首例兽用活疫苗中污染副流感病毒5型的检测
2019-01-09吴华伟秦义娴陈晓春曹明慧林梓栋
吴华伟,秦义娴,陈晓春,曹明慧,林梓栋,邓 永,刘 丹
(1.中国兽医药品监察所,北京 100081;2.广东永顺生物制药股份有限公司,广州 010030)
副流感病毒5型(Parainfluenza virus 5,PIV5)为单股负链不分节段RNA病毒,属于副黏病毒科(Paramyxoviridae)。1954年首先在原代猴肾细胞中发现猴病毒5型(Simian virus 5,SV5)[1]。不同宿主可分离到该病毒,如人类、猪、牛、犬、猫、虎和小熊猫等[1-3]。我国近几年陆续报道在牛群和猪体中也检测出PIV5[4-5]。近期,在对某企业送检的猪伪狂犬活疫苗进行外源病毒检验时发现疑似血凝性外源病毒污染,经病原学和分子生物学验证,证实该批产品污染了PIV5,这也是国内外首次报道生物制品中污染了PIV5。此外,还对我国现有主要的猪用病毒类活疫苗中污染PIV5的情况进行了摸底检测,以期为加强兽用疫苗中PIV5污染的预防和控制提供数据参考。
1 材料与方法
1.1 材料
1.1.1 疫苗、细胞与血清 猪伪狂犬病活疫苗,某公司产品;Vero细胞和猪伪狂犬病特异性阳性血清,均由中国微生物菌种保藏管理委员会兽医微生物中心提供;PIV5特异性阳性血清,由中国兽医药品监察所病毒室制备。
1.1.2 主要试剂 DMEM营养液 ,Gibco公司产品;胎牛血清,PAN公司产品;Ex-Taq酶,宝生物工程(大连)有限公司产品;Trizol,Invitrogen公司产品;IPTG、X-gal,购自北京索莱宝科技有限公司;DNA凝胶回收试剂盒,购自天根生化科技(北京)有限公司;T载体和感受态细胞,购自Tansgen公司;PIV5单克隆抗体,购自USbiological公司;羊抗小鼠IgG FITC,购自Sigma公司。
1.1.3 主要仪器 PCR仪、电泳仪、紫外成像仪、倒置荧光显微镜(莱卡)等。
1.2 方法
1.2.1 样品的处理与接种 按《中国兽药典》三部附录3305进行[6]。随机取疫苗3瓶,同批疫苗混匀后,2000~3000 g离心10 min,取上清液加入等体积猪伪狂犬病阳性血清,37 ℃中和作用1 h,接种已长成良好单层的Vero细胞(75 cm2),3 mL/瓶,37 ℃孵育1 h,补加含2%胎牛血清的DMEM维持液至10 mL。置37 ℃ 5%二氧化碳的培养箱培养5 d,每天观察CPE。
1.2.2 F3 代培养物HA效价测定 按1.2.1进行培养,继代3次后,3000 r/min离心15 min后,取上清液用PBS(0.1 mol/L,pH 7.0~7.2)作2倍系列稀释,加入0.5%鸡红细胞悬液,混合均匀后,置37 ℃孵育 20~40 min,进行HA效价判定,同时设立红细胞对照。当细胞对照孔的红细胞呈显著纽扣状时判定结果,以使红细胞完全凝集的最高稀释度作为判定终点。
1.2.3 病毒分离 按1.2.1进行培养,如此盲传5代,如出现CPE,且经RT-PCR检测结果为阳性,则视为病毒分离阳性;如无CPE,且经RT-PCR检测结果为阴性,则视为病毒分离阴性。如无CPE,且经RT-PCR检测结果为阳性,则继续盲传继代。
1.2.4 病毒含量测定 将1.2.3病毒分离株F10代细胞培养物,3000 r/min离心15 min,取上清液用不含血清的DMEM营养液进行10倍系列稀释,取10-1~10-88个稀释度,每个稀释度接种8孔已长成vero细胞单层的96孔细胞板,每孔0.1 mL,37 ℃吸附1 h,补加2%胎牛血清的DMEM营养液培养5 d,同时设正常细胞对照,以PIV5单克隆抗体作为一抗(工作浓度1∶200),以羊抗小鼠IgG FITC作为二抗(工作浓度1∶100)进行间接荧光染色,判定是否感染,按Reed-Muench法计算TCID50。
1.2.5 分离株F10代细胞培养物HA效价测定 将1.2.3病毒分离株F10代细胞培养物,按1.2.2方法进行HA效价测定。
1.2.6 纯净性检测 将1.2.3病毒分离株F10代细胞培养物,按照《中国兽药典》2015年版三部附录方法[6]分别进行无菌检验、支原体检验和外源病毒检验。
1.2.7 特异性检测
1.2.7.1 间接荧光抗体检测 将毒种用DMEM营养液稀释为100 TCID50/0.1 mL,接种96孔板单层Vero细胞各8孔,每孔100 μL,同时设立正常细胞对照8孔。接种后在37 ℃下吸附1 h,再补加含2%新生牛血清的DMEM维持液100 μL,置37 ℃二氧化碳培养箱培养96 h,采用间接荧光抗体法判定结果。
1.2.7.2 RT-PCR检测 根据GenBank上PIV5相关序列,设计针对L蛋白的一对引物:上游引物:5′-CGCCAGCAACAATTACTACC-3′;下游引物:5′-ACAACCCTAATGGGCGTAAC-3′。引物由北京六合华大基因科技股份有限公司合成,预期片段为277 bp。
按病毒基因组RNA提取试剂盒说明,从分离毒株的细胞培养液中提取RNA。按一步法RT-PCR试剂盒说明书进行检测,反应体系为:模板5 μl,上游引物和下游引物(25 μmol/L)各1 μL,PrimeScript 1 step Enzyme Mix 1 μL,2×1 Step buffer 12.5 μL,RNase Free dH2O 4.5 μL,混匀后瞬离。反应条件为:50 ℃ 30 min,94 ℃ 2 min,94 ℃ 30 s,50 ℃ 40 s,72 ℃ 30 s,35个循环;72 ℃ 5 min;最后4 ℃保温。用1.5%琼脂糖平板(溴化乙铵终浓度0.5 μg/mL)凝胶电泳检测PCR扩增结果。
1.2.7.3 基因序列测定 将1.2.6.2的 PCR产物目的片段的凝胶块切下后,按商品化DNA凝胶回收试剂盒说明书进行DNA回收,克隆到pMD18-T载体上,送北京六合华大基因科技股份有限公司进行序列测定,然后与GenBank中已发表的8株PIV5序列进行同源性比较。采用的PIV5毒株信息见表1。
水力压裂技术产生的裂缝长度通常可达100 m,宽度和长度分别为0.01 m和1 m。为了对油层进行分布式测量,微纳传感节点混在携砂液中(含石英砂)随压裂进程进入裂缝,其在裂缝中的位置因而是随机分布的[4]。体积和功率较大的锚节点通常布置于井筒内部,由外部电源供电,可直接与裂缝内的传感器节点进行磁感应通信,锚节点同时通过磁感应方式为传感节点提供电能;微纳尺寸的传感器节点具有全向线圈天线,同时配置超级电容器储存耦合电能。考虑到供电及传感器通信能力等因素,在面向油藏裂缝的地下无线传感网络中,锚节点和传感节点之间通信(下行链路)是单跳方式,传感节点与锚节点之间通信(上行链路)采用多跳方式[5]。
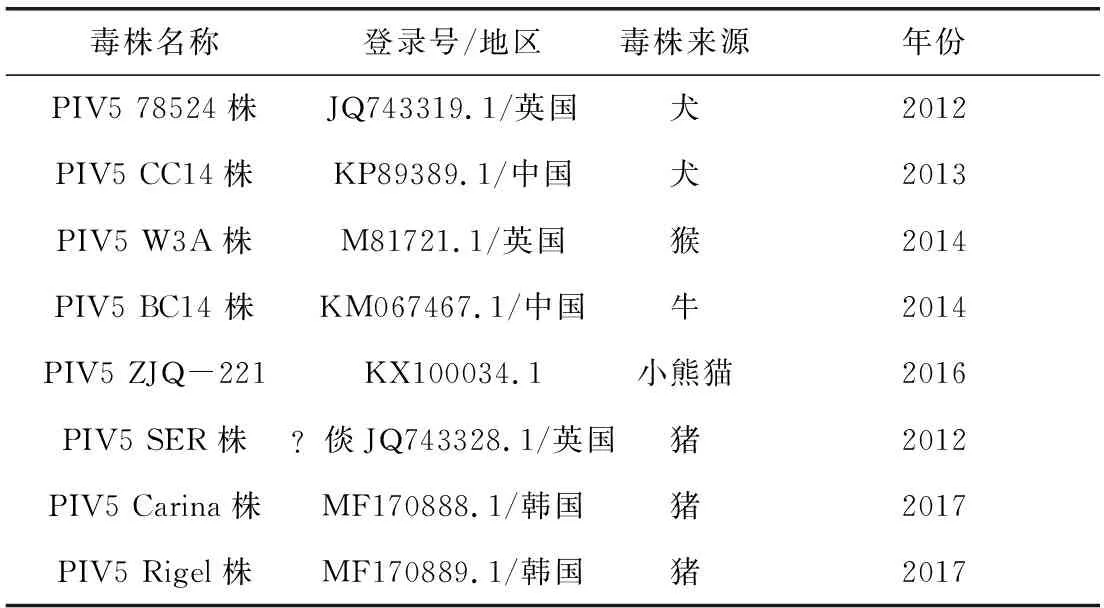
表1 序列分析用PIV5参考毒株Tab 1 PIV5 reference strains for sequence analysis
1.2.8 猪用活疫苗中污染PIV5情况摸底检测 随机选取30批猪用活疫苗(其中猪繁殖与呼吸综合征活疫苗20批,猪瘟活疫苗10批),按照1.2.6.2方法进行RT-PCR检测,分析现有猪用活疫苗中污染PIV5情况。
2 结果与分析
2.1 样品F3代HA效价测定 经测定,以使0.5%红细胞完全凝集的最高稀释度作为判定终点,PIV5 F3代培养物HA效价为1∶16(图1),而正常Vero细胞上清液和鸡红细胞对照均沉淀。

1:Vero细胞培养物上清液; 2、3: PIV5 F3代培养物;4:0.5%红细胞对照1:The supernatant of normal Vero control;2 and3:The fifth generation PIV5; 4:0.5% chicken red cell suspension control图1 PIV5 F3代细胞培养物HA效价测定Fig 1 The HA titer result of the third generation PIV5
2.2 病毒分离及RT-PCR结果 将样品在Vero细胞上连续传5代后,可发现细胞出现颗粒增多、圆缩、聚集等CPE(图2),而细胞对照正常。用设计的特异性引物,对分离培养物F5代进行RT-PCR,可扩增出277 bp的目的片段(图3),扩增结果清晰、无杂带,而Vero细胞对照和阴性对照均无任何条带。

A: PIV5 F5在Vero细胞上产生CPE;B: Vero细胞对照A: CPE appeared on Vero cell infected with the fifth generation PIV5;B:Normal Vero control图2 PIV5 适应Vero细胞病变(10×)Fig 2 The CPE of Vero infected with PIV5(10×)
M:蛋白分子量标准;1: Vero细胞的PCR产物;2: PIV5 F5代培养物的PCR产物; 3: 阴性对照M:Protein Marker;1: PCR result of Normal Vero control;2: PCR result of the fifth generation PIV-5;3: PCR result of negative control图3 PIV5 F5代细胞培养物PCR鉴定Fig 3 The PCR result of the fifth generation PIV5
2.2 病毒含量及HA效价测定结果 经测定,PIV5 F10代培养物病毒含量为107.0TCID50/mL;以使0.5%红细胞完全凝集的最高稀释度作为判定终点,BPIV-5 F10代培养物HA效价为1∶256(图4),而Vero细胞对照上清液和鸡红细胞对照均沉淀。
1、2:PIV-5 F10代培养物;3:Vero细胞培养物上清液;4:0.5%红细胞对照1 and 2:The fifth generation PIV5;3:The supernatant of normal Vero control; 4:0.5% chicken red cell suspension图4 PIV5 F10代细胞培养物HA效价测定Fig 4 The HA titer result of the 10th generation PIV5
2.3 纯净性检测 按照2015年版《中国兽药典》三部附录方法进行无菌检验、支原体检验和外源病毒检验,结果为无菌生长、无支原体生长和无外源病毒污染,说明该分离毒株纯净性良好。
2.4 特异性检验
2.4.1 IFA检测 将分离的PIV5培养物在Vero细胞上培养96 h,然后以PIV5 单抗为一抗(工作浓度1∶200),以羊抗鼠IgG FITC二抗(工作浓度1∶100)进行染色,在感染细胞的胞浆可观察到典型的绿色荧光(图5 A),而细胞对照未出现绿色荧光(图5B)。
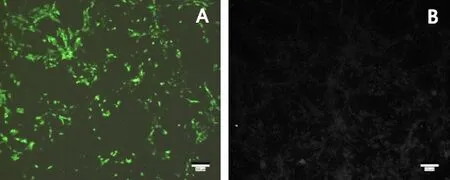
A:PIV5感染Vero ;B:Vero对照A: Virus infected Vero cell;B: Vero cell control图5 IFA染色结果(10×) Fig 5 The result of IFA(10×)
2.4.2 RT-PCR结果 用设计的特异性引物,对分离培养物F10代进行RT-PCR,可扩增出277 bp的目的片段(图6),扩增结果清晰、无杂带,而Vero细胞对照和阴性对照均无任何条带。
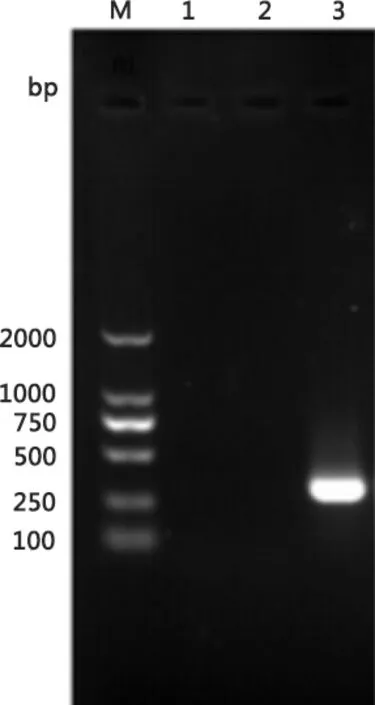
M:蛋白分子量标准;1: 阴性对照;2:Vero细胞的PCR产物;3: PIV5 F10代培养物的PCR产物M:Protein Marker;1: PCR result of negative control 2: PCR result of normal Vero control3: PCR result of the tenth generation PIV5图6 PIV5 F10代细胞培养物的PCR鉴定Fig 6 The PCR result of the tenth generation PIV5
2.4.3 基因序列测定 将所测的目的片段与GenBank中已发表的8株PIV5 的L基因序列进行同源性比较,同源性为93.1%~97.4%(图7)。其中与我国分离的来自小熊猫的PIV5 ZJQ-221株(登陆号:KF100034.1)同源关系最近,为97.4%;其次与犬源、猴源、牛源的PIV5同源性均在95.5%以上,与猪源的PIV5同源性为93.3%~95.9%,同源性均较高。基因序列系统进化树分析结果显示同样的结果(图8)。
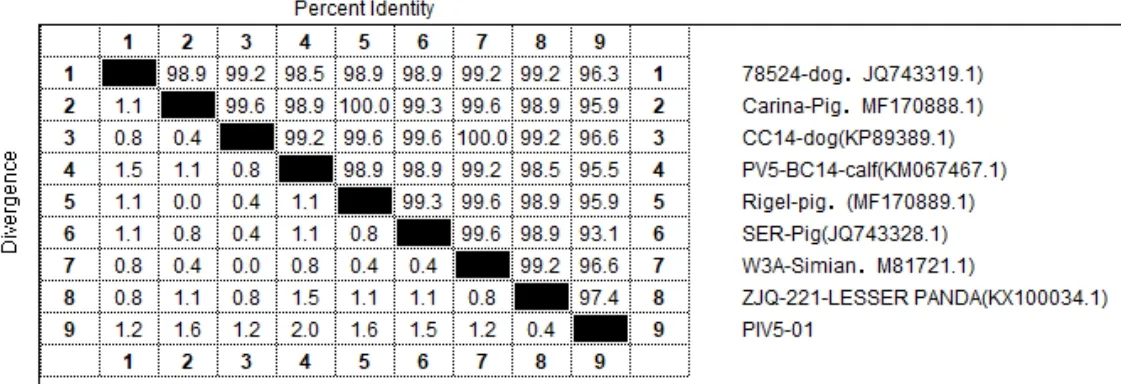
图7 PIV5/01株与GenBank中L基因序列同源性比较结果Fig 7 Homology analysis between PIV5 and the sequences from GenBank

图8 PIV5/01株与GenBank中PIV5基因序列系统进化树Fig 8 Phylogenetic analysis of PI-5 and sequences from GenBank
3 猪用活疫苗中污染PIV5情况检测结果
经对30批猪用病毒类活疫苗进行PIV5污染情况调查,共检出5批阳性样品(图9),阳性率为16.7%(5/30),其中猪繁殖与呼吸综合征活疫苗检出3批,阳性率为10%(2/20);猪瘟活疫苗检出3批,阳性率为30%(3/10),显示现有猪用活疫苗PIV5污染风险较高。
4 讨论与结论
据报道,PIV5可以感染包括人类细胞在内的多种细胞,且在大多数细胞中均可获得高滴度的病毒,其中对Vero细胞最为敏感,培养滴度可高于1010PFU/mL[7]。此外,PIV5感染的细胞也具有较好的红细胞吸附作用和红细胞凝集作用,可凝集豚鼠、鸡、猴等的红细胞,尤其以4 ℃对鸡红细胞的血凝效价最高[8]。采用Vero细胞进行猪伪狂犬活疫苗中污染PIV5的分离,并采用鸡红细胞进行HA效价测定。结果显示,样品经特异性猪伪狂犬阳性血清中和后,连续继代5代,即可出现颗粒增多、圆缩、聚集等CPE,且其F10代培养物的病毒含量和HA效价测定分别达到107.0TCID50/mL和1∶256,显示出良好的细胞适应性。特异性检测结果显示:采用PIV5单克隆抗体作为一抗进行IFA检测,可在PIV5感染的Vero细胞的胞浆中观察到典型的绿色荧光,这与文献[9]报道的PIV5生命周期中不存在DNA阶段,只在感染细胞的胞浆中增殖相吻合。RT-PCR可扩增出预期大小的目的片段;序列比对结果显示与GenBank中已发表的8株PIV5 的L蛋白序列同源性为93.1%~97.4%,其中与我国分离的来自小熊猫的PIV5 ZJQ-221株(登陆号:KF100034.1)同源关系最近,为97.4%;与犬源、猴源、牛源的PIV5同源性均在95.5%以上,与猪源的PIV5同源性为93.3%~95.9%,均呈现较高的同源性,系统进化树分析也显示同样的结果。以上病原学和分子生物学结果均证实,从某企业送检的猪伪狂犬活疫苗中检出疑似血凝性外源病毒为PIV5。

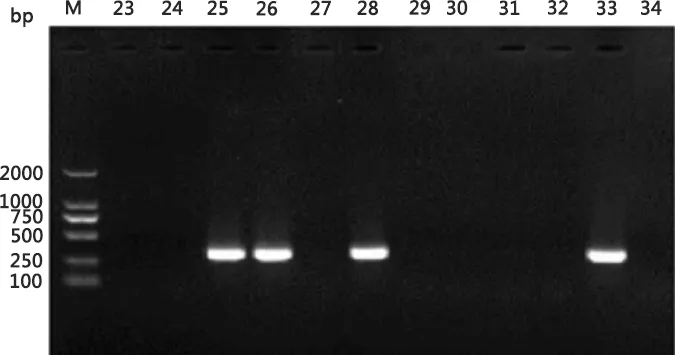
M:蛋白分子量标准;1-20:20批次PRRSV活疫苗样品;23-32:10批次CSFV活疫苗样品;21、33:PIV5/01株阳性对照;22、34: 阴性对照M:Protein Marker;1-20:20 batches of PRRSV live vaccines;21-32:10 batches of CSFV live vaccines;21、33:PCR result of positive control;22、34:PCR result of negative control图9 PRRSV和CSFV活疫苗中PIV5污染情况检测Fig 9 The PCR result of PRRSV and CSFV live vaccines
PIV5可感染不同的宿主,我国近几年也陆续有犬、猴、小熊猫、牛群和猪群中分离到PIV5的报道[2-5]。目前,除犬副流感病毒5型可引起犬呼吸系统或感染性支气管炎外,陆续也有PIV5疑似可引起其他动物发病的报告。Heinen E等[10]2008在德国一例PRRSV共感染的样品中分离出一株PIV5(SER株),2011年Yu Na Lee等[11]从韩国出现呼吸症状猪的肺脏样品中分离出KNU-11株PIV5 2015年Liu等[4]曾报道,在吉林省白城牛场死于呼吸困难和间质性肺炎的犊牛肺组织中分离到一株与猪源KUN-11和SER株高度同源的PIV5(PIV5-BC14株),由于在健康牛中未检测到PIV5,他们据此推测犊牛的疾病很有可能是由PIV5-BC14株引起的。2018年Ning Jiang等[5]从中国4个省(市)腹泻相关猪群的肠道组织中分离到5株与中国分离的小熊猫源ZJQ-221株和韩国分离的犬源1168-1株高度同源的PIV5,但未揭示分离株是否是引起腹泻的病原。尽管尚未看到除犬之外PIV5能引起其他物种(如人、猪、牛等)致病的明确报道,但PIV5感染的潜在威胁需引起充分重视。从对国内主要猪用活疫苗(以猪繁殖与呼吸综合征活疫苗和猪瘟活疫苗为代表)PIV5 污染状况的初步检测结果看,PIV5污染的阳性率约为16.7%,提醒我们必须高度重视兽用疫苗中PIV5 污染的风险,并尽快采取必要措施加以预防和控制。对于兽用疫苗中污染PIV5,推测其主要原因可能有两个:一是由于目前我国猪群、牛群等动物中存在PIV5污染,因此来源于感染或隐性感染动物或组织制备的细胞或分离的毒种存在较大的PIV5污染风险,使用它们进行疫苗生产有可能造成终产品PIV5污染;二是鉴于目前我国兽用生物制品使用的牛血清、胰酶、培养基、原代细胞(或传代细胞)等生产用原辅材料的质量控制标准不够全面或部分缺失(如缺少胰酶、DMEM等动物细胞用培养基的质量标准),造成生产用原辅材料质量控制严重缺位,从而可以通过生产环节进入疫苗成品。从兽用生物制品生产过程看,种毒(特别是新分离的野毒株)、细胞、胰酶(猪源或牛源)、牛血清等基础物质和材料是目前我国兽用生物制品外源病毒污染的主要风险点[12],任何一种材料或几种材料污染,都有可能造成终产品疫苗中污染PIV5。至于本次兽用疫苗中PIV5污染的主要原因,尚需进一步进行试验验证。
