能量耦合存在于产甲烷菌甲基辅酶M还原酶MCR活化过程
2019-01-09周玉珍徐建明
周玉珍, 汪 伟, 金 皓, 姚 萍, 徐建明
(淮阴师范学院/江苏省环洪泽湖生态农业技术重点实验室,江苏淮安 223300)
产甲烷菌转化厌氧发酵的产品(如氢气、二氧化碳、甲醇、甲酸和乙酸)为甲烷[1-2],同时除去生物氧化代谢过程中形成的氢气(H2),从而促进复杂的有机化合物(如木质素,纤维素等)的降解。因此产甲烷菌在碳循环中发挥着关键的作用[3]。甲烷生成途径非常复杂,大多数的步骤涉及很多产甲烷菌新颖独特的辅因子[4-6]。产甲烷菌可以转化各种一碳化合物为甲烷,底物不同,所用的甲烷生成途径也不同(图1) 。这3种途径只有最后一步催化反应共享,该反应由甲基辅酶R还原酶(MCR)催化。由于MCR在产甲烷菌Methanothermobactermarburgensis细胞内表达量很高(约占细胞总蛋白量的10%),MCR是第1个被纯化的明确显示参与甲烷生产途径的酶[7-9]。它催化甲烷生成途径中的最后一步,同时也是甲烷生成途径中速率限制的一步。因此研究MCR的机理是研究产甲烷菌来人为抑制或加快其甲烷生成途径的最有效方法。
MCR是一种含镍的酶,它的催化作用需要产甲烷菌独有的辅酶F430(镍四吡咯)。MCR将甲基辅酶M(CH3-SCoM)、辅酶B(CoBSH)转化为甲烷(CH4)和辅酶M与辅酶B的杂二硫(CoBS-SCoM),如公式(1)所示[10-11]。

CH3-SCoM+CoBSH→CH4+CoBS-SCoM;ΔG′=-30 kJ/mol。
(1)
MCR的辅酶F430有很低的氧化还原电势(<-600 mV),而其活性状态是还原状态(镍为+1价),细胞的培养液中只能加入氧化态的镍(+2价),因此在体内肯定存在二价镍还原的过程,即MCR的活化过程。如果没有添加强还原剂和辅酶HSCoM,以及对细胞进行特殊的处理,裂解细胞将导致99%以上的MCR失去活性[12]。由于不能得到活性蛋白将无法研究其催化机理,因此研究MCR活化机理是研究其催化机理的首要条件。
研究显示在细胞悬浮液中加入MCR的一个底物CH3—SCOM(或HSCoM)和柠檬酸钛(Ⅲ)(Ti(Ⅲ)citrate,氧化还原电势约-700 mV),并在破碎细胞前对悬浮细胞进行通H2处理可以活化MCR[13]。H2/H+的氧化还原电势(Eθ)约为 -420 mV,这个电势远远高于MCR辅助因子的氧化还原电势(<-600 mV)[9]。氢气是如何活化MCR的,至今还是一个谜。由于CO/CO2的氧化还原电势(-520 mV)比H2/H+低,CO能更快、更有效地还原MCR,而且其重复性好[9]。一般来说,由于H2/H+(-420 mV)和CO/CO2的氧化还原电势(-520 mV)均高于MCR的辅酶F430的氧化还原电势(<-600 mV),CO和H2是不可能还原MCR的。
2H++2e-→H2;Eθ=-0.42 V;
(2)
CO2+2H++2e-→CO;Eθ=-0.52 V;
(3)
CO2+2H++2e-→HCOOH;Eθ=-0.43 V。
(4)
在1988年,Bobik和Wolfe发现甲烷菌可以利用CO2和H2合成甲烷,细胞破碎液不能利用CO2和H2合成甲烷,然而在细胞破碎液里添加CoMS-SCoB就可以利用CO2和H2合成甲烷,并称这种现象为RPG效应[14]。后来他们发现在细胞破碎液里添加CH3-SCoM、富马酸盐(fumarate)、丝氨酸也可以使细胞破碎液利用CO2和H2合成甲烷[15-17]。在2008年,Thauer等首次提出用生物体内生物能量耦合现象来解释这个谜[18]。这种能量耦合利用放能过程来推动吸能过程。随后Kaster等和Costa等先后证实了这种能量耦合存在于这种远古的产甲烷菌中,并推测生命的起源可能就是利用能量耦合而出现的[19-20]。Kaster等发现了在产甲烷菌中MvhADG/HdrABC复合物能耦合H2还原铁氧化还原蛋白Fd(氧化还原电势为-450~-500 mV)的吸能反应和H2还原CoBS-SCoM的放能反应[19]。
由于MCR的辅酶F430氧化还原电势极低(<-600 mV),H2和CO是如何还原MCR的,这里笔者猜测H2和CO还原MCR的过程中也存在上述能量耦合反应。本研究从几个方面证实了这一猜想。
1 材料与方法
1.1 生化试剂、混合气体和产甲烷菌的生长
所有的缓冲溶液、培养基和试剂都订购于阿拉丁试剂(上海)有限公司,除非额外说明,均买分析纯及以上的纯度。溶液都采用超纯水配制。液氮、N2(99.98%)、CO(99.99%)、H2/CO2(80%和20%)和超高纯H2(99.999%)购于江苏淮安瑞丰气体有限公司。还原剂柠檬酸钛(Ⅲ)是通过在30%(质量百分比)的TiCl3溶液里添加柠檬酸钠,并将pH值调至7.0配制而成[8]。柠檬酸钛(Ⅲ)的浓度通过甲基紫精滴定测量[8]。产甲烷菌Methanothermobactermarburgensis(原称M.thermoautophicumstrain Marburg)来自美国密西根大学Stephen W. Ragsdale实验室。产甲烷菌M.marburgenesis的培养基按照以前的配方配制[8],需要时在培养基中添加不同浓度的钨酸钠和硒酸钠来调节培养基中钨和硒的浓度。产甲烷菌培养于65 ℃、10 L 发酵罐中,并用 H2/CO2(80%/20%)作为还原剂和碳源。
1.2 体内活化MCR
所有溶液都是在严格厌氧条件下(氧气<1 mg/L)的无氧操作台里配制,并在无氧操作台内保存7 d以上才使用。厌氧操作台的厌氧通过维持约9.0 kPa的氮气来实现。M.thermautotrophics按照之前发表文章的方法用H2/CO2培养[7]。在回收细胞之前,在发酵罐通H230 min以活化MCR。然后,在无氧条件下离心回收细胞,并将细胞转移到无氧操作台。在无氧操作台内将细胞重悬于50 mmol/L Tris,pH值为7.6,加入10 mmol/L HSCoM、0.1 mmol/L 柠檬酸钛(Ⅲ),并分装到150 mL的无氧血清瓶中[7,21]。用CO或H2体内活化MCR时,在重悬细胞分装好后,立即在其顶部橡皮封口上通过针头给血清瓶顶部空间通气(CO或H2)10 min。为了使溶液中的气体平衡,通气过程中每2 min摇动血清瓶几下。通气结束后保存血清瓶内约10.3 kPa的气压。随后每次取样之前也进行同样的通气操作。每次通气结束后,血清瓶倒置于无氧操作台内的25 ℃的水浴锅内以减少气体流失[8]。通H2是在无氧操作台内完成的;出于安全考虑,通CO是在无氧操作台外的通风橱里完成的。为了监测MCR是否被活化及其活化的程度,于不同时间在无氧操作台内从血清瓶内取 200 μL 样品于EPR试管中,并在无氧操作台内用液氮迅速冷冻样品后才移到无氧操作台外的液氮罐中保存以备后续电子顺磁共振光谱(EPR谱分析,EPR spectroscopy)检测。
用甲酸盐(formate)体内活化MCR时,采用上述相同的步骤,只是在细胞重悬液中添加不同浓度的formate(formate的添加并没有改变缓冲液的pH值)来取代上述通气。
1.3 体外活化MCR
在体外活化MCR时,使用上述方法培养、回收和在无氧操作台内重悬细胞,并用JY92-2D超声波细胞破碎机冰浴破碎细胞。设置超声功率为220 W,超声总时间为10 min,每次辐射时间为10 s,间隔时间为30 s。细胞破碎完毕的混合液用作细胞破碎液。细胞破碎液在无氧操作台内用离心机在4 ℃、35 000g离心30 min后,取上清液。用H2或CO在体外(细胞破碎液或上清液)活化MCR的操作步骤和上述体内活化MCR相同。在检测fumarate和CH3-SCoM对H2和CO体外活化MCR的作用时,在细胞破碎液或上清中直接加入fumarate和CH3-SCoM到所需浓度。
1.4 甲酸脱氢酶的酶活性测定和MCR的EPR波谱分析
甲酸脱氢酶的酶活性测定和MCR的EPR波谱分析是严格按照参考文献[9]完成。
2 结果与分析
2.1 金属离子钨和硒能提高氢气活化MCR的效果
MCR的活化最初是通过在细胞重悬液中通H2而实现的[22]。2013年,笔者研究发现,CO由于具有更低的氧化还原电势,能够更有效地活化MCR;然而CO2/COOH有着与2H+/H2相似的氧化还原电势却不能活化MCR[9]。在甲烷2种形式的甲酸脱氢酶中,一种以钼为活性中心,一种以钨为活性中心,2种甲酸脱氢酶都有硒代半胱氨酸作为金属活性中的一个配体。然而2013年笔者在甲酸钠活化MCR时,培养甲烷菌的培养基里没有添加钨和硒[9],本研究检测发现添加钨和硒能使甲酸活化MCR。
为了检测在培养基中添加钨和硒能否提高甲酸脱氢酶的活性,从而使甲酸能够活化MCR,在培养基中分别添加0.1、0.3、0.6、0.9、1.1、1.5、2.0、4.0、6.0 μmol/L的钨和硒,回收细胞之后,通过在细胞重悬液中添加0.1 mol/L或 0.5 mol/L 的甲酸钠来活化MCR。试验结果显示30 h内 0.1 mol/L 或0.5 mol/L的甲酸盐并不能活化MCR(添加 0.6 μmol/L 钨和1.1 μmol/L硒的试验数据)(图2)。本研究检测添加钨和硒后甲酸还原酶的活性发现,在培养基中添加不同浓度的钨和硒并没有提高甲酸还原酶的活性[9]。当用NADP+和甲基紫精(MV)作为电子受体时,甲酸还原酶的活性还是分别为3~4 、2~3 mU/mg。CO2/COOH与2H+/H2虽然有相似的氧化还原电势,但是M.marburgenesis体内氢化酶的活性是甲酸还原酶的20 000倍[9]。因此甲酸不能活化MCR很有可能是由于M.marburgenesis体内甲酸还原酶的活性太低。

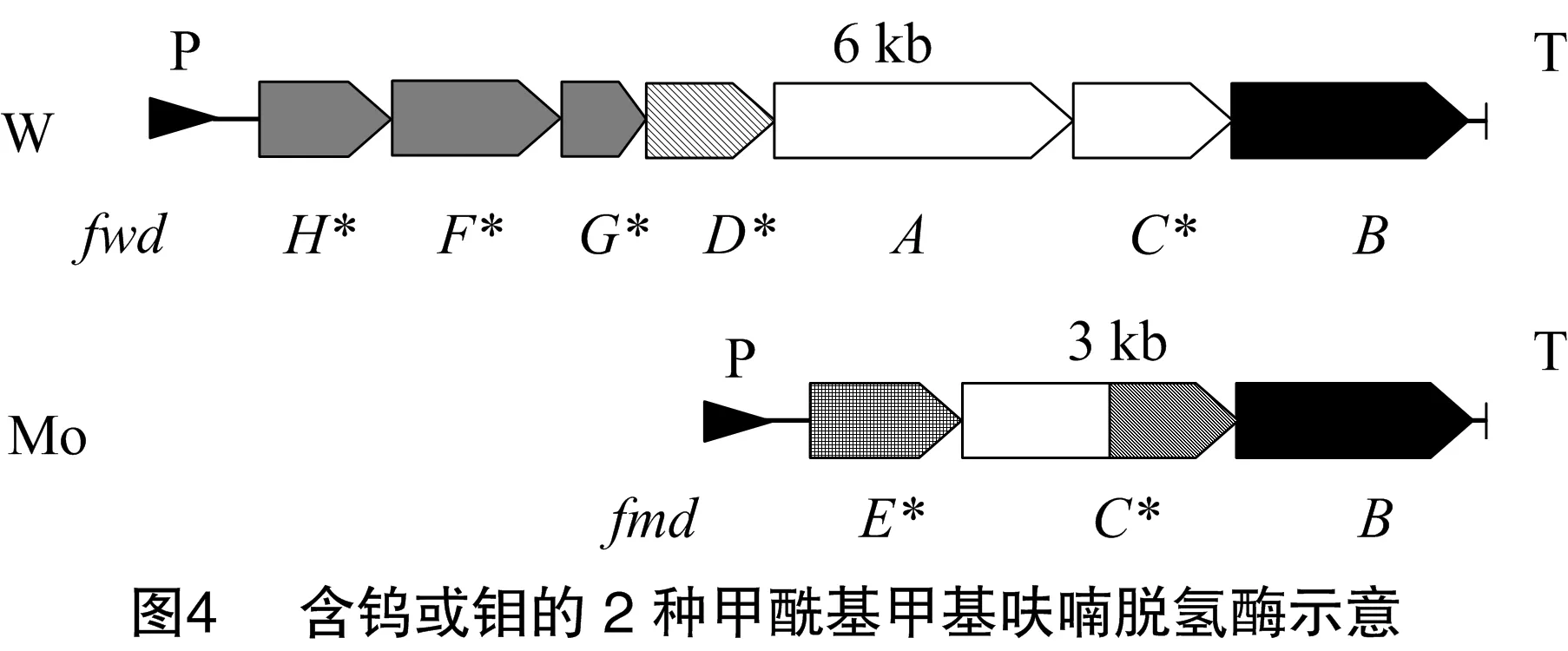
研究发现,添加钨和硒虽然不能使甲酸盐活化MCR,却能提高H2活化MCR的效果约65%,加快H2活化MCR的速度8倍(72 min和8 min),并且使得H2活化MCR没有了滞后期。钨和硒能如此有效地提高H2活化MCR的效果确实令人惊讶。然而Thauer等发现,甲烷合成途径中由甲酰基甲基呋喃脱氢酶催化的CO2和H2合成甲酰基甲基呋喃的吸能反应和由异二硫还原酶催化的异二硫CoMS-SCoB和H2合成SHCoM和CoBSH的放能反应通过能量耦合完成(图3)[18]。由于甲酰基甲基呋喃脱氢酶在甲烷菌种也有2种形式的酶,分别以钼和硒或钨和硒为活化中心(图4)。因此添加钨和硒很有可能大大提高了甲酰基甲基呋喃脱氢酶(催化甲烷合成途径的第1步反应)的活性,从而加快了以氢化酶为媒介的由甲酰基甲基呋喃脱氢酶催化的吸能反应和由异二硫还原酶催化的放能反应之间的能量耦合反应,证实了能量耦合反应存在于H2活化MCR的吸能过程中。

在M.marburgenesis的细胞破碎液中添加CH3-SCoM、CoBS-SCoM使得其细胞可缓慢利用CO2合成甲烷[15,17]。这一现象被称为RPG效应,其实质是CH3-SCoM、CoBS-SCoM的加入使得甲酰基甲基呋喃脱氢酶催化的吸能反应和由异二硫还原酶催化的放能反应之间的能量耦合反应成为可能[14]。后来发现在M.marburgenesis的细胞破碎液中添加fumarate和丝氨酸(serine)也可以使细胞缓慢地利用CO2合成甲烷,而且证实这也是能量耦合反应的结果[15]。Kaster等发现甲烷合成途径中由甲酰基甲基呋喃脱氢酶催化的CO2和H2合成甲基呋喃和水的吸能反应和由异二硫还原酶催化的异二硫CoMS-SCoB和H2合成CoMSH和CoBSH的放能反应通过能量耦合完成[19]。而且只有CoBS-SCoM存在的条件下H2才能还原铁氧化还原蛋白。因此推测类似于RPG效应的能量耦合反应存在于H2活化MCR的吸能过程中。
图3引自文献[19]。短横线部分显示氢化酶(MvhADG)通过铁氧化还原蛋白(Fd)能量耦合由甲酰基甲基呋喃脱氢酶催化的甲烷合成途径的第1步。
2.2 CH3-SCoM,fumarate使H2能在体外活化MCR
就像细胞破碎液在没有添加可以进行能量耦合反应的小分子时不能利用CO2合成甲烷一样,H2也不能在细胞破碎液或上清中活化MCR。为了证实类似于RPG效应的能量耦合反应是否存在于H2活化MCR的吸能过程中,在细胞破碎液或上清中添加fumarate或CH3-SCoM。由于金属离子钨和硒能提高氢气活化MCR的效果,在此试验过程中,细胞培养时其培养基中添加了0.6 μmol/L钨和 1.1 μmol/L 硒。本研究发现,在细胞破碎液中添加10 mmol/L fumarate和 10 mmol/L CH3-SCoM时,能使H2在细胞破碎液中活化MCR,其MCR的活化程度分别为体内活化的48%、34%;在上清中添加10 mmol/L fumarate和10 mmol/L CH3-SCoM时,也能使H2在上清中活化MCR,其MCR的活化程度分别为体内活化的29%、27%(图5)。
2.3 CH3-SCoM、fumarate使CO体外活化的MCRred1更稳定
不像H2、CO能在体外活化MCR。CO在细胞破碎液和上清中活化MCR的程度分别为体内活化的41%、16%,然而CO体外活化的MCR不稳定,4 h后活化的MCR开始失活,但是细胞破碎液或上清中添加10 mmol/L fumarate和 10 mmol/L CH3-SCoM可以使得体外CO活化的MCR更稳定,20小时左右未见MCR失活(图6)。
3 结论与讨论
建立一种有效活化MCR的方法对研究甲烷天然合成机理相当关键,因为MCR催化甲烷是天然合成途径中速率限制的一步[8]。目前为止,MCR的活化只能通过体内H2或CO活化完成,因为CO/CO2有着更低的氧化还原电势,其活化效果优于H2。然而理论上来说,H2和CO都不能活化MCR,因为两者的标准氧化还原电势都高于MCR辅酶F430中心的 Ni(Ⅰ) 的标准氧化还原电势。


本研究发现,在培养基添加钨和硒可以加快H2活化MCR的速度8倍,提高H2活化MCR的效率约65%。经过分析发现,钨和硒的加入很有可能提高了甲酰基甲基呋喃脱氢酶酶活性,因而提高了以氢化酶为媒介的由甲酰基甲基呋喃脱氢酶催化的吸能反应和由异二硫还原酶催化的放能反应之间的能量耦合反应,证实了能量耦合反应存在于H2活化MCR的吸能过程中。
产甲烷菌可以还原CO2合成甲烷,然而人们发现其细胞破碎液只有在添加CH3-SCoM、CoBS-SCoM、fumarate等小分子时才能还原CO2合成甲烷,这一现象在当地被称为RPG效应[23-24]。后来人们发现这种RPG效应是因为CH3—SCoM、CoBS-SCoM、fumarate等小分子的加入使得甲酰基甲基呋喃脱氢酶催化的吸能反应和由异二硫还原酶催化的放能反应之间的能量耦合反应成为可能,才使得甲烷合成途径得以进行[19,25-26]。这种RPG效应与H2活化MCR非常相似,H2可以在体内活化MCR,而不能再体外活化MCR。为了证实RPG效应的这种能量耦合是否也存在于H2或CO活化MCR的过程中,本研究在体外活化MCR时添加了CH3—SoM或fumarate,结果发现体外活化MCR时添加了CH3—SoM或fumarate使H2能够在体外活化MCR(为体内活化MCR的30%~40%),让CO体外活化的MCR更稳定。这都说明H2和CO活化MCR的过程中存在能量耦合反应,正是这种能量耦合反应使得氧化还原电势较高的H2(-420 mV)和CO(-520 mV)能还原氧化还原电势较低的MCR的活性中心F430(<-600 mV)。
