黄花蒿水浸液对赤豆种子萌发及幼苗生长的化感效应
2019-01-09张曲玲杨占南罗世琼霍鸿浩
张曲玲, 杨占南, 罗世琼, 霍鸿浩, 赵 铖, 扶 蝶, 杨 娟
(1.贵州师范大学生命科学学院,贵州贵阳 550001; 2.贵州省山地环境信息系统与生态环境保护重点实验室,贵州贵阳 550001;3.贵阳中医学院药学院,贵州贵阳 550001)
黄花蒿(ArtemisiaannuaL.)广泛分布于我国及世界各地,是传统的药用植物,富含萜类、酚类、类黄酮及其他代谢物,民间用于治疗多种疾病,如抗疟疾、抗炎、止血等[1-3]。研究显示,黄花蒿还具有其他药效功能,如具有抗癌细胞活性[4]以及抑制艾滋病毒的作用[5]。黄花蒿是青蒿素的唯一原料来源,因此,我国特别是西南部重庆等地将黄花蒿作为重要的主要经济作物[6-7]。但因为它对环境具有广泛的适应性,且耐贫瘠,往往是裸露新地的先锋植物[8],大面积栽培或大量聚集生长会对周围植物或当季及后茬作物产生化感效应[9-12]。目前,已经发现受黄花蒿化感影响的植物有燕麦、小麦、蒲公英、黄瓜、萝卜[13]、豇豆、菜豆、白菜、大白菜[9]、灰菜、玉米、豌豆[14]、绿豆[15]、绿藻[16]等。但鲜见黄花蒿对赤豆化感作用的报道。
赤豆[Vignaangularis(Willd.) Ohwi et Ohash]别称小豆或赤小豆,含有蛋白质、糖类、粗纤维、钙、磷等营养成分,是一种很受欢迎的大众食品[17]。赤豆植株成直立或缠绕草本生长,花期在夏季,每年的9月—10月结果,全国均有栽种,西南地区往往种植于田边和地边,且与黄花蒿是同季作物[18]。而黄花蒿是一种强侵染性植物,喜长于田间地头,可能对其周围赤豆种子萌发及生长造成影响[1]。因此,研究黄花蒿对赤豆化感效应具有重要意义。本研究以赤豆为受试对象,通过室内培养,研究各部位不同浓度黄花蒿水浸液(aqueous extracts from Aremisia annus. L,简称AEA)对赤豆种子萌发、幼苗生长、保护酶活性、丙二醛和叶绿素含量的化感效应,为明确黄花蒿对赤豆生长的机制及制定有效防范措施提供科学参考。
1 材料与方法
1.1 试验材料
供试赤豆于2017年7月6日购买于贵州省贵阳市万东桥农贸市场。供试黄花蒿于2016年8月26日采集于重庆市北碚区西南大学周边山坡上,洗净根部,将根、茎、叶分开,自然风干,经粉碎,过100目筛,分别装入样品袋备用。于2017年10月在贵州省山地环境信息系统与生态环境保护重点实验室进行化感效应试验。
1.2 水浸液的制备
称取备好的黄花蒿粉末10 g,置于装有100 mL去离子水的250 mL三角瓶中,在转速为141 r/min,温度为25 ℃的振荡器中浸泡24 h。取出后,4 000 r/min离心10 min,取上清液得含有原料浓度为100 mg/mL的AEA,放入4 ℃冰箱中保存。使用前取出,并用去离子水配制成0(CK)、10、20、30、40 mg/mL 的浓度。
1.3 试验处理
选取颗粒饱满、大小一致的赤豆种子,用1.0%过氧化氢溶液(H2O2)消毒1 min,无菌去离子水洗净。分别置于铺有双层滤纸的9 cm培养皿中,每个培养皿均匀放置30粒消毒处理的赤豆,再加入10 mL各浓度AEA,各部位AEA的每个浓度设3个重复,以等量的去离子水为对照(即浓度 0 mg/mL,CK),共42个重复。加盖并在25 ℃暗培养,第3天记录最终发芽数,幼苗持续培养15 d,自然光照,赤豆生长情况见图1。

1.4 测定指标及方法
以芽长超过种子的1/2为标准记录种子是否萌发,且以萌发的种子能生长成幼苗,计算赤豆种子的萌发率。在赤豆幼苗培养结束时,测量幼苗的茎长,单位是cm;称10株长势均匀幼苗的鲜质量,单位是g/10株;并分析幼苗叶片超氧化物歧化酶(SOD)活性,过氧化物酶(POD)活性,丙二醛(MDA)含量及叶绿素含量。SOD、POD活性及MDA含量分别采用愈创木酚、氮蓝四唑和硫代巴比妥酸比色法测定;叶绿素含量使用分光光度法测定[19]
1.5 数据处理
赤豆种子萌发率=(萌发的种子数/供试种子总数)×100%;赤豆种子萌发抑制率=[(对照种子萌发率-处理种子萌发率)/对照种子萌发率]×100%。参照Williamson的方法[20]计算AEA的化感效应指数(RI)。即:RI=1-C/T;式中,C为对照值,T为处理值;RI>0为促进作用,RI<0为抑制作用,负值越小或负值的绝对值越大,化感效应越强。通过此公式,可以计算出黄花蒿水浸叶对赤豆幼苗茎长和鲜质量的RI。用Excel进行试验数据基础统计和作图;采用SPSS 10.0软件进行标准误差分析、单因素方差分析和LSD法(最小显著性差异法)作显著性检验,显著水平为P﹤0.05。
2 结果与分析
2.1 AEA对赤豆萌发的影响
由图2可知,AEA对赤豆萌发的影响具有来源(根、茎、叶)和浓度差异。与对照相比,除根AEA处理浓度为 10 mg/mL 时,赤豆种子的萌发率略有提高外,其他各处理均有一定的抑制作用,且随着浓度的增加,抑制作用逐渐增强。10 mg/mL根、茎、叶AEA处理种子,赤豆的萌发率分别为95.71%、87.62%、81.90%;40 mg/mL根、茎、叶AEA处理种子的萌发率分别为87.62%、80.00%、73.33%。各部位AEA对赤豆种子萌发抑制作用强弱依次为根<茎<叶,10 mg/mL根、茎、叶AEA对赤豆萌发抑制率分别为-0.75%、7.77%、13.78%;40 mg/mL根、茎、叶AEA处理的萌发抑制率分别为7.77%、15.79%、22.81%。
2.2 AEA对赤豆幼苗生长的影响
图3为AEA对赤豆幼苗生长情况的影响,叶AEA处理后的赤豆幼苗植株明显矮化,幼苗叶片和根系畸形。各部位不同浓度处理的幼苗,培养期间茎长和鲜质量表现出相似的趋势。根AEA对赤豆幼苗的生长影响不大,浓度为 10 mg/mL 时,对幼苗茎长和鲜质量还有一定的促进作用,与对照相比,幼苗茎长和鲜质量分别增加3.94 cm、0.70 g/10株,浓度20~40 mg/mL AEA处理的幼苗生长状况平稳,影响不大。茎AEA处理后的幼苗,随处理浓度增加,茎长和鲜质量均呈现缓慢减小的趋势。但叶AEA对赤豆幼苗的影响更明显,随处理浓度增加,幼苗的茎长和鲜质量均表现出明显下降的趋势,与对照相比,10、20、30、40 mg/mL叶AEA处理的幼苗茎长分别降低29.46%、38.13%、48.07%、68.25%,鲜质量分别下降20.08%、27.37%、48.57%、68.67%。值得注意的是,AEA对赤豆幼苗生长的影响因水浸液来源黄花蒿部位的不同而异,与萌发率相似,影响强弱趋势为根<茎<叶。处理浓度达40 mg/mL时,幼苗茎长分别为 22.12、17.02、7.22 cm;鲜质量分别为3.26、3.06、1.85 g/10株。可见黄花蒿对赤豆幼苗生长有抑制作用的化感成分主要存在于叶片。
利用赤豆幼苗的茎长和鲜质量进行分析,得到不同浓度AEA的IR。由表1可知,黄花蒿不同部位、不同浓度AEA,除浓度为10、20 mg/mL根AEA对幼苗的生长具有促进作用外,其他各AEA处理浓度均有不同程度的抑制效应,且随AEA浓度增加,IR值越小,说明对赤豆幼苗的化感效应增强。各部位AEA处理浓度,除根30和40 mg/mL处理的茎长RI、根和茎20和30 mg/mL处理的鲜质量RI之间不显著以外,其余各浓度之间差异均显著。但赤豆幼苗对不同部位AEA化感效应的响应不同,从综合效应指数来看,表现为根AEA化感作用较小,其次是茎,最大为叶片。


表1 AEA对赤豆幼苗生长的化感效应
注:同列数据后不同小写字母表示在0.05水平上差异显著。
2.3 AEA对赤豆幼苗生理生化指标的影响
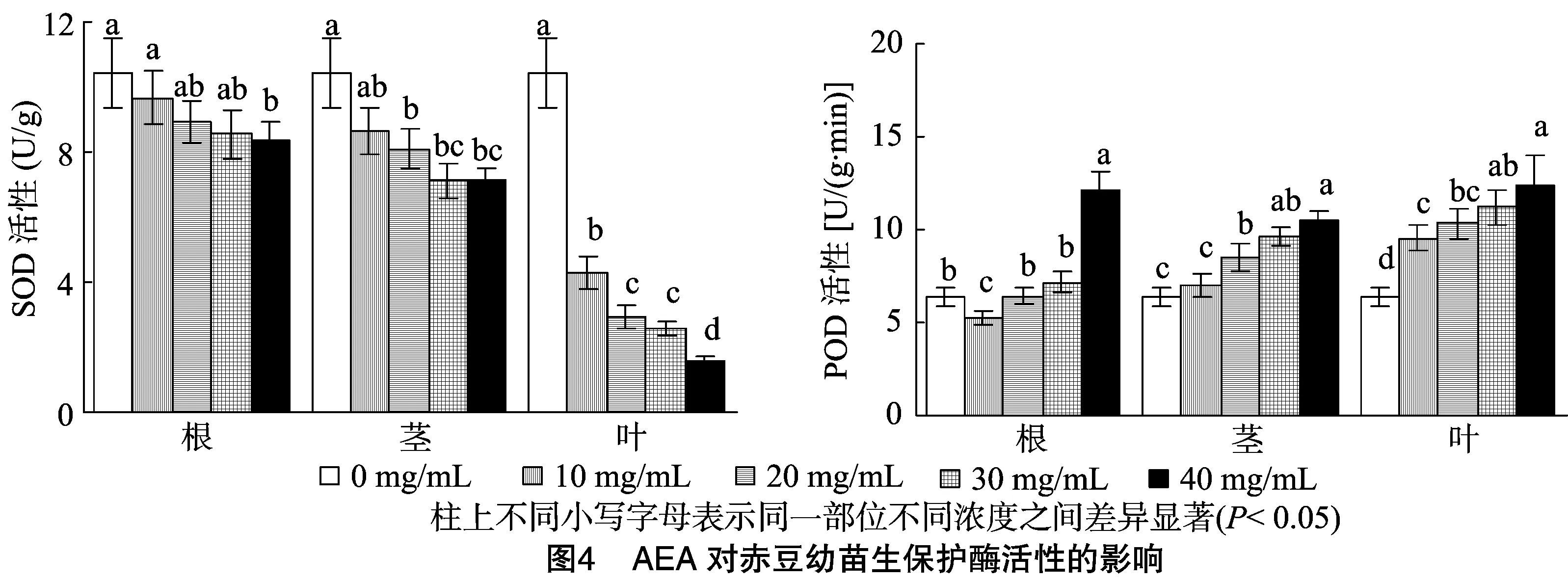
2.3.1 AEA对保护酶活性的影响 由图4可知,黄花蒿各部位AEA随浓度升高,SOD活性降低,但降低的幅度不尽相同,根和茎AEA各浓度处理降低的幅度小,叶AEA各浓度处理降低的幅度大,与对照相比,10、20、40 mg/mL根、茎、叶AEA处理下的SOD分别降低0.76、1.51、1.87、2.11 U/g(根);1.81、2.33、3.32、3.30 U/g(茎);6.13、7.48、7.86、8.88 U/g(叶)。根AEA除了40 mg/mL的SOD活性显著低于对照外,其他各处理浓度之间没有显著性差异;茎部AEA除了10 mg/mL处理的SOD活性与对照没有显著性差异外,其他3个浓度都显著低于对照,且它们之间没有显著性差异;叶片AEA各处理浓度之间,除了20和 30 mg/mL 外,均差异显著。与SOD活性相反,POD活性除根AEA处理浓度为 10 mg/mL 时比对照显著下降外,总体随着处理浓度的升高而增大。但增加的幅度各有差异,根10、20、30 mg/mL的AEA与对照相比无显著性增加,当升高到40 mg/mL时,POD活性显著大幅度增加; 茎部AEA各浓度, 除了10 mg/mL的AEA与对照的POD活性无显著性增加外,其余各浓度均显著提高;叶片各浓度AEA处理下的POD活性均显著高于对照,说明叶片在低浓度时均会对POD活性造成负面影响。
2.3.2 AEA对赤豆幼苗MDA及叶绿素含量的影响 由图5可看出,MDA含量随着AEA浓度增加而升高。叶片AEA对MDA的累积促进作用最强,当浓度为40 mg/mL时,MDA含量最高,为7.69 mmol/g,是对照的2.30倍;其次是茎部AEA处理,与叶片AEA处理的MDA含量差异大,与根部AEA差异小,40 mg/mL时,MDA含量为4.91 mmol/g,为对照的1.46倍。根AEA对MDA含量的影响最弱,位于折线图的最下方,各浓度与对照的差异不大,AEA浓度为 40 mg/mL 时,MDA含量最高,为对照的1.15倍。
AEA对赤豆幼苗总叶绿素含量的影响因来源部位不同而异,叶片AEA浓度在10、20 mg/mL时叶绿素含量升高,分别比对照显著提高15.30%、13.55%;30、40 mg/mL时叶绿素含量降低,与对照无显著性差异。茎部AEA处理的幼苗,叶绿素含量变化不大,但总体高于叶片,并且都显著高于对照,10、20、30、40 mg/mL茎部AEA分别比对照提高 19.26%、16.67%、23.54%、14.58%。根AEA处理浓度在10、20 mg/mL 时叶绿素含量比对照分别降低3.20%、8.88%,30、40 mg/mL 时叶绿素含量分别显著升高10.88%、20.36%,在 40 mg/mL 时叶绿素含量最高,为10.04 mg/g。

3 结论与讨论
植物界普遍存在化感效应,其化感成分会抑制周围其他植物的生长,利于扩大自身的竞争优势[21]。白三叶水浸液影响无芒稗种子萌发和幼苗生长[22],黄连须根浸提液降低莴苣、绿豆和白菜种子的活力指数,并显著降低这些植物幼苗的生物量和根系活力[23]。黄花蒿在生长过程中,不仅影响植物的生长,还影响其土壤微生物和动物的生长繁殖[14]。近期赵铖等报道了AEA对同季作物绿豆种子萌发和幼苗生长的抑制作用[15],本研究探讨了AEA对赤豆种子萌发及幼苗生长的化感效应。结果显示,黄花蒿各部位不同浓度AEA对赤豆种子萌发的化感作用,除了根AEA为10 mg/mL时具有促进作用外,其余各浓度均表现不同程度的抑制作用,且具有随处理浓度升高而增强的效应,各部位对赤豆种子萌发的抑制强弱表现为叶>茎>根,与前期对绿豆种子萌发结果[16]相似,张志忠等在空心莲子草对生菜和萝卜的化感作用研究中也得出相似的结果[24]。
AEA还影响赤豆幼苗生长,且也表现出浓度效应,尤其叶片AEA对赤豆幼苗影响最为明显,随处理浓度增加,生长高度和健康状况逐步减弱(图1、图2、图3),当叶片AEA浓度为40 mg/mL,对赤豆幼苗茎长和鲜质量RI值最低,分别为 -4.109、-3.764(表1),说明对赤豆幼苗生长的抑制化感效应最强,该结果与以往的研究结果相似[22],同样,再力花地下部分水浸液对水生植物生长也具有抑制作用[25]。
植物在生长发育的过程中,形成自身体内的保护套系统,这套系统一般是由POD、SOD等酶组成,其作用是避免细胞膜受到膜脂过氧化造成的伤害、维持细胞内自由基的动态平衡[17]。POD是一种适应性酶,植物对外界环境变化适应和植物生长发育与体内代谢变化都与POD活性密切相关[18]。本研究中POD活性随浸提液浓度升高而增强,其原因可能是外界环境导致赤豆幼苗中活性氧、自由基增多,因此植物自身须要产生更多的POD来消除自由基。SOD也是生物体内清除自由基的首要物质[19]。但SOD活性随浸提液浓度升高反而呈下降趋势,其可能原因是浸提液对赤豆幼苗的影响超过SOD调节的阀值,对植物造成伤害,导致SOD活性降低,还可能是酚类物质对POD、SOD有影响,刘建国在对棉花的研究中发现,酚类物质对POD活性具有促进作用[26],但随着酚类物质浓度升高,对SOD活性的抑制越明显[20]。
AEA对赤豆幼苗丙二醛含量的影响为随处理浓度升高,丙二醛含量增多,这与郑世英等在玉米中的结果[27]一致。其原因是植物在逆境环境中受到伤害就会产生MDA,且伤害越大,MDA含量越多[23]。然而,在本研究中,各部位不同浓度AEA处理下赤豆幼苗叶绿素含量变化没有明显规律,但除根AEA浓度为10和20 mg/mL处理的赤豆幼苗叶片叶绿素含量有所降低外,其他各浓度处理叶绿素含量均表现出与对照相当或显著高于对照。黄花蒿对植物幼苗叶绿素含量的影响,因受试对象不同而有差异,如其化感物质-青蒿素对豇豆(VignasinensisL.)和菜豆(PhaseolusvulgarisL.)幼苗的叶绿素含量有促进作用,对小白菜(Brassicachinensis)和大白菜(Brassicapikenensis)幼苗叶绿素含量有抑制作用[9],本研究结果与前2种豆类相似,具体原因有待进一步研究。
总之,AEA抑制赤豆种子的萌发和幼苗的生长,并表现出明显的来源部位(根、茎、叶)差异和浓度效应,通过影响幼苗的生理活性,从而导致幼苗的不健康生长。
