HPLC-MS/MS检测猪肉中4种硝基呋喃类代谢物残留
2019-01-09桂文龙苏治国徐婷婷
桂文龙, 苏治国, 徐婷婷
(江苏农牧科技职业学院,江苏泰州 225300)
硝基呋喃类药物主要用于抗细菌感染,也用于抗滴虫感染[1]。硝基呋喃类化合物都具有一个5-硝基呋喃环的特征结构,主要包含有呋喃它酮(AMOZ)、呋喃妥因(AHD)、呋喃西林(SEM)和呋喃唑酮(AOZ)等[2]。由于硝基呋喃类药物的广谱抗菌性,除了能抑制、灭杀大多数的革兰阴性菌以外,还对大部分革兰阳性菌也有杀伤作用[3-4]。硝基呋喃类抗菌药药效明显、很难产生耐药性,并且生产成本低廉,故而被大范围用于畜牧业,在禁用前作为饲料添加剂治疗猪、牛、禽类的胃肠道感染[5]。多年来研究表明,硝基呋喃类药物具有基因毒性及致癌性,且其在动物源性食品中的有害残留也对人类健康存在一定风险。
应用于硝基呋喃类药物的色谱联用技术主要有高效液相色谱-质谱法和高效液相-串联质谱法[6]。其中,高效液相-串联质谱法(HPLC-MS/MS)是我国国家标准规定的检测方法,满足了0.5 μg/kg的检测限[7]。HPLC-MS/MS法的原理是联用高效液相色谱与质谱,对物质结构定性并在定量限以上可以进行定量分析。利用高效液相色谱将待测样品中化合物分离并确定各化合物的浓度或含量进行定量,再将其汽化后导入多级质谱仪中进行结构分析,从而确定被高效液相色谱仪分离的各化合物的详细分子结构信息从而达到定性的目的。
1 仪器与试剂材料
1.1 主要仪器设
液相色谱-三级四级杆质谱联用仪(WatersAcqutyUPLC-ThermoFisherTSQ);组织匀浆机(JZ-Ⅱ型);电子分析天平(AB204-N型);多管涡旋振荡器(Targin Technologies VX-2型);台式高速冷冻离心机(3K-30型);水浴恒温振荡器(MAXQ4000型);氮吹仪(TTL-DC11型);酸度计(SevevExcellence系列);有机相针式滤器(SCAA-104);具塞离心管(50 mL、10 mL规格);移液枪(5 mL、10 mL规格);高纯水发生器(MILLI-QADVANTAGE A10)。
1.2 主要试剂及配制
主要试剂有:对照品AOZ、AMOZ、AHD、SEM(纯度均≥99.0%);内标对照品AOZ-D4、AMOZ-D5、AHD-13C3、SEM-HCl-[1,2-15N213C](纯度均≥99.0%);2-硝基苯甲醛(分析纯);甲醇、乙酸乙酯、甲酸、乙醚、乙腈、磷酸钾(均为色谱纯);浓盐酸。主要试验用的试剂配制如下。
0.2 mol/L盐酸溶液、1.0 mol/L磷酸钾溶液和0.1%甲酸溶液按常规方法配制。
标准储备液:分别精确称取AOZ、AMOZ、AHD和SEM·HCl的标准对照品各0.01 g,置于4个100 mL棕色容量瓶中,用纯甲醇溶解并定容,配制成浓度为100 μg/mL的标准储备液,于-20 ℃以下保存。
内标储备液:用分析天平精确称取AOZ-D4、AMOZ-D5、AHD-13C3和SEM-Hcl-[1,2-15N213C]对照品各 0.01 g,置于100 mL棕色容量瓶中,分别用甲醇溶解定容至刻度,稀释成浓度为100 μg/mL的内标储备液,于-20 ℃以下保存。
混合标准工作液(100 ng/mL):精确量取LAOZ、AMOZ、AHD和SEM·HCl标准储备液各100 μL,混合于10 mL棕色容量瓶中,添加纯甲醇直至10 mL刻度线,制得10 μg/mL的混合标准中间溶液,再用80%甲醇稀释成100 ng/mL的混合标准工作液,于4 ℃以下保存。
混合内标标准工作液(100 ng/mL):精确量取AOZ-D4、AMOZ-D5、AHD-13C3和SEM-HCl-[1,2-15N213C]内标储备液100 μL,置于10 mL棕色容量瓶中混匀,用甲醇定容至刻度,制得100 μg/mL的混合内标中间工作液,再逐步稀释为100 ng/mL的混合内标标准工作液于4 ℃下保存。
2 方法与步骤
2.1 待测试样处理
(1)洗涤。称取均质后的供试试料2.00 g,于50 mL离心管中,每个试样称取1个平行样。加10 mL 50%甲醇溶液,涡旋,中速振荡10 min,然后6 000 r/min离心5 min,弃上清液;向离心管中加入10 mL 50%甲醇溶液,重复洗涤1次;用乙醚替代上述50%甲醇洗涤2次。(2)衍生。洗涤后试料加100 ng/mL的混合内标标准工作液20 μL;用刻度吸管加入0.2 mol/L盐酸5 mL和0.1 mol/L 2-硝基苯甲醛的溶液 100 μL,涡旋振荡混匀;于恒温水浴振荡器中设置37 ℃遮光反应约16 h。(3)提取。将衍生后的试料放置于实验室冷却至室温(避光条件下进行),调节其pH值至中性(7.4左右),所用的pH值调节剂是1 mol/L磷酸三钾溶液,所需量大约为0.85 mL;加乙酸乙酯5 mL,进行液液萃取,先涡旋,中速振荡5 min后,高速冷冻离心机3 000 r/min离心10 min,上清液分层,吸取上层清液;用乙酸乙酯5 mL重复提取1次,合并上层清液;合并的乙酸乙酯层于40 ℃水浴下氮气吹干;用0.1%甲酸水溶液1.0 mL溶解残余物(若发现试样混浊,可将试样转移到1.5 mL离心管,离心后吸取上清液),经 0.22 μm 的有机相针式滤器过滤后备用。
2.2 质量控制样品的制备
空白样品:称取2.00 g空白试样,在衍生步骤中不添加混合内标标准工作液,其余步骤与待测试样相同。
添加样品:取空白试样2.00 g,在上述待测试样衍生步骤中再添加100 ng/mL的混合标准工作液20 μL,其余操作相同,从而制得浓度为1.0 ng/g的阳性添加试料。
2.3 标准曲线
精确量取上述试验试剂配制好的混合标准工作液(100 ng/mL)0.1、0.2、0.4、0.8、1.0 mL分别置于5个10 mL容量瓶中,用5%乙腈(含0.1%甲酸)水溶液定容至刻度,混匀即得各浓度为1、2、4、8、10 ng/mL的标准工作液,按与待测试样相同的色谱和质谱条件进样并进行检测,将测得的数据制作图表得到标准曲线,并换算出相关系数公式,求出该检测方法的定量的线性范围。
2.4 准确度与精密度
分别精确量取100 ng/mL的标准贮备液0.1、0.5、1.0 mL 于10 mL容量瓶内,加0.1%甲酸水溶液直至容量瓶刻度线,从而制得序列浓度为1.0、5.0、10.0 ng/mL的溶液,每个浓度的溶液制备6个平行样,分别进样检测用于计算仪器回收率并得到相对标准偏差。
3 仪器参数与测定
3.1 色谱条件
色谱柱:Waters UPLCTM BEH C18柱(2.1 mm×50 mm,1.7 μm);进样量:2 μL;柱温:35 ℃;流动相:A:乙腈;B:0.1%(体积分数)甲酸溶液,梯度洗脱(梯度洗脱程序见表1)。
3.2 质谱条件
离子源参考参数见表2。质量分析器参考参数见表3。定性、定量离子对、锥孔电压和碰撞能量见表4。

表1 液相色谱流动相浓度梯度
注:曲线类型1为即时变化,6为线性变化。

表2 离子源参考参数

表3 质量分析器参考参数

表4 硝基呋喃类代谢物衍生物和内标的定性、定量离子对、锥孔电压和碰撞能量
4 结果与分析
4.1 标准曲线
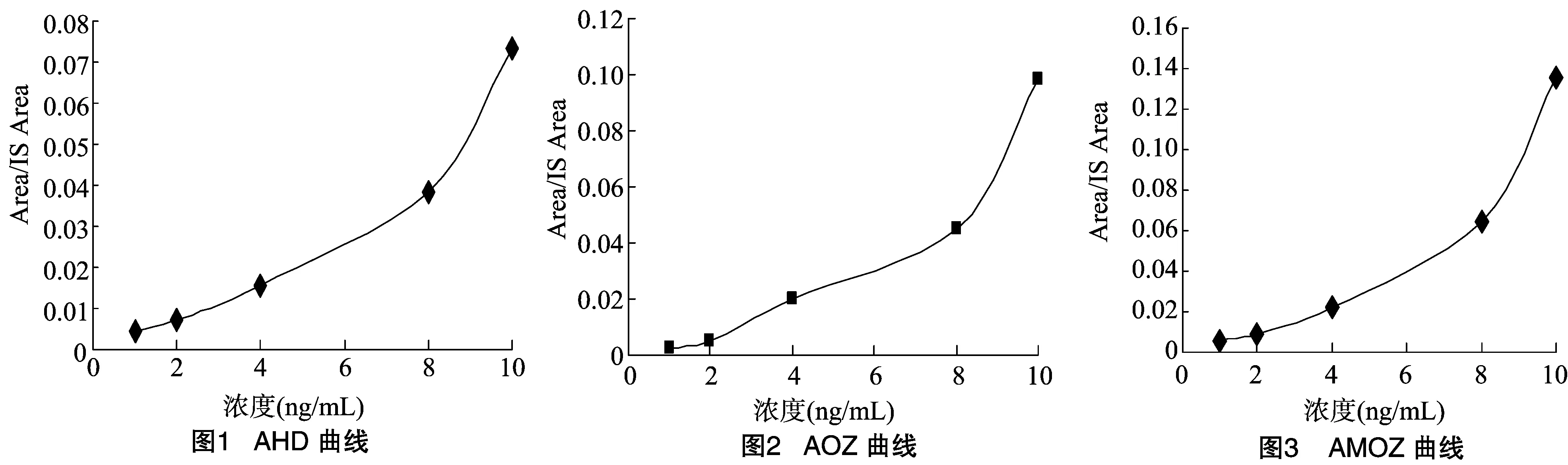
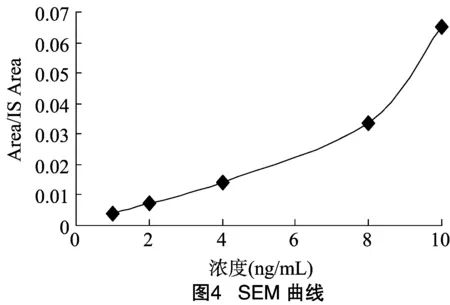
根据配制的标准溶液进样检测,将标准溶液浓度设为横坐标,将检测得到的Area/IS Area比值设为纵坐标,绘制标准曲线,得到线性方程(图1至图4)。
由图1至图4可知,回归标准曲线方程的r2范围为0.999 478~0.999 679,r2>0.999 9。
4.2 回收率与精密度
方法回收率及相对标准偏差数据见表5。
由表5可知,各组的回收率在93.2%~106.1%之间,即绝对误差范围在1.12%~6.80%。结果显示,相对标准偏差(RSD)处在0.83%~13.9%范围内。

表5 方法回收率及相对标准偏差数据(n=6)
4.3 检测样品药物残留
根据样品前处理过程,选择样品进行检测,样品编号为SX2017W0003,检测结果见表6,该样品未检出硝基呋喃类药物的代谢物。

表6 样品SX2017W0003检测结果
5 讨论
5.1 样品前处理过程
硝基呋喃类药物在动物体内代谢,代谢物与猪肉中的蛋白质键合在一起,所以若要检测硝基呋喃类代谢物的残留量则需要将该结合蛋白从样品中分离出来,并分离出结合蛋白中的4种代谢物,为进行下一步的仪器分析提供检测目标物。
前处理过程第1步洗涤的目的是除去样品中游离可溶性杂质及脂类物质,甲醇作为蛋白质沉淀剂与水同时存在可以沉淀蛋白质,甲醇在水中溶解度很大,能破坏蛋白质外表面的水化层,从而使蛋白质相互聚集而沉淀。弃去上清液中游离的杂质,再用乙醚洗涤,乙醚是非极性化合物,能与样品脂类化合物互溶,从而除去样品中的脂类物质,减少基质对后期仪器检测的影响。第2步衍生是先将硝基呋喃类药物的4种代谢物从其结合的蛋白质中提取出来,再进行衍生反应。代谢物质解离水解需要适当酸性的pH值条件,故而需要盐酸调节pH值至所需条件,同时为了之后的仪器分析,要对代谢物进行衍生。第3步提取是将衍生后的物质从样品中提取出来,使用液液萃取的方法进行提取净化,利用衍生物质与样品中其他物质在乙酸乙酯中的溶解度不同,从而达到提取净化的目的。然后用氮吹仪氮吹,对提取液进行浓缩以减少基质效应。
硝基呋喃类药物见光易分解,故而前处理过程中尽量避光操作。
5.2 标准曲线与检出限、定量限
由上述4种代谢物标准曲线分析可得4种硝基呋喃类药物代谢物的标准曲线在0.5~10.0 ng/mL的范围内所得到的线性关系,回归标准曲线方程的r2在 0.999 478~0.999 679范围内,r2>0.999 9,线性良好。即样品浓度在0.5~10.0 ng/mL 的范围内,色谱峰面积与样品中某组分的浓度成正比,可以根据线性方程进行定量分析。本方法所用仪器达到检出限0.25 μg/kg,定量限0.5 μg/kg。
5.3 回收率与精密度
由表5可知,猪肉空白样品中硝基呋喃四中代谢物的3个不同添加水平,测定6次的回收率,准确度范围在 93.2%~106.1%之间,绝对误差范围在1.12%~6.80%之间,说明仪器所导致的系统误差较小,处在检测的标准范围内,符合检测标准规定的误差大小。由表5可知,各代谢物回收率相对标准偏差范围为0.83%~13.90%,均<20%,即精密度较高。上述检测数据的RSD均符合国家标准检测要求。
5.4 检测方法
高效液相-串联质谱法能充分利用了色谱与质谱的检测功能,本次试验中所用的液质联用仪是液相色谱-三级四级杆质谱联用仪,其采用多级质谱检测,对化合物的鉴别非常精细,其检测限能够达到0.25 μg/kg,远远高于酶联免疫法和液相色谱-紫外法两种检测仪器,在实际的食品检测分析中能够更加准确的进行药物残留鉴定。
6 结论
世界各国都要求禁止使用硝基呋喃类药物于动物源性食品当中,该类药物的有效检测是对人类食用安全健康肉类食品的保证。硝基呋喃类药物残留量的检测属于痕量检测,对于检测方法的准确性要求很高。本研究采用高效液相色谱-串联质谱法对猪肉中的4种硝基呋喃类代谢物残留同时进行检测,得到硝基呋喃类药物代谢衍生物的定性定量分析结果。使用4种代谢物的同位素内标,减少了样品前处理对检测结果的影响,使定量更加精确。此法前处理过程简单易做、试验重复性好,该方法具有较高的灵敏度,检测更为准确且具有较低的检出限。因此,对比液相色谱-串联质谱法、液相色谱-质谱法和液相色谱法,三者中液相色谱-串联质谱法的准确性最高,其检测限定量限都是最低的,是三者中最为理想的检测方法。
