肠炎型犬细小病毒的分离鉴定及病毒滴度测定
2019-01-09朱善元郭长明左伟勇王永娟洪伟鸣王安平
吴 双, 朱善元, 郭长明, 秦 枫, 左伟勇, 王永娟, 洪伟鸣, 王安平
(江苏农牧科技职业学院/江苏省兽用生物制药高技术研究重点实验室,江苏泰州 225300)
犬细小病毒(CPV)感染是以呕吐和腹泻并伴有胃肠道出血等为主要病征的急性传染性疾病,加拿大、美国和澳大利亚同年报道从患肠炎的病犬粪便中分离到CPV,该病很快在全世界范围内传播。各年龄段犬均可发病,以6月龄以下幼犬发病和死亡较多[1]。作为细小病毒中最易变异的病毒[2],1980年报道,1978—2000年从最初的CPV-2型演变出现了CPV-2a,与CPV-2相比潜伏期更短、肠炎症状更严重、粪便中病毒含量低;1984年报道了CPV-2b,2000年报道了CPV-2c,2010年在国内首次被鉴定,致病性更强,3种抗原变异株。近10年来,世界各地出现了New CPV-2a、New CPV-2b和New CPV-2c优势抗原变异株,其中New CPV-2a/b主要在中国、韩国和日本等亚洲国家流行。New CPV-2a/b与CPV-2a/b区别在于VP2蛋白上297位氨基酸发生了突变,改变了与宿主细胞受体的亲和力[3-4]。CPV-2的变异主要是通过VP2基因定向漂移产生新抗原变异株[5],只是在VP2蛋白上5~8个关键氨基酸位点发生了变化,但却导致抗原性、致病性和宿主谱发生改变[6]。CPV-2是一种无囊膜、单股负链的易变异DNA病毒,基因组约为5 200个核苷酸,编码的结构蛋白包括VP1和VP2,其中VP2 是病毒结构蛋白,含有CPV的主要抗原决定簇,约占病毒衣壳蛋白90%的比重。VP2蛋白在决定病毒的宿主范围、结合及进入细胞过程中均起到了重要作用[7-8]。由于CPV-2的复制和组装须要借助宿主细胞中的多种DNA复制酶,因此只能在分裂间期细胞中复制,所以采用同步接毒法来分离病毒[9]。本试验采用同步接毒法利用F81和MDCK细胞分离到1株CPV,该病毒属于CPV-2a亚型,为了满足后续测定重组犬干扰素活性试验的需要,测定了该分离株的病毒滴度。
1 材料与方法
1.1 疑似犬细小病毒病病料的采集
江苏省泰州某宠物医院收治了3例疑患犬细小病毒病的病犬,病犬均出现典型的腹泻症状、呕吐、消瘦、鼻镜干燥等临床症状,采集病犬的新鲜粪便,先按照韩国安捷公司生产的CPV胶体金快速诊断试纸说明书进行检测,后采集检测为阳性犬的新鲜粪便,将其置于含3%胎牛血清、10%双抗的RPMI-1640,于-80 ℃下备用。
1.2 细胞、常用试剂
F81和MDCK购自武汉博士德生物工程有限公司;胎牛血清、DMEM培养基、胰酶、青链双抗,购自GIBCO公司;安捷快速检测CPV抗体试剂盒、MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0、PrimeSTAR® HS DNA聚合酶、大肠杆菌(Escherichiacoli) DH5αCompetent Cells、Mighty TA-cloning Reagent Set for PrimeSTAR®试剂盒、DNA marker、质粒小提试剂盒、琼脂糖凝胶DNA胶回收试剂盒等,均购自宝生物工程(大连)有限公司。
1.3 犬细小病料处理
病料反复冻融3次后挤净棉签,5 000 r/min×10 min离心后的上清经0.22 μm过滤至灭菌冻存管中。在F81细胞消化传代的同时将代接种的病料上清按照1 ∶10接种细胞培养液比例采用同步接毒法传代,于37 ℃、5% CO2培养24 h,再换2% DMEM维持液继续培养,同时设正常细胞对照。若有80%细胞出现细胞病变(CPE)时,收获病毒;按照1 ∶30比例进行传代。如果没有出现CPE则于4~5 d收取上清,细胞传代至第3代仍无CPE,则判断为阴性。同时,利用MDCK细胞按照上述方法进行病毒分离。
1.4 DNA的提取、VP2基因片段测序及分析
参考GenBank发布的CPV基因,设计1对引物[CPV-VP2-U,5′-AGAGACAATCTTGCACCAAT-3′;CPV-VP2-D1755,5′-TATAATTTTCTAGGTGCTAGTTG-3′引物由英潍捷基(上海)贸易有限公司合成]。
按照TaKaRa MiniBEST Viral RNA/DNA Extraction Kit Ver.5.0试剂使用说明书流程提取阳性病料中病毒基因组DNA,将DNA模板置于-80 ℃备用。运用高保真酶PrimeSTAR® HS DNA聚合酶扩增VP2基因,PCR反应条件为:98 ℃10 s;60 ℃ 15 s,72 ℃ 2 min,30个循环。利用Mighty TA-cloning Reagent Set for PrimeSTAR®试剂盒连接胶回收目的片段,转化后挑取白色菌落,将菌落PCR方法鉴定为阳性的菌液送至英潍捷基(上海)贸易有限公司测序,至少送3个阳性克隆测序。应用 Lasergene软件对VP2基因核苷酸序列进行同源性分析,应用MEGA5.03采用Maximum Likelihood法(最大似然法)构建系统进化树进行分析。
1.5 病毒滴度的测定
将培养的病毒液反复冻融3次后,用2% DMEM维持液做10倍比稀释,取10-1~10-7稀释度接种MDCK细胞。将MDCK细胞消化稀释为2×105个/mL后铺布于96孔细胞板,每孔加100 μL细胞悬液,再将稀释好的病毒液接种于孔中,每孔100 μL,每个稀释度重复10孔。每个稀释度做2个阴性对照孔,每孔加入100 μL维持液,37 ℃培养72 h,镜检,观察细胞形态并记录病变孔的数目,通过组织细胞半数感染量(TCID50)计算病毒滴度,按Reed-Muench法计算结果。
2 结果与分析
2.1 CPV细胞分离结果
按同步接毒法接种F81细胞,仅病料3从第2代次开始出现细胞病变(CPE),细胞发生变圆、拉网状、脱落、崩解等形态变化,将分离到的病毒命名为CPV-F。细胞在接毒72 h出现明显的细胞病变(图1-A),对照组细胞生长正常(图1-B);其他2份病料传至第3代仍无CPE,判断为阴性。

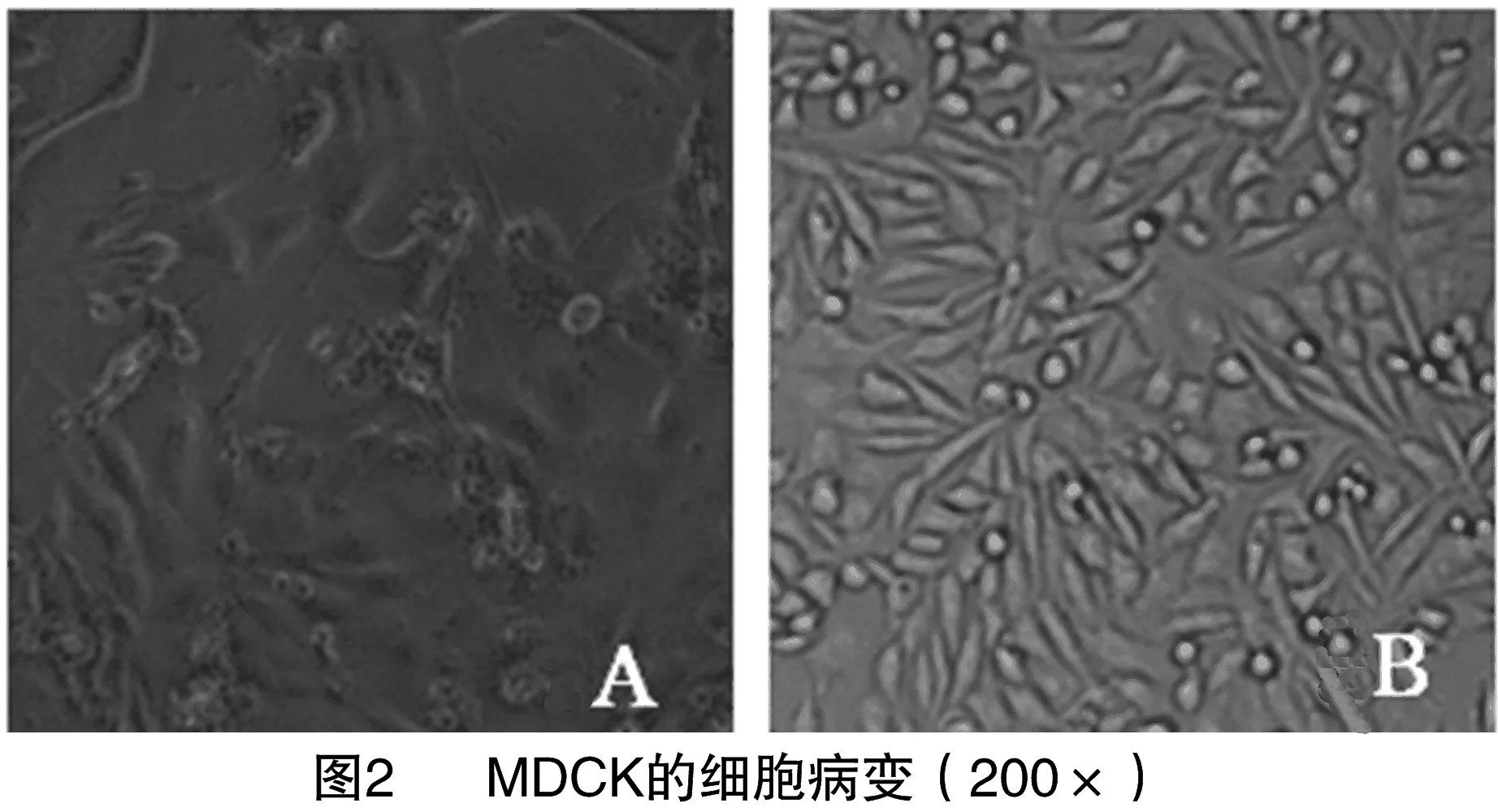
采用上述的同步接毒法接种MDCK细胞后仅病料3从第3代次出现CPE,命名为CPV-M。从图2可以看出,在MDCK细胞培养72 h时出现的细胞病变。
2.2 PCR扩增及其序列分析
通过PCR方法扩增得到的片段与预期片段大小一致,3份病料均扩增到目的片段,1、2、3泳道依次命名为CPV1、CPV2、CPV3。从图3可以看出,3份病料中病毒含量差异明显。

经切胶回收TA克隆后仅CPV3测序成功。根据VP2基因核苷酸序列的测序结果绘制系统进化树,CPV3位于2a分支中,基因核苷酸序列系统发生树见图4。
将测序获得的CPVVP2基因及推导氨基酸序列进行分析,该分离株的426位为天冬酰胺,符合CPV-2a亚型的特征。与上述引用的21株VP2基因的同源性为99.2%~99.9%,氨基酸同源性亦为99.2%~99.9%。系统发生树表明CPV3与上海分离株CPV/CN/SH1/2013(KR002792)亲缘关系最近。
2.3 病毒滴度的测定结果
在加入病毒72 h时通过记录MDCK病变孔的数目,运用Reed-Muench法计算TCID50数值,其中CPV-M-5的TCID50数值为10-4.83/0.1 mL,CPV-M-10的TCID50数值为10-5.50/0.1 mL。

3 讨论与结论
本试验从疑似感染犬细小病毒病的粪便中分离到1株病毒,经2种细胞培养和分子生物学的鉴定获得CPV3,该病毒属于CPV-2a亚型,测定了2个代次的病毒滴度,为后续测定重组犬干扰素活性提供了基础材料。
CPV由于自身所带基因限制,其复制增殖病毒前期所需的酶均要宿主细胞提供,要求宿主细胞必须处于对数生长期,故细小病毒培养分离多采用同步接毒方法[10]。相关文献报道,分离CPV常用细胞有F81和MDCK,由于F81细胞出现CPE更加明显,所以成为分离CPV最常用的培养细胞。本试验中CPV感染的F81和MDCK细胞均出现CPE,虽然F81出现CPE时间更早、症状更明显,但是MDCK中CPE症状也是很容易观察到,这些细胞病变情况与相关报道较一致。
本试验中应用胶体金试纸条和PCR检测技术结果相一致,3份病料均检测到含有CPV,但在细胞分离病毒的过程中,只有病料3分离到CPV。结果表明,胶体金试纸条和PCR检测灵敏度远高于病毒分离,而分离到病毒的难度要高于检测到病毒。本研究中扩增的VP2基因全长为1 755个核苷酸,共编码584个氨基酸。该病毒与CPV-2的VP2基因推导的氨基酸相比,共有Met87Leu、Ile101Thr、Ala300Gly、Asp305Tyr、Val555Ile 5个氨基酸序列发生了突变,据此判定CPV3属于CPV-2a亚型。分析VP2基因序列发现,CPV3位于遗传进化树的2a分支中,且与国内分离株的亲缘关系普遍较近,该遗传进化树一定程度上表明国内分离的CPV没有明显的地域差异。
为了后续试验的需要,对分离CPV-M进行传代增殖并测定TCID50数值,CPV-M-5的TCID50数值略低于CPV-M-10的TCID50数值,表明毒株的毒力在传代中逐渐增强。传代导致毒力增强的原因还有待于进一步研究阐明。
