木薯朱砂叶螨抗阿维菌素品系选育及其解毒酶活性变化
2019-01-09刘连军李恒锐杨海霞农秋连梁振华马仙花
刘连军, 黎 萍, 李恒锐, 杨海霞, 农秋连, 梁振华, 马仙花
(广西南亚热带农业科学研究所,广西崇左 532415)
朱砂叶螨[Tetranychuscinnabarinus(Boisduval)]属叶螨科(Tetranychidae),别称红蜘蛛,是危害木薯最为严重的一种害螨,可导致当地木薯减产10%~30%,严重危害时可减产 50%~70%[1]。朱砂叶螨个体小、繁殖能力强、世代周期短,年繁殖代数可达15代。由于生产上长期大面积使用化学农药防治朱砂叶螨,不可避免地会产生抗药性[2-3]。
阿维菌素是一种广谱、高效、低残留,对人畜安全的抗生素类杀虫剂[4-5],以干扰害虫神经来杀死害虫,与常用杀虫剂的作用机制不同,不会和常用杀虫剂产生交互抗性,适合防治对其他杀螨剂已产生抗药性的害虫。用阿维菌素进行螨类抗性选育已有报道,如陈文博等研究表明,土耳其斯坦叶螨对阿维菌素的抗性发展较慢[6];刘贻聪等研究得出,二斑叶螨田间种群普遍对阿维菌素产生了稳定抗性[7];宋丽雯等用阿维菌素对截形叶螨进行抗性筛选,结果表明截形叶螨对阿维菌素抗性较稳定[8]。
螨类抗药性形成与体内各种解毒酶系活性变化存在密切联系[9]。研究认为,多功能氧化酶(MFO)、谷胱甘肽-S-转移酶(GSTs)、羧酸酯酶(CarE)等是动物体内的重要解毒酶系[10]。MFO的底物谱极广,几乎能氧化代谢所有杀虫剂,与许多害虫的抗药性形成有关;GSTs能使内源谷胱甘肽与化学农药(包括杀虫剂、杀螨剂)中具有毒理作用的亲电基团结合并排出体外;CarE是昆虫体内重要的解毒酶系,在对外源化合物的解毒代谢和对杀虫剂的抗性形成中起重要作用。何林等报道用阿维菌素处理不同螨类其结果都表明该抗性品系的形成与体内解毒酶活性升高有一定关系[9,11-12],但尚未见对木薯朱砂叶螨抗药性机制方面的报道。本研究采用室内喷药继代汰选法对阿维菌素进行木薯朱砂叶螨抗性筛选,分析敏感品系和抗性品系3种解毒酶活性的变化,旨在探讨朱砂叶螨对阿维菌素抗性形成及其体内解毒酶活性变化与产生抗性之间的关系,为朱砂叶螨的抗性综合治理提供理论依据。
1 材料与方法
1.1 试验地点和时间
试验地点设在广西南亚热带农业科学研究所农产品检测中心,2016年4—12月进行室内抗性品系筛选,2017年1月进行解毒酶活性测定。
1.2 供试虫源
朱砂叶螨敏感品系(SS):供试木薯朱砂叶螨采自广西南亚热带农业科学研究所木薯种植田间,试验前在室内饲养繁殖至少2代。饲养温度为(27±2) ℃,相对湿度为(75±2)%,光照16 h/d,期间不接触任何药剂。
朱砂叶螨抗性品系(Ab-R):从朱砂叶螨敏感品系中分离部分群体,扩繁后用阿维菌素乳油进行抗性筛选,采用水隔式饲养法(木薯叶叶背朝上置于托盘内的浸湿海绵上)连续饲养至15代,可视为抗性品系。
1.3 供试药剂和主要仪器
阿维菌素乳油(购自广东中迅农科股份有限公司);α-萘酚(购自国药集团化学试剂有限公司),分析纯;固蓝B盐(购自成都艾科达化学试剂有限公司),分析纯;4-对硝基苯甲醚(购自成都艾科达化学试剂有限公司),分析纯;十二烷基磺酸钠(SDS,购自北京欣华绿源科技有限公司),化学纯;α-乙酸萘酯(购自上海瑞永生物科技有限公司),化学纯;毒扁豆碱(a-NA,购自Fluka公司),纯度≥98%;2,4-二氯硝基苯(DCNB,购自Sigma公司),纯度>98%,化学纯;还原型谷胱甘肽(购自Japan公司),纯度≥98%;牛血清白蛋白(购自北京欣华绿源科技有限公司);考马斯亮蓝G-250(购自Fluka公司);乙二胺四乙酸(EDTA,购自上海源叶生物科技有限公司);还原型辅酶Ⅱ(NADPH,购自Sigma公司),纯度≥98%。人工气候培养箱(型号LRH-250-GsbI,购自韶关市泰宏医疗器械有限公司);T6新世纪紫外分光光度计(购自北京普析通用仪器有限公司)。
1.4 试验方法
1.4.1 抗性品系选育 参照黎萍等的方法[13],用1.8%阿维菌素乳油,以种群死亡率25%左右的选择压力给予喷药处理,喷药24 h后将存活的叶螨个体转移到托盘里离体新鲜的木薯叶背面,采用水隔式培养,待存活个体在新鲜木薯叶上产卵3 d后移走,每次喷药后进行生物测定,计算致死中浓度,适当提高每代喷药浓度。当F1代成螨高峰期时再次喷药处理,重复上述操作,直至F15代。
1.4.2 室内毒力测定 参照黎萍等的方法[13],每代分别设置5种不同梯度的药剂浓度,每个梯度浓度保证螨死亡率在40%~75%,每个浓度重复3次,用清水作为对照。取饲养室个体大小均匀一致的雌成螨接于新鲜离体的木薯叶背面,作为F0代成螨。用手持式喷雾器均匀喷施于木薯叶背面,24 h 后检查死亡率,挑选存活成螨置于人工气候培养箱中培养,温度为(27±2) ℃,相对湿度为(75±2)%左右,光照 16 h/d。每次施药后记录施药前成螨总数和施药后死亡数,计算抗性指数。
抗性指数=抗性品系LC50/敏感品系LC50。
1.4.3 解毒酶活性测定
1.4.3.1 酶液制备 挑取木薯朱砂叶螨敏感品系和经致死量处理过100头左右的雌性朱砂叶螨,加入2 mL相对应的磷酸缓冲液(0.1 mol/L、pH值为7.0),冰浴中研磨充分,在高速离心机中离心(10 000 r/min、4 ℃)15 min,取上清液,置于冰浴中待用,上清液即为酶液。
1.4.3.2 蛋白质标准曲线绘制 取7支试管按表1顺序加入试剂,在37 ℃恒温水浴内放置10 min,在595 nm下比色测定(表1)。以牛血清蛋白含量(μg/mL)为横坐标,并以测得的吸光度取平均值后为纵坐标,绘制标准曲线。
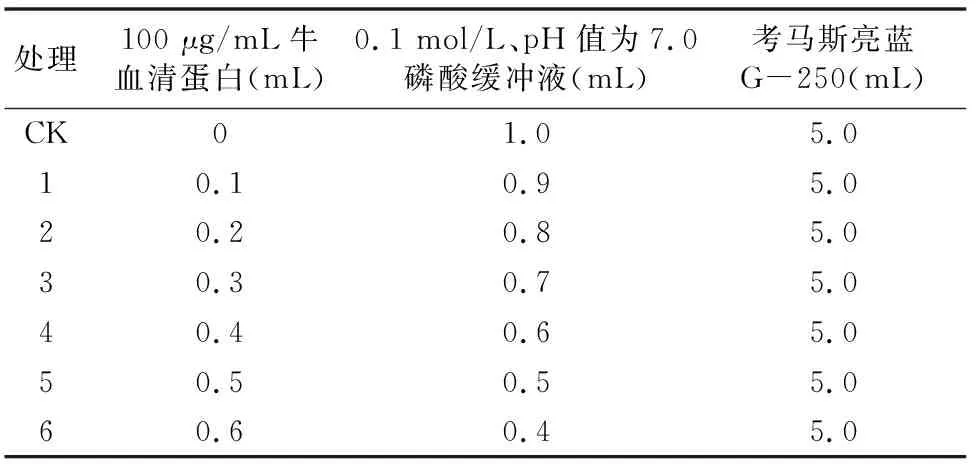
表1 蛋白质标准曲线测定
1.4.3.3 CarE活性测定 参照van Asperen的方法[14],以 a-NA (3×10-4mol/L,含10-4mol/L a-NA)为底物,加 3 mL 酶液,混匀,在30 ℃恒温水浴10 min,立刻加0.5 mL显色剂,在30 ℃水浴反应10 min,待颜色稳定后,在紫外分光光度仪上600 nm处测定吸光度,3次重复。根据酶源蛋白质含量的测定结果计算CarE的比活力[mmol/(mg·30 min)]。
1.4.3.4 GSTs活性测定 参照Clark等的方法[15],取 66 mmol/L pH值为7.0的磷酸缓冲液、50 mmol/L谷胱甘肽、0.03 mol/L 2,4-二硝基苯和酶液分别为2.4、0.3、0.1、0.2 mL,对照不加酶液,混合均匀,27 ℃水浴10 min,在紫外分光光度仪上340 nm处测定吸光度,重复3次。根据酶源蛋白质含量测定结果,将吸光度换算成比活力[ΔD/(mg·30 min)]。
1.4.3.5 MFO活性测定 取对硝基苯甲醚(0.1 mol/L、pH值为7.0)、磷酸缓冲液、NADPH和酶液分别为0.1、1.9、0.5、0.5 mL,对照不加酶液,混合摇匀,置于37 ℃水浴振荡 30 min,然后加1.0 mL HCl溶液(1 mol/L)终止反应,后用四氯甲烷、NaOH溶液(0.5 mol/L)萃取,在温室下静置10 min后,取 2.0 mL 水相置于比色皿中,在400 nm处测吸光度。根据各处理的吸光度与标准曲线相比较,计算MFO的比活力[nmol/(mg·30 min)]。
1.4.3.6 数据统计与分析 阿维菌素对朱砂叶螨的抗性选育结果数据及解毒酶活性数据处理均采用SPSS Statistics 22.0 软件进行统计分析,采用Duncan’s新复极差法进行差异显著性分析。
2 结果与分析
2.1 木薯朱砂叶螨对阿维菌素抗性的选育
朱砂叶螨对阿维菌素抗性结果(表2)表明,通过从F1至F15代试虫的逐次汰选和饲养,获得F15代抗性倍数为3.25。LC50由2.830 μg/mL上升到9.208 μg/mL,F0~F6、F7~F12、F13~F15抗性倍数范围分别在1.00~1.87、2.01~2.84、3.03~3.25内。由此可见,阿素菌素对朱砂叶螨的抗药倍数呈缓慢上升趋势,抗性发展较慢,没有出现抗性突增阶段。
2.2 朱砂叶螨不同品系对CarE比活力的变化
由表3可知,与SS品系相比只有Ab-R15品系CarE比活力达到显著性差异水平,为SS品系的1.27倍。除了Ab-R15品系外,其余2个抗性品系与SS品系CarE比活力差异均未达到显著水平,说明阿维菌素抗性品系的形成与CarE比活力可能关系不大。
2.3 朱砂叶螨不同品系对GSTs比活力的变化
由表4可知,连续15代筛选,GSTs的比活力一直在上升中,Ab-R5品系比活力上升幅度最小,与SS品系之间没有显著性差异,筛选至10代,Ab-R10品系比活力上升较快,与 Ab-R5、SS品系之间差异达到显著水平,为SS品系的1.43倍,说明朱砂叶螨对阿维菌素抗性水平的提高可能部分与GSTs比活力的提高有关。
2.4 朱砂叶螨不同品系对MFO比活力的变化
由表5可知,随着选育代数的增加,MFO的比活力不断增强,且上升幅度相对较大,Ab-R品系与SS品系之间MFO比活力差异均达到显著性水平,Ab-R15品系是SS品系的1.92倍,从F5代到F15代MFO的活性上升较快,且与SS品系相比具有显著差异,表明朱砂叶螨对阿维菌素产生的抗性与MFO比活力增强有直接关系, 而且是朱砂叶螨对阿维菌素产生抗药性的重要原因。

表2 木薯朱砂叶螨抗阿维菌素品系选育结果

表3 朱砂叶螨不同品系对CarE比活力的变化
注:表中所示数据为平均值±标准差;同列数据后不同小写字母表示差异显著(P<0.05),下表同。
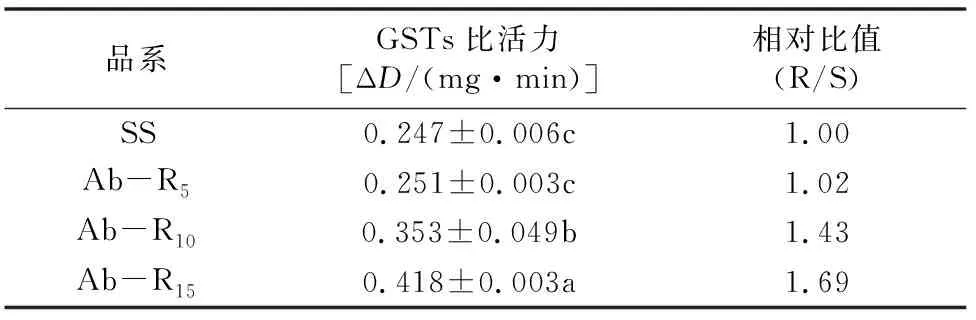
表4 朱砂叶螨不同品系对GSTs比活力的变化

表5 朱砂叶螨不同品系对MFO比活力的变化
3 结论与讨论
通过阿维菌素对木薯朱砂叶螨的室内筛选,获得F15代抗性为3.25倍的朱砂叶螨阿维菌素种群,在抗性筛选过程中发现该朱砂叶螨对阿维菌素的抗性发展速度慢,呈平缓的上升趋势,没有出现抗性突增阶段,不易产生抗药性,这与陈文博等的研究结果[6,8]一致。
室内抗性选育是害虫抗药性研究的重要手段,抗药性发展的速度和程度与害虫种类、原始种群的抗性水平、药剂种类及选择压力有关[16]。通过朱砂叶螨对阿维菌素的抗药性研究结果表明,在实际生产中为预防朱砂叶螨对阿维菌素过快产生抗药性,要适当与常用药剂进行轮换或者选用混配药剂,控制使用量和施用次数,从而延长阿维菌素的使用寿命,这样才有可能阻止或延缓害螨抗药性的发生。
本研究用阿维菌素经F15代抗性选育后,对Ab-R品系和SS品系的3种解毒酶(CarE、GSTs和MFO)比活力测定表明,CarE比活力在F10代前基本没有变化,Ab-R品系与SS品系之间的比活力差异不显著;GSTs选育F10代时比活力变化显著,Ab-R10品系比SS品系比活力提高1.43倍;MFO的比活力变化显著且上升较快,说明朱砂叶螨体内MFO在对阿维菌素的抗药性中起主要作用,这与沈一凡等认为MFO比活力增强是二斑叶螨对阿维菌素产生抗药性的主要原因的结论[11-12]相印证。高新菊等报道二斑叶螨对四螨嗪产生抗性是3种解毒酶协同作用的结果[17];刘金香等研究表明,水胺硫磷和甲氰菊酯的抗性形成与3种解毒酶有一定的关系[18]。同样,笔者认为木薯朱砂叶螨对阿维菌素抗性的形成与CarE、GSTs、MFO比活力的变化存在联系,但MFO比活力的提高是导致朱砂叶螨抗性形成的重要原因。
本研究的木薯朱砂叶螨室内抗性选育至F15代,如果抗性筛选不断进行,朱砂叶螨抗性会迅速上升。随着抗性的增强,朱砂叶螨体内3种解毒酶活性可能会有更大的变化,因此本课题有待今后继续深入探讨,为进一步研究抗性治理提供科学的理论依据。
