兴化龙香芋脱毒快繁组培技术体系的建立与优化
2019-01-09殷剑美张培通韩晓勇郭文琦李春宏
王 立, 殷剑美, 张培通, 韩晓勇, 郭文琦, 李春宏
(江苏省农业科学院经济作物研究所,江苏南京 210014)
兴化龙香芋是江苏省泰州市兴化地区特有的芋头品种,其母芋近圆形,肉质白、粉而香,子芋少,呈椭圆形,肉质粉且糯[1]。兴化龙香芋采用垛田种植,生长方式独特,种植历史悠久,耐贮运,品质优良,含有丰富的蛋白质、淀粉以及钙、铁等矿物质,是人们喜食的蔬菜品种之一。随着纪录片《舌尖上的中国》的热播,兴化的垛田龙香芋成功申请了国家地理标志保护,其品牌价值迅速提升,市场需求量巨大。但是,由于生产上常采用块茎繁殖龙香芋,长期的自繁留种易引起兴化龙香芋的种性退化,导致芋病毒病的普遍发生,从而严重影响兴化龙香芋的产量和品质[2]。目前,采用组织培养技术对芋组织进行脱毒快繁的研究已有报道,通过组织培养脱毒技术不但可以降低芋植株的发病率,还能明显提高芋头的产量和品质[3-5]。
正交试验不仅可以大大减少工作量,还可以通过分析极差和方差结果,发现组培过程中的关键因素,获得最佳培养条件和培养基最优组合,因此在植物组织培养中具有重要的应用价值[6]。本研究通过对兴化龙香芋茎尖组培技术进行研究,旨在建立并优化兴化龙香芋茎尖脱毒快速繁殖组织培养技术体系,探索兴化龙香芋农家优良品种脱毒复壮的有效方法,为优良龙香芋种源的生产提供理论参考。
1 材料与方法
1.1 试验材料
选择大小一致、外表无创伤的兴化龙香芋球茎,用0.5% K2MnO4浸泡5 min后,用沙土覆盖至整个芋块的2/3处,放置于光照培养箱中,在温度为25 ℃、相对湿度为70%的条件下催芽10 d左右。
1.2 试验方法
1.2.1 外植体的选取及消毒灭菌 待球茎顶芽生长到3~4 cm 长时,剥除外层2~3层鳞片,切下顶芽,切成带球茎 1 cm3左右的芽,用流动的水冲洗10 min。在无菌条件下进行以下操作:用70%乙醇表面消毒2次,每次30 s,然后放在5%次氯酸钠溶液中消毒10 min,最后用无菌水清洗3~4次,获得无菌外植体;使用体视显微镜和解剖针将顶芽外层的鳞芽剥除,获得长1.0 mm左右的茎尖生长点。
1.2.2 愈伤组织的诱导 在无菌条件下,对上述所得的无菌外植体进行不定芽的诱导。培养条件:白天温度为(25±1) ℃,夜间温度为(20±1) ℃,湿度为65%~70%,光照度为3 000 lx,光照时间为12 h/d。诱导培养基以MS+30 g/L蔗糖+6.0 g/L琼脂为基本培养基(pH值为5.8),按照表1的配方分别添加0.1、0.5、1.0 mg/L TDZ(噻苯隆),0.1、0.5、1.0 mg/L 2,4-D(2,4-二氯苯氧乙酸)和0.1、0.2、0.3 mg/L 6-BA(6-芐氨基腺嘌呤)。培养40 d后,统计愈伤组织诱导情况。愈伤组织诱导率=诱导出愈伤组织的外植体数/接种的外植体总数×100%。每个处理设15个外植体,重复3次,计算平均值。
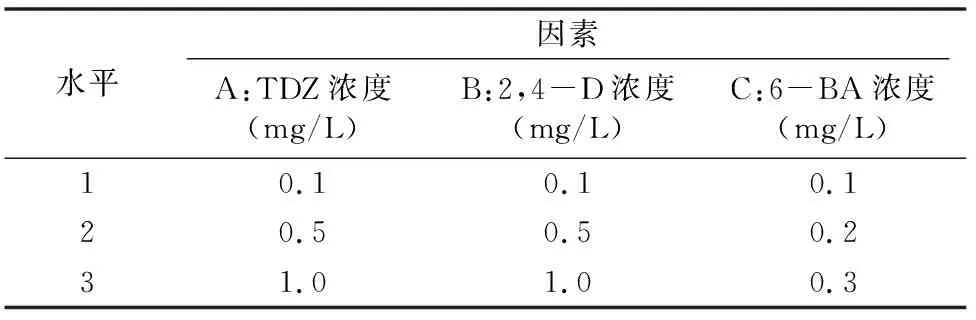
表1 愈伤组织诱导的L9(33)正交试验设计
1.2.3 不定芽诱导 在无菌条件下,对诱导获得的愈伤组织进行不定芽的诱导。诱导培养基以MS+30 g/L蔗糖+6.0 g/L 琼脂为基本培养基,附加0.1、0.5、1.0 mg/L TDZ,0.1、0.5、1.0 mg/L 2,4-D和0.1、0.2、0.3mg/L 6-BA(表1)。培养45 d后,观察并统计外植体的不定芽诱导情况。不定芽诱导率=诱导出不定芽的外植体数/接种外植体总数×100%。每个处理设15个愈伤,重复3次,计算平均值。
1.2.4 不定芽的分化和增殖 将诱导出的不定芽接入以MS+30 g/L蔗糖+6.0 g/L琼脂为基本培养基,同时附加表1中按L9(33)正交试验设计的培养基配方,诱导不定芽分化和增殖。培养30 d后,观察并统计不定芽增殖情况。不定芽分化率=(长出不定芽的外植体数/外植体总数)×100%;增殖系数=增殖后不定芽总数/接种的不定芽总数。每个处理设20个不定芽,重复3 次,计算平均值。
1.2.5 组培苗生根 将增殖培养所得的1~3 cm高的组培苗切割,接种在以1/2MS+30 g/L蔗糖+6.0 g/L琼脂为基本培养基,同时附加表2按L9(33)正交试验设计的培养基配方,诱导不定芽生根,培养30 d后,观察并统计不定芽的生根情况。生根率=生根外植体数/接种外植体数×100%。每个处理接种10个外植体,重复3次,计算平均值。
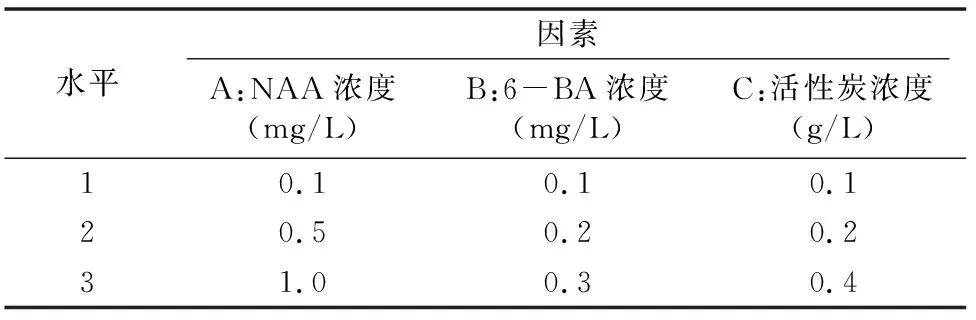
表2 组培苗生根诱导的L9(33)正交试验设计
1.3 数据统计与处理
采用Excel 2016、SPSS 17.0对试验数据进行方差分析,采用Duncan’s法进行差异显著性检验。结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同激素水平组合对兴化龙香芋愈伤组织诱导的影响
将外植体接种在诱导培养基内10~15 d后,开始形成愈伤组织,茎尖开始膨大。由图1可以看出,30 d左右出现淡黄色团状的愈伤组织;40~55 d左右产生大量疏松的淡黄色颗粒状愈伤组织;60~70 d后愈伤组织颗粒变成绿色,并开始分化形成不定芽;80~90 d左右可以进行不定芽增殖诱导。
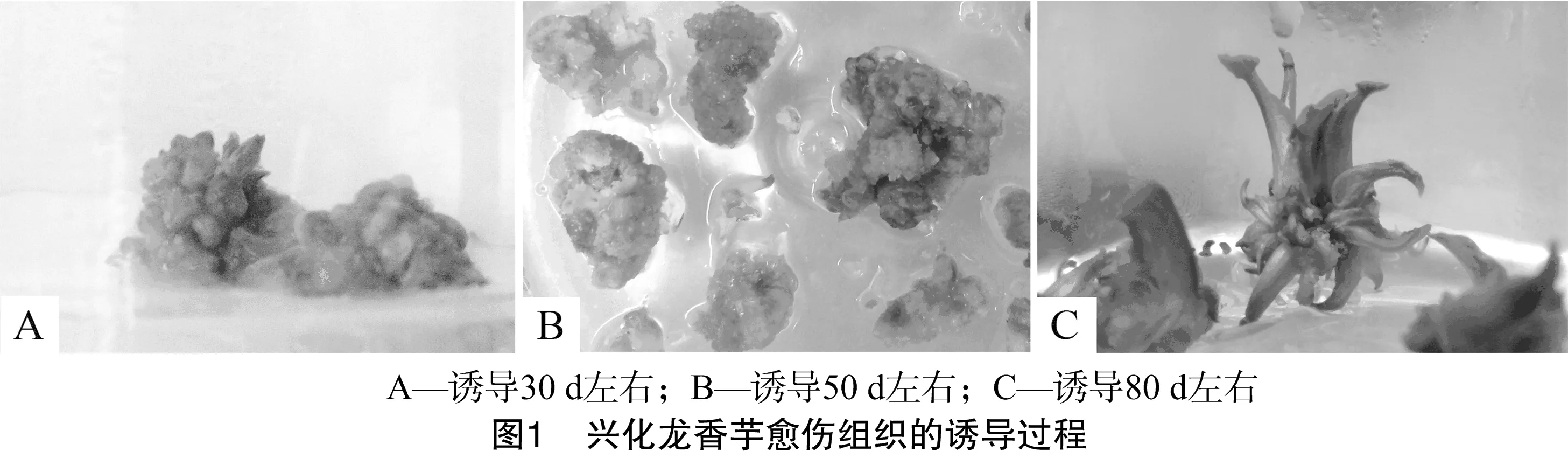
表3结果显示,随着TDZ和2,4-D浓度的增加,形成愈伤组织的兴化龙香芋外植体数量不断增加,愈伤组织诱导率不断提高。从诱导外植体数量和愈伤组织诱导率来看,2,4-D的极差均为最大值,表明2,4-D对兴化龙香芋愈伤组织诱导的影响最大,其次是6-BA、TDZ。结合表4的方差分析结果可知,兴化龙香芋愈伤组织诱导的最佳激素组合是 0.5 mg/L TDZ+1.0 mg/L 2,4-D+0.1 mg/L 6-BA,在此浓度组合下,诱导外植体数量、愈伤组织诱导率均为最大值,分别为13.67个、91.11%。
2.2 不同激素水平组合对兴化龙香芋不定芽诱导的影响
将不定芽从愈伤组织上切下,转入不定芽诱导培养基中培养。由表5不定芽诱导率来看,TDZ的R值最大,其次是2,4-D和6-BA,这表明TDZ对兴化龙香芋不定芽诱导的影响最大。当TDZ的激素水平从0.1 mg/L增加到0.5 mg/L时,兴化龙香芋的不定芽诱导率极显著提高(从TDZ浓度为0.1 mg/L时最高的44.44%提高到TDZ浓度为0.5 mg/L时最高的88.89%);而6-BA对不定芽诱导的增强效果不明显:当TDZ浓度较低(低于0.5 mg/L)时,增加6-BA浓度可以促进不定芽分化;而当TDZ浓度提高后,增加6-BA浓度反而会抑制不定芽的诱导。方差分析结果显示,TDZ的F值最大,与2,4-D、6-BA相比差异极显著(表6),表明TDZ的浓度是决定兴化龙香芋不定芽诱导的最重要因素,此结论与极差分析所得结论一致。由表5及以上分析可知,兴化龙香芋不定芽诱导的激素最佳组合是0.5 mg/L TDZ+1.0 mg/L 2,4-D+0.1 mg/L 6-BA,此时不定芽诱导率最高,为 88.89%。
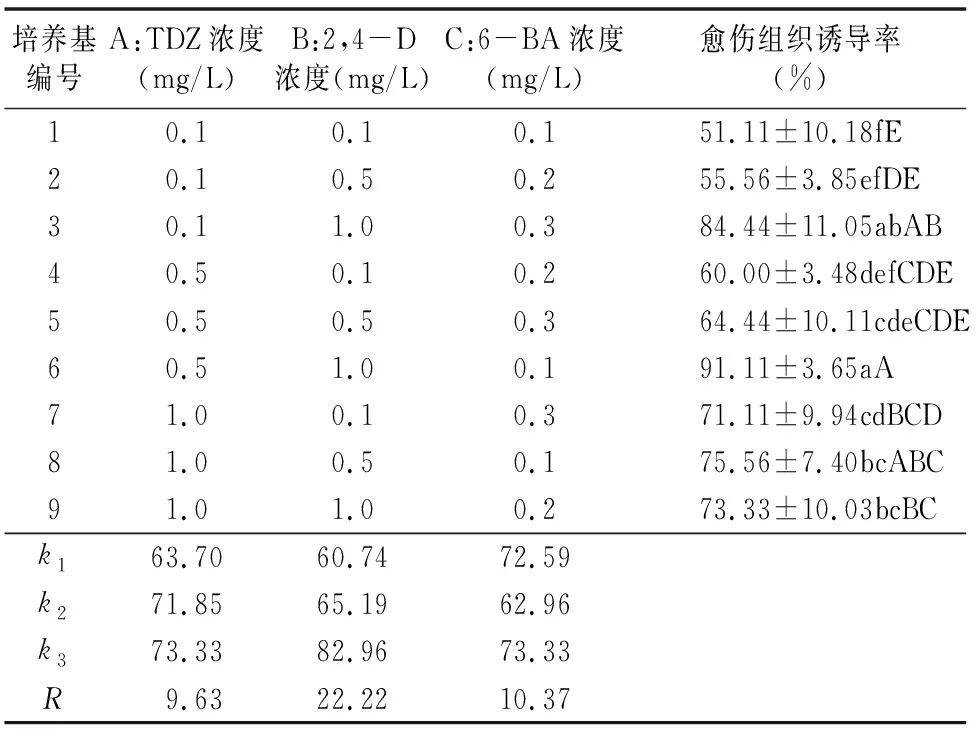
表3 不同水平组合对兴化龙香芋愈伤组织诱导的影响
注:同列数据后标有不同大写、小写字母分别表示差异极显著(P<0.01)、显著(P<0.05)。表5、表7、表9同。
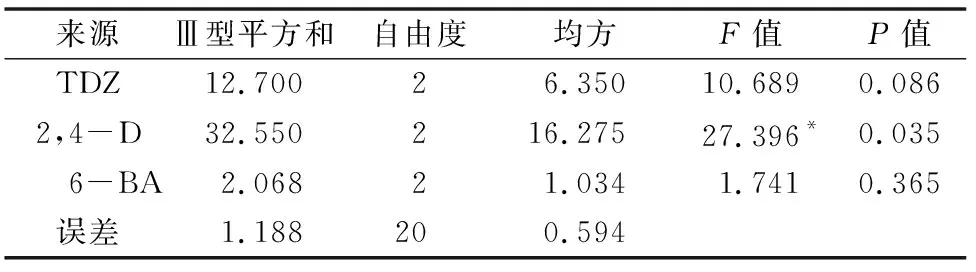
表4 兴化龙香芋愈伤组织诱导率的方差分析结果
注:愈伤组织诱导率的R2=0.976(校正R2=0.902)。“*”表示差异显著(P<0.05)。

表5 不同水平组合对兴化龙香芋不定芽诱导的影响
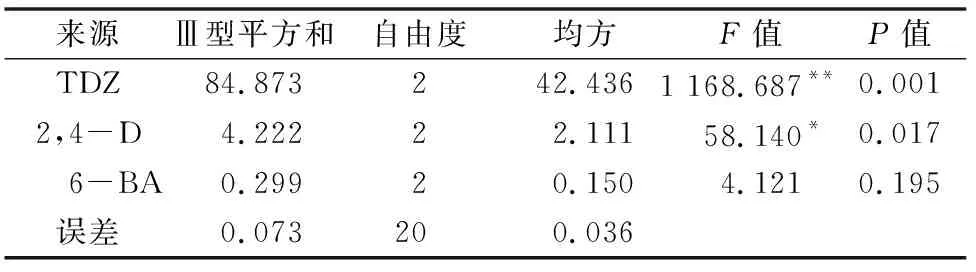
表6 兴化龙香芋愈伤不定芽诱导的方差分析结果
注:R诱导率2=0.999(校正R2=0.997)。“*”“**”分别表示差异显著(P<0.05)、极显著(P<0.01)。
2.3 不同激素水平组合对兴化龙香芋不定芽分化的影响
由表7中的R值可以看出,3种激素对不定芽分化产生的效应大小依次是TDZ>2,4-D>6-BA。由表8的方差分析结果可知,各水平的TDZ对不定芽分化率和增殖系数均有显著影响。综合分析可以确定,本试验条件下不定芽分化的最佳激素组合为1.0 mg/L TDZ+1.0 mg/L 2,4-D+0.2 mg/L 6-BA。

表7 不同水平组合对兴化龙香芋不定芽分化的影响

表8 兴化龙香芋愈伤不定芽诱导方差分析结果
注:R分化率2=0.986(校正R2=0.944),R增殖系数2=0.961(校正R2=0.845)。“*”表示差异显著(P<0.05)。
2.4 不同激素水平组合对兴化龙香芋组培苗生根诱导的影响
兴化龙香芋组培苗接种在生根培养基内10 d左右时,开始长出白色根毛;15~20 d时根毛向四周生长,并形成粗壮根系;30 d左右时生根数达到3~5条,根长为2~6 cm;40 d后可以炼苗;经过3~5 d的炼苗,将幼苗移栽到营养土基质中,30 d后移栽成活率达到100%。生根过程详见图2。
由表9可以看出,NAA、6-BA和活性炭3个因素对不定芽诱导生根的效应排序是NAA>活性炭>6-BA。由表9、表10可以看出,NAA对不定芽生根具有显著影响,其次是6-BA 和活性炭,此结论与极差分析所得结论一致。综合分析可知,兴化龙香芋不定芽诱导生根的最佳培养基为 1/2MS+0.5 mg/L NAA+0.1 mg/L 6-BA+0.2 mg/L活性炭+30 g/L蔗糖。
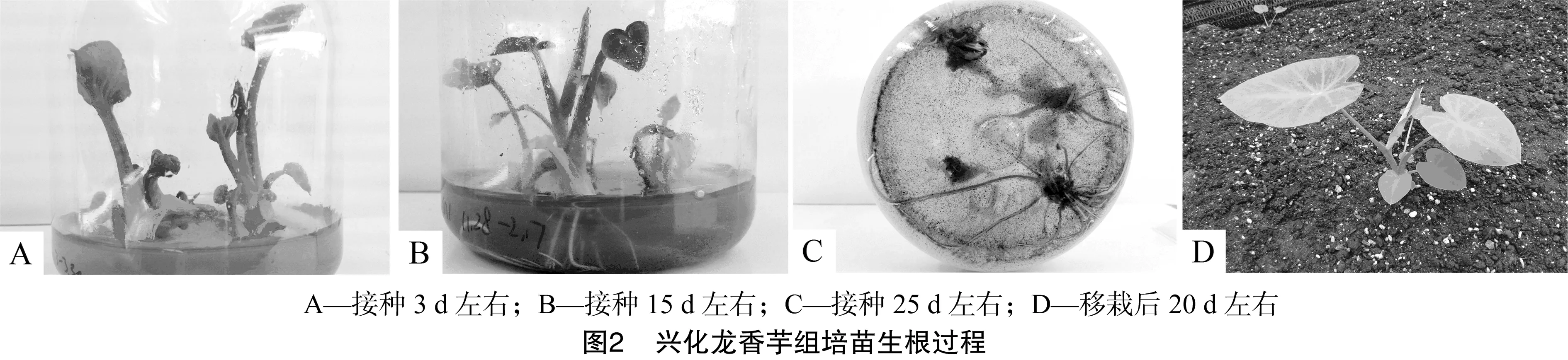
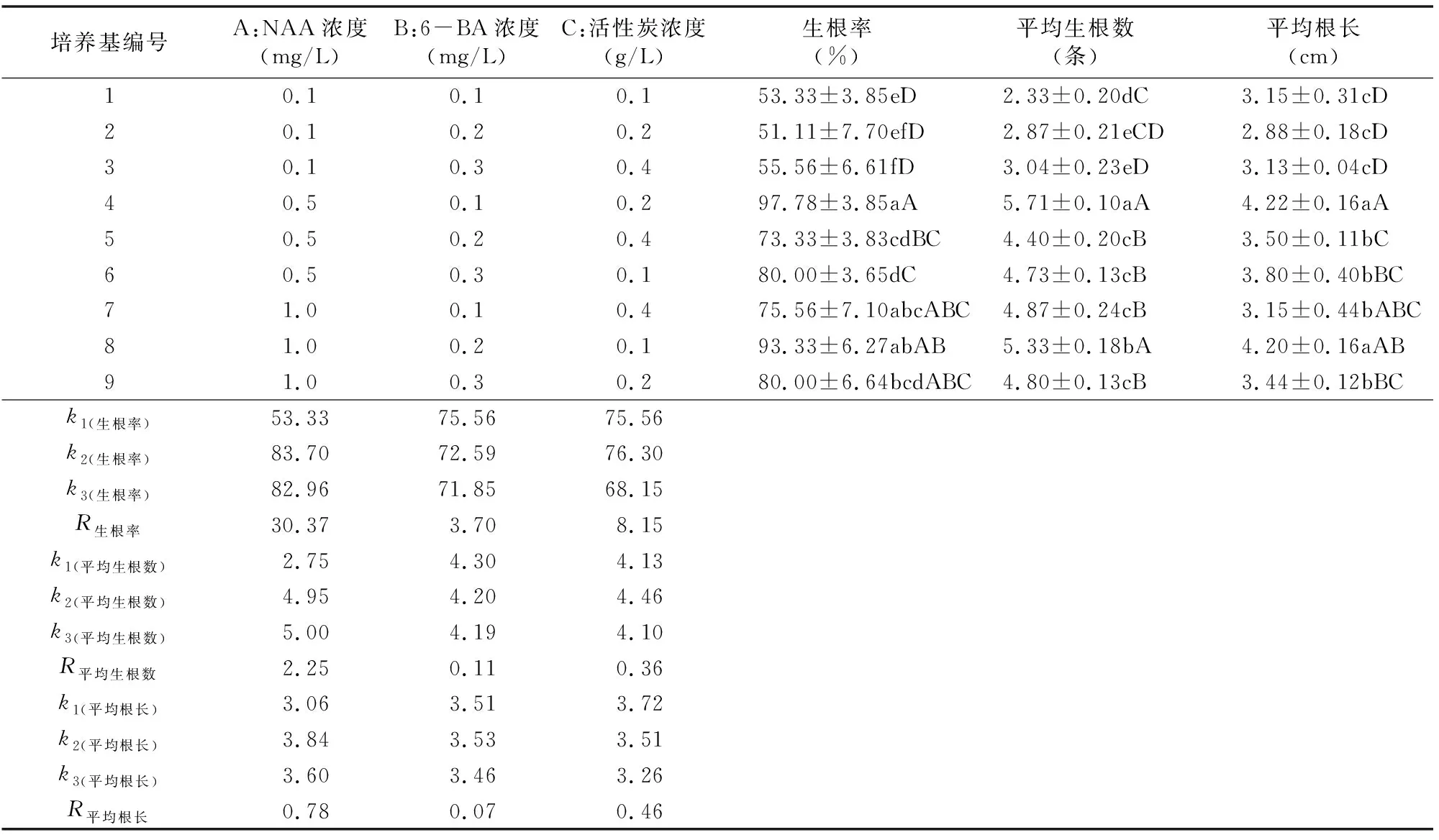
表9 不同水平组合对兴化龙香芋组培苗生根的影响

表10 兴化龙香芋愈伤不定芽诱导方差分析结果
注:R生根率2=0.984(校正R2=0.937),R平均生根数2=0.971(校正R2=0.883),R平均根长2=0.961(校正R2=0.846)。“*”表示差异显著(P<0.05)。
3 讨论
由于芋类植物长期的无性繁殖,使病毒在其植株中不断积累、扩散,导致病毒病害逐年加重,造成芋头产量和品质下降,出现严重的品种退化[7]。目前,在生产上危害较大的病毒病主要有芋花叶病毒病、黄瓜花叶病毒病、芋杆状病毒病等[2]。但是,目前在生产中还没有一种能够完全免疫病毒病的芋品种,因此,对兴化龙香芋开展茎尖脱毒快繁技术的研究十分必要。通过植物茎尖培养是目前获得无病毒材料最有效的手段[8],目前,茎尖培养脱病毒技术已经在以营养繁殖为主的植物中得到了广泛应用,并在马铃薯、甘薯、大蒜、香蕉等作物上取得了明显的增产效果[9-15]。
关于芋组织培养和快速繁殖技术的研究报道很多,但是对于不同的芋品种,相应的培养基组分和激素配方存在差异。柏新富等研究了莱阳孤芋的茎尖分生组织离体培养技术,最终获得试管苗增殖培养基为MS+0.2 mg/L NAA+1.0 mg/L 6-BA,试管苗生根培养基为MS+0.05 mg/L NAA+0.15 mg/L 6-BA[16]。詹忠根等对奉化大芋艿的茎尖脱毒苗进行研究,发现采用MS+2.0 mg/L 6-BA+0.2 mg/L NAA培养基的不定芽诱导率为75%,在培养基中添加芋头汁、椰子汁等有机物可以实现不定芽继代繁殖和诱导生根一步完成[17]。刘独臣等对四川芋品种乌杆枪的茎尖离体培养进行研究,得到适宜的茎尖不定芽诱导培养基为MS+1.0 mg/L TDZ+0.2 mg/L NAA,适宜的生根培养基为MS+0.05 mg/L NAA+0.1 mg/L 6-BA[18]。韩晓勇等对靖江香沙芋进行组织培养快繁技术研究,结果获得适宜的芽诱导培养基为MS+0.5 mg/L TDZ,最适的继代增殖培养基为MS+1.0 mg/L TDZ,最适生根培养基为1/2MS+0.1 mg/L 6-BA+0.5 mg/L NAA+0.02%活性炭[19]。以上结果说明,对于不同来源和基因型的芋植物组织培养,其增殖分化生根等过程所需要的激素种类和浓度不尽相同,因此对于不同的芋品种开展组织培养,需要对培养基组分和培养条件进行比较和探索,以建立相应的组织培养技术体系。
本研究采用正交设计方式,研究了激素的种类、浓度及其配比对兴化龙香芋组织培养的影响,与传统单因素试验相比,正交试验能容纳更多的因素和水平,最大限度地减少试验误差,从而提高试验结果的准确率。本研究结果表明,2,4-D对兴化龙香芋愈伤组织诱导的影响最大,适宜的愈伤组织诱导培养基为MS+0.5 mg/L TDZ+1.0 mg/L 2,4-D+0.1 mg/L 6-BA+30.0 g/L蔗糖;在不定芽诱导和增殖过程中,3种激素对兴化龙香芋不定芽诱导率和增殖系数的影响大小依次是TDZ > 2,4-D > 6-BA,不定芽诱导和增殖的适宜培养基分别为MS+0.5 mg/L TDZ+1.0 mg/L 2,4-D+0.1 mg/L 6-BA+30.0 g/L蔗糖和MS+1.0 mg/L TDZ+1.0 mg/L 2,4-D+0.2 mg/L 6-BA+30.0 g/L蔗糖;适宜的生根培养基为1/2 MS+0.5 mg/L NAA+0.1 mg/L 6-BA+0.2 mg/L活性炭+30.0 g/L蔗糖。
