基于植物转座子的分子标记研究进展
2019-01-09何虎翼樊吴静唐洲萍李丽淑谭冠宁何新民
何虎翼, 樊吴静, 唐洲萍, 杨 鑫, 李丽淑, 谭冠宁, 何新民
(广西农业科学院经济作物研究所,广西南宁 530007)
1 植物转座子
植物转座子是广泛分布于植物基因组中的一类能从染色体的一个位置跳跃到另一个位置或者另一条染色体的DNA序列。根据转座机制的不同可分为DNA转座子和反转录转座子。DNA转座子是一类由DNA介导,通过“剪切-复制”进行转座的可移动元件,包括微型反向重复转座元件(miniature inverted repeat transposable elements,简称MITEs)和Helitron,其插入位点多态性丰富、拷贝数多。MITEs两端由末端反向重复序列(terminal inverted repeat,简称TIR)和靶位点重复序列(target site duplication,简称TSD)组成,富含 T/A,其转座主要依靠自主型DNA转座子的转座酶。反转录转座子是一类广泛分布于植物基因组的由RNA介导,通过“复制-粘贴”进行转座的可移动遗传因子。根据是否具有长末端重复元件(long terminal repeat,简称LTR)又可分为LTR反转录转座子和非LTR反转录转座子,其中LTR反转录转座子包括2种类型——Ty1-copia和Ty3-gypsy,非LTR反转录转座子包括长散在核重复序列(long interspersed nuclear element,简称LINE)和短散在核重复序列(short interspersed nuclear element,简称SINE)。植物转座子具有拷贝数丰富、插入位点多态性、高度异质性等特点,非常适合用来开发分子标记。
2 基于植物转座子的分子标记类型
目前基于反转录转座子的分子标记技术主要包括序列特异扩增多态性(sequence-specific amplification polymorphisms,简称S-SAP)、反转录转座子序列间扩增多态性(inter-retrotransposon amplified polymorphism,简称IRAP)、反转录转座子-微卫星扩增多态性(retrotransposon-microsatellite amplified polymorphism,简称REMAP)、基于反转录转座子的插入多态性(retrotransposn-based insertion polymorphisms,简称RBIP)。S-SAP标记技术来源于扩增片段长度多态性(amplified fragment length polymorphism,简称AFLP),由限制性内切酶Pst1和Mse1消化基因组DNA,通过连接接头进行预扩增和选择性扩增,在同一位置片段的有无有判断其多态性。不仅可以检测反转录转座子内部变异,还可以用来检测插入位点的多态性[1]。IRAP标记技术是利用基于反转录转座子LTR区域设计的引物,通过PCR扩增出相邻同一家族的反转录转座子成员间的片段,从而检测反转录转座子插入位点间的多态性[2]。REMAP标记技术是利用基于反转录转座子LTR区域和微卫星序列设计的引物,通过PCR扩增出反转录转座子与相邻微卫星间的片段,从而检测反转录转座子与简单重复序列间的多态性[2]。RBIP标记技术是以PDR1反转录转座子设计引物,筛选基因组文库,通过测序获得该反转录转座子及两侧翼的碱基序列,再通过设计特异引物组合A/E或C/E产生PCR扩增产物[3]。这些基于转座子的分子标记技术普遍具有共显性、高多态性和高重复性等特征,已广泛应用于遗传多样性分析、变异鉴定和遗传连锁图谱构建等方面。
3 基于植物转座子的分子标记应用
3.1 遗传多样性分析
基于PDR1的S-SAP标记技术显示豌豆属可分为Pisumfulvum、Pisumabyssinicum、Pisumspp.等3组[4]。基于Tps12、Tps19和PDR1的S-SAP标记揭示了55份不同豌豆种间和种内的关系[5]。基于Tms1元件的S-SAP标记技术非常适合用来研究紫花苜蓿的遗传多样性[6]。基于BARE-1、BAGY-1、BAGY-2、Sabrina、Nikita、Sukkula等6个反转录转座子家族的S-SAP分子标记可以用来比较大麦的遗传多样性[7]。基于Vine-1的S-SAP扩增能有效分析葡萄的遗传多样性[8]。基于Ty1-copia 类反转录转座子的S-SAP标记技术可用于检测不同生态型黄瓜材料间的多态性[9]。利用不同酶切组合S-SAP引物建立了适用于糯玉米的DNA图谱[10]。利用10个S-SAP引物组对28份柿属基因型种质进行遗传多样性分析,发现MseI与反转录转座子引物组扩增性能最优[11]。基于反转录转座子的25对S-SAP引物将28份柿属植物聚为2组[12]。利用S-SAP标记技术检测短芒大麦突变系种群的遗传多样性,发现种群遗传变异主要存在于种群内[13]。利用基于杨梅Ty1-copia类反转录转座子LTR序列设计的18个S-SAP引物将48份杨梅试材分为3个组,分组结果与地域来源基本一致[14]。
基于2个不同类copia反转录转座子的IRAP标记技术将克莱门柚分成北非和西班牙2组,分组结果与地理来源基本一致[15]。利用基于反转录转座子IRAP标记技术可以将59份烤烟品种分为14个类群[16]。为分析茄子遗传多样性,根据马铃薯和烟草反转录转座子LTR区域设计引物并建立了茄子IRAP分子标记体系[17]。用基于马铃薯和烟草反转录转座子LTR区域设计的2组引物将34份茄子材料分为3大类群[18]。通过优化各影响因素,建立了稳定的香菇IRAP分子标记技术体系[19]。与ISSR方法相比,用IRAP标记分析烟草种质资源遗传多样性的品种间遗传相异系数和多态性比率更高[20]。利用基于小麦反转录转座子Wis2-1A的IRAP标记技术可将21个小麦品种聚成6大类群[21]。沈玉英等利用基于梅Ty1-copia反转录转座子的IRAP标记技术体系研究了梅的遗传多样性和亲缘关系[22]。杜晓云等利用IRAP标记技术揭示了部分柿属种间倍性进化关系[23]。基于Ty1-copia类反转录转座子的IRAP标记技术也适用于检测火龙果IRAP多态性[24]。利用IRAP标记可以区分36份小麦材料的抗性强弱关系[25]。李慧等利用IRAP标记技术研究显示,湖北省建始县的“关口葡萄”与欧美杂交杂种亲缘关系最近,其来源可能与“尼加拉”和“白香蕉”有关[26]。崔博文等利用29条IRAP引物将12份马尾松种质分为3类,并构建了DNA指纹图谱[27]。王燕等利用IRAP标记技术将48份柿属植物区分为野生君迁子居群、柿品种和浙江柿种质3组[28]。贾春平等基于4个稻属反转录转座子的LTR区域设计引物,用IRAP标记方法分析新疆粳稻种质资源的遗传多样性,发现多态性比率为93.4%的Houba/Tos5/Osr13引物最适合于DNA指纹图谱数据库构建,以0.55为阀值将37份新疆粳稻品种(系)分为6大类群[29]。10个IRAP引物可将49份江西柿属种质资源分为柿、油柿、野柿3种[30]。
沈玉英等利用REMAP标记技术将24个梅品种聚为3组[31]。通过Ty1-copia类反转录转座子LTR保守区域和ISSR设计引物,王东等建立了甜瓜属REMAP分子标记技术体系[32]。为鉴定中国水仙种质资源遗传多样性,林晓红等建立了优化的REMAP技术体系[33]。马忠友等建立了一种基于MITEs的分子标记方法,可广泛应用到水稻及其他植物上[34]。利用AhMITE转座子标记技术可以鉴定花生栽培种及高世代材料的亲缘关系[35]。基于植物转座子的分子标记在遗传多样性中的应用详见表1。
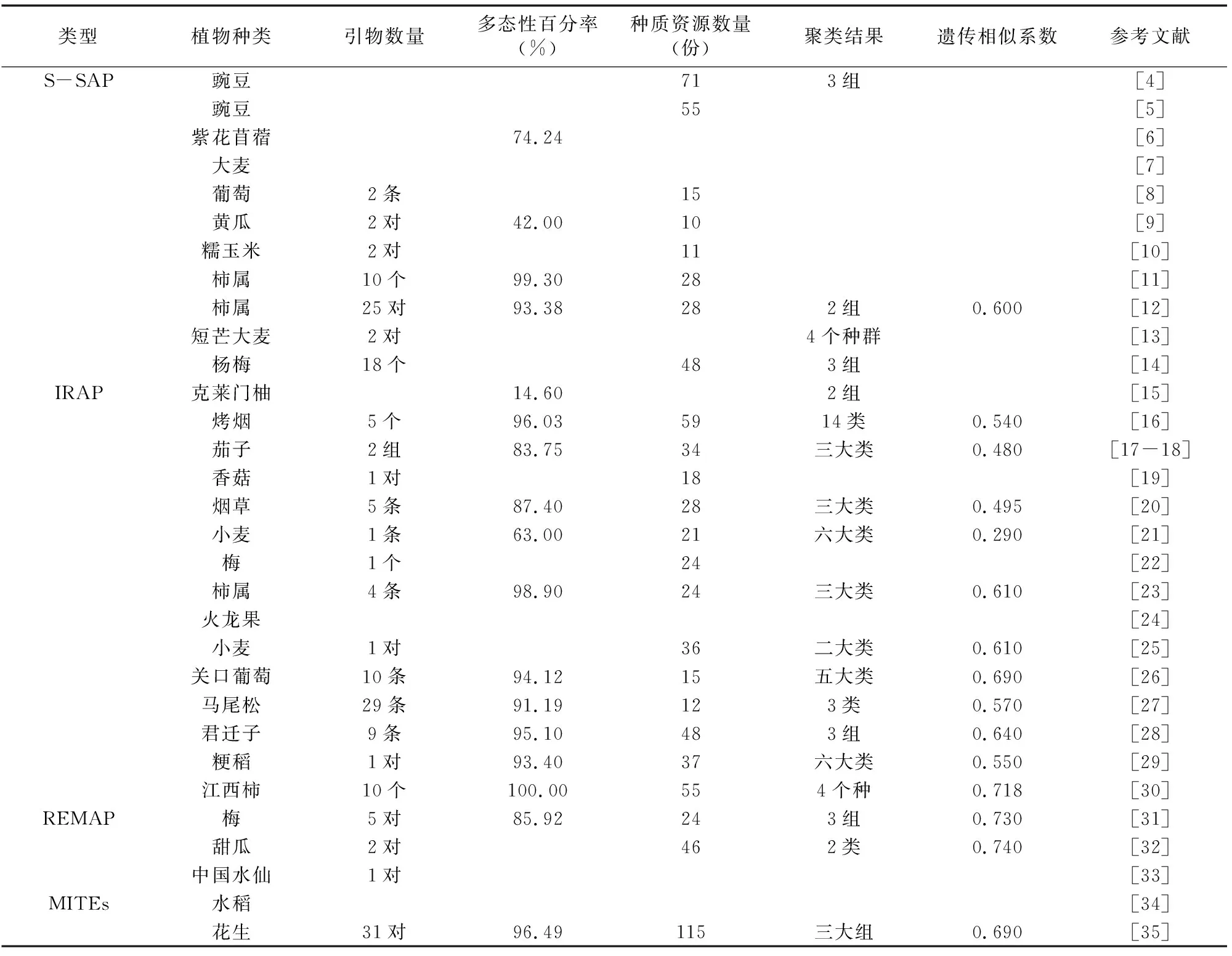
表1 基于植物转座子的分子标记在遗传多样性中的应用
3.2 变异鉴定
利用S-SAP标记技术发现富士苹果芽变品种产生可能与反转录转座子的插入有关[36]。利用基于苹果Ty1-copia类反转录转座子建立S-SAP标记技术可以区分元帅苹果芽变[37]。一个基于苹果查尔酮合成酶基因启动子的特异性片段可以用来鉴定芽变材料发生的性状变异[38]。何平等用7对基于反转录转座子的S-SAP标记引物将15个苹果芽变品种区分为嘎拉系、元帅系和富士系[39]。基于普通欧柑特异片段的S-SAP标记技术可鉴别青瓯柑品种[40]。
基于反转录转座子的单引物IRAP-PCR可以有效建立33份柿属植物基因型的DNA指纹图谱,可以区分芽变品种[41]。基于反转录转座子序列开发的分子标记可用来鉴定族毛麦染色质,提高小麦-族毛麦易位系的利用价值[42]。基于苹果反转录转座子LTR保守区域设计引物的IRAP标记技术可以鉴定部分芽变品种[43]。通过利用IRAP引物鉴定元帅苹果和富士苹果无性系芽变,揭示转座插入和反转录转座子间重组是苹果无性系变异的重要机制[44]。利用IRAP标记技术构建的苹果指纹图谱,可以作为短枝和着色芽变鉴定的依据[45]。基于反转录转座子引物IRAP标记可鉴定遗传背景高度相似的磨盘柿芽变[46]。林晓红等利用IRAP标记技术研究中国水仙自然变异体,发现转座子插入和反转录转座子间重组是中国水仙变异的重要机制[47]。IRAP引物标记可用于分析金枣柿实生后代的遗传变异[48]。利用基于旱酥梨及其红皮芽变Ty1-copia反转录转座子的IRAP标记技术可以建立DNA指纹图谱[49]。
成文革等用REMAP标记技术分析吉生羊草体细胞无性系变异,发现其遗传相似性系数范围比ISSR技术要大[50]。冯荣芳等用基于反转录转座子的REMAP标记技术证实红翎菜科海藻存在较高程度变异[51]。基于AhMITE1转座子标记技术可以有效鉴定花生F1代杂种的真实性[52]。利用AhMITE1转座子标记可对栽培种花生F1代杂交种子的真伪进行鉴定[53]。基于植物转座子的分子标记在变异鉴定中的应用详见表2。
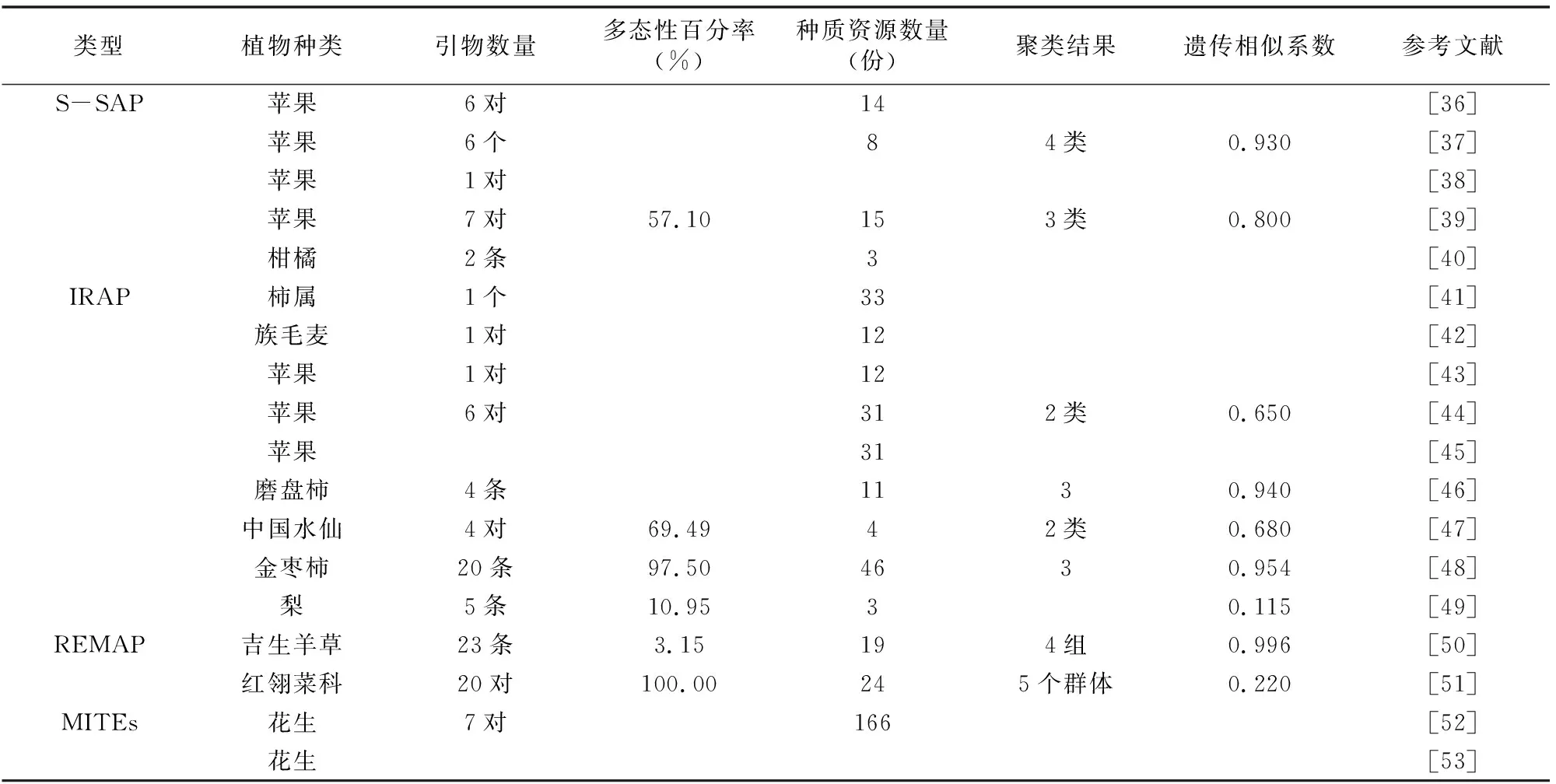
表2 基于植物转座子的分子标记在变异鉴定中的应用
3.3 遗传连锁图谱构建
基于Ty1-copia反转录转座子LTR区域设计的引物可以分析棉属不同种,构建棉花高密度遗传图谱[54]。王利英等根据大麦和烟草反转录转座子Bare-1、Tto1的LTR区域设计引物,建立了茄子IRAP和REMAP分子标记技术体系[55]。用基于烟草反转录转座子Tnt1的LTR区域设计的引物可将32个百合品种完全区分[56]。李芳等利用基于萝卜Ty1-copia 反转录转座子的IRAP标记技术构建了14个萝卜品种指纹图谱[57]。在基于MITEs结构特征开发的119条引物中,21个MITEs位点间多态性(inter-MITE polymorphism,简称IMP)标记可以整合定位到1个SSR标记的遗传连锁图谱上[58]。基于植物转座子的分子标记在遗传连锁图谱构建中的应用详见表3。

表3 基于植物转座子的分子标记在遗传连锁图谱构建中的应用
4 结论
植物转座子是广泛分布于植物基因组中的一类可移动元件,可分为DNA转座子和反转录转座子。植物转座子拷贝数丰富、插入位点多态性、高度异质性等特点,非常适合用来开发分子标记。本研究在了解国内外研究现状的基础上,分析基于植物转座子的S-SAP、IRAP、REMAP、RBIP等分子标记差异,归纳了这些标记在遗传多样性分析、变异鉴定以及遗传连锁图谱构建等方面的应用。随着越来越多植物全基因组序列的发布,在全基因组水平上鉴定植物转座子、高通量开发基于植物转座子的分子标记将成为可能。
