腐殖酸对低浓度百菌清的缓释增效作用
2019-01-09魏世平吴萌李桂龙江春玉刘明陈瑞蕊李忠佩
魏世平,吴萌,李桂龙,江春玉,刘明,陈瑞蕊,李忠佩
腐殖酸对低浓度百菌清的缓释增效作用
魏世平1,2,吴萌1,李桂龙1,江春玉1,刘明1,2,陈瑞蕊1,2,李忠佩1,2
(1中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室,南京 210008;2中国科学院大学,北京 100049)
【目的】明确腐殖酸对低浓度(5 mg·L-1)百菌清(chlorothalonil)的缓释增效作用,为减少农药使用量、延长农药药效提供新的科学思路,为选择新的农药增效剂提供理论依据。【方法】将腐殖酸(50 mg·L-1)添加至低浓度百菌清中,进行尖镰孢()的体外平板及液体培养,通过菌丝体生长试验及血球计数板、等温微量热技术,测定相应的抑菌率(inhibition rate,IR)、孢子体数量以及生长代谢过程中的热量排放。【结果】将对照抑菌率设定为0,腐殖酸-百菌清复配处理较百菌清处理的IR显著提高了10.29%(<0.05),相对增效达到25.33%。液体摇菌培养过程中,摇菌培养的第3天,百菌清处理与腐殖酸-百菌清复配处理的孢子数无显著差异;摇菌培养第7天,百菌清处理的孢子数极显著低于其他处理(<0.01);摇菌培养的第14天,腐殖酸-百菌清复配处理的孢子数显著低于其他处理(<0.05),而百菌清处理与对照之间无显著差异,表明腐殖酸延长了低浓度百菌清对尖镰孢孢子数增加的抑制效应。各处理的热功率-时间曲线图显示,腐殖酸-百菌清复配处理热量排放曲线在监测的72 h内未检测到热排放峰;而单独添加百菌清的处理在试验的后期重新出现热排放峰;单独添加腐殖酸处理的热排放曲线与对照曲线接近。对热功率-时间曲线相关参数进一步分析,结果显示百菌清处理的Pmax(最大热功率)显著低于对照和腐殖酸处理(<0.05),而Tmax(最大热功率时间)显著高于对照和腐殖酸处理(<0.05);腐殖酸-百菌清复配处理的Pmax、Q(整体发热量)、k(生长速率常数)均显著低于其他处理(<0.05),表明该处理病原菌的生长代谢活性显著低于其他处理,即病原菌生长代谢受到抑制的程度最大;腐殖酸处理与对照曲线各参数之间无显著差异,表明病原菌的生长代谢活性没有受到抑制,同时说明腐殖酸-百菌清复配处理中生长代谢受到的抑制作用与腐殖酸本身无关。【结论】添加腐殖酸可以显著提高低浓度百菌清对尖镰孢菌丝体生长、孢子体数量增加以及生长代谢过程中能量排放的抑制能力。将腐殖酸作为低浓度百菌清的农药增效剂,是降低百菌清用量及延长百菌清药效的有效措施。
腐殖酸;百菌清;等温微量热;缓释增效作用
0 引言
【研究意义】尖镰孢()是引起多种农作物根腐病、枯萎病的主要真菌致病菌,严重危害农作物的生长和粮食安全[1-2]。针对该致病菌的防治技术包括农业防治、物理防治、化学防治和生物防治,其中化学防治仍然是目前主要的防治手段,百菌清(chlorothalonil)、多菌灵(carbendazim)、代森锰锌(mancozeb)等杀菌剂是农业上常用的化学防治药剂[3]。作为一种广谱高效的保护性杀菌剂,百菌清被广泛应用于农业生产中,但随着使用年限的增加,防治效果逐年下降;且百菌清在水体、土壤中的累积残留量给生态环境和人类带来了新的威胁[3-5]。农业生产中如何提高农药药效,进而减少农药的使用量,成为一种研究趋势[6]。农药增效剂是解决这一生态环境问题的重要途径[7]。【前人研究进展】越来越多的绿色农药增效剂应用到农业生产中,如植物油、生物碱、萜烯、茶皂素、腐殖酸等[8-11]。研究证明腐殖酸能够通过理化作用与农药形成复合物,降低农药毒性,减少环境污染,是一种较好的农药缓释增效剂。腐殖酸类物质在结构单元组成上包含大量的活性基团,如羧基、羰基、醇羟基、醌基等,这些活性基团使得腐殖酸-农药复配体系在杀菌、杀虫等过程中发挥了重要的作用[12]。研究发现,腐殖酸类物质可作为甲基托布津、多菌灵等农药的增效剂[13]。王任明等[14]通过室外盆栽接虫和田间小区试验,得出黄腐酸对杀虫脒存在较好的增效作用;金平等[15]用1% NaOH提取出泥炭的腐殖酸,将其与克露复配喷施黄瓜叶片,从生理机制上证明了腐殖酸对克露起到增效作用。【本研究切入点】目前还未见腐殖酸对百菌清缓释增效作用的报道。另外,田间接种和生理指标测定的试验方法存在工作量大、耗时长等弊端,因此,探索一种新的试验方法实现对农药增效剂的有效筛选意义重大。等温微量热技术在医学上已经普遍用于检测药物活性及其定量构效关系的研究(quantitative structure-activity relationship,QSAR)[16-17],但利用等温微量热技术来筛选农药增效剂的研究未见报道。【拟解决的关键问题】将腐殖酸与农药百菌清同时添加至纯菌培养基中,通过测定病原菌菌丝体的净生长量以及孢子体数量,探索腐殖酸-百菌清复配体系对尖镰孢体外生长的直接影响,同时利用等温微量热仪监测复配体系及单独添加处理生长代谢过程中的热排放,实时监测微生物代谢活性的变化,为农药增效剂的选择提供新的筛选方法以及衡量指标,为扩大腐殖酸在农业领域的应用提供理论依据,为我国煤矿、泥炭等腐殖酸材料来源的充分利用提供新的途径。
1 材料与方法
试验于2017年7月至2018年6月在中国科学院南京土壤研究所土壤与农业可持续发展国家重点实验室完成。
1.1 腐殖酸材料来源及提取、纯化
供试腐殖酸材料来源于褐煤,购自内蒙古自治区乌海市同升商贸有限责任公司,其腐殖酸的提取、纯化过程参考文献[18-19]。经元素分析仪测定该腐殖酸含碳565.5 g·kg-1,氮15.1 g·kg-1,硫5.1 g·kg-1,氧339.4 g·kg-1。13C固态核磁光谱显示,其化学组成中各碳组分的相对比例为烷基碳11.6%,甲氧基/酰胺碳0.6%,烷氧碳0.7%,异头碳3.4%,芳香碳64.8%,芳香族碳氧8.5%,羰基碳10.5%。
1.2 病原菌来源
供试菌种尖镰孢购自中国农业科学院农业资源与农业区划研究所中国农业微生物菌种保藏管理中心,为花生根腐病致病菌株。
1.3 菌丝体体外平板培养试验
试验设置4个处理,分别为PSA(potato sugar agar)培养基对照、单独添加低浓度百菌清处理、单独添加腐殖酸处理以及同时添加腐殖酸和低浓度百菌清的处理。
PSA固体培养基配方:200 g马铃薯加蒸馏水煮沸,小火煮20 min,加20 g蔗糖和18 g琼脂粉,定容至1 L,115℃灭菌,30 min。PSA液体培养基的配制不添加琼脂粉。
将腐殖酸和百菌清用二甲基亚砜(dimethyl sulfoxide,DMSO)溶解,并用含有200 μg·mL-1乳化剂的无菌蒸馏水稀释至相应浓度,腐殖酸添加浓度为50 mg·L-1,百菌清添加浓度为5 mg·L-1。吸取1 mL检测液至无菌培养皿中(直径9 cm),加入9 mL的PSA固体培养基。菌丝接种环的直径约5 mm,将致病真菌接种至各处理培养皿的中间位置,25℃培养72 h,测量菌丝体的生长直径,每处理 3—4个重复。
1.4 孢子体计数
试验处理同1.3,但固体培养基改为不添加琼脂的PSA液体培养基。将致病菌从平板上接种至PSA液体培养基中,30℃摇菌培养48 h(摇菌时间根据孢子浓度适当调整),吸取一定体积的菌悬液至含有新鲜培养基的不同处理中,接种后孢子初始浓度控制在2.5×105个/mL[17,20],将各处理菌悬液置于25℃摇菌,分别于摇菌培养的第3、7、14、33天采样进行孢子数计数。使用血球计数板进行计数,血球计数板规格为25个中方格×16个小方格,选择左上、左下、右上、右下以及中央的中方格进行孢子计数,对于临界的孢子体需遵循数上不数下,数左不数右的原则,最后折算为各摇菌瓶中的孢子总数。
1.5 热动力学试验
试验处理同1.4,4 mL的安培瓶内最终上机液体体积为3 mL,其中包含各处理相应量的菌悬液、DMSO、腐殖酸、百菌清及PSA液体培养基。菌悬液配制同1.4,最终上机真菌孢子数同样为2.5×105个孢子/mL。将安培瓶置于TAM III(TA Instruments,Utah,USA)检测通道中,设定油浴温度为25℃恒温,代谢反应过程中的功率-时间曲线被连续监测72 h(根据试验结果可适当调整)。用TAM assistant软件对热排放曲线进行处理,汇总各热排放曲线的相关参数,包括最大热功率(Pmax)、最大热功率时间(Tmax)、整体发热量(Q)和生长速率常数k[21-23]。
1.6 数据处理与统计分析
根据真菌菌丝体净生长量计算抑菌率(inhibition rate,IR),计算公式:IR(%)=100×(对照菌丝体净生长量-处理菌丝体净生长量)/对照菌丝体净生长量。
腐殖酸-百菌清复配处理的相对增效(%)=100×(复配处理抑菌率-百菌清处理抑菌率)/百菌清处理抑菌率。
热功率-时间曲线中生长速率常数k是由OriginPro8.0中Exponential进行指数模型拟合得到。各处理抑菌率、孢子数以及热排放曲线相关参数的单因素方差分析和Tukey B、Duncan多重比较由SPSS 25.0完成。
2 结果
2.1 腐殖酸对百菌清抑制病原菌菌丝体生长的作用
将对照抑菌率(IR)设为0,得到各处理对尖镰孢的IR(表1)。表1中百菌清、腐殖酸以及腐殖酸-百菌清复配处理对尖镰孢的IR均大于0,即各处理均存在抑制作用。同时,腐殖酸-百菌清复配处理的IR较百菌清处理有显著的提高,相对增效为25.33%,表明腐殖酸对低浓度百菌清抑制尖镰孢菌丝体生长存在显著的增效作用。

表1 不同处理对尖镰孢的抑菌率
数据后不同字母表示Tukey B多重比较差异显著(<0.05)
Different letters behind the values indicate significantly different at<0.05 level by Tukey B multiple comparisons
2.2 腐殖酸对百菌清抑制病原菌孢子体数量增加的作用
利用血球计数板对各处理不同培养时间采样的真菌孢子体进行计数,结果见图1。摇菌培养的第3天,对照与腐殖酸处理的孢子数极显著大于百菌清处理与腐殖酸-百菌清复配处理,而百菌清处理与腐殖酸-百菌清复配处理的孢子数之间无显著差异;摇菌培养第7天,对照的孢子数极显著大于腐殖酸处理及腐殖酸-百菌清复配处理,而百菌清处理的孢子数极显著小于其他处理;摇菌培养第14天,腐殖酸-百菌清复配处理的孢子数显著小于其他处理,而百菌清处理与对照之间无显著差异。以上结果表明腐殖酸对低浓度百菌清抑制尖镰孢孢子数增加的效应存在显著的延长作用。

图中同一培养时间下处理间不同字母为Duncan多重比较结果。*:差异显著(P<0.05);**:差异极显著(P<0.01)
2.3 腐殖酸对百菌清抑制病原菌生长代谢的作用
各处理尖镰孢热功率-时间曲线见图2。热功率-时间曲线图显示腐殖酸处理与对照的热排放曲线接近,表明两个处理中病原菌的生长代谢过程相近,即腐殖酸对病原菌在生长代谢过程中的热量排放未检测到抑制作用。而百菌清处理与对照、腐殖酸处理差异较大,在监测初期热量排放曲线接近直线,百菌清对病原菌的生长起到了很好的抑制作用,这一过程主要来自百菌清杀灭病原菌的作用,随着监测时间的延长,热排放峰又重新出现,表明百菌清对病原菌的药效减弱,病原菌重新开始生长产生代谢热。腐殖酸-百菌清复配处理从监测初期开始热排放一直呈现直线状态,表明代谢热的排放始终受到抑制。从图3也可以看出,4个处理经微量热仪72 h、25℃恒温监测培养后,只有腐殖酸-百菌清复配处理的安培瓶中未见明显的菌丝,这与热功率-排放曲线的结果一致。
热功率-时间曲线的Pmax、Tmax、Q和k是用于评估微生物代谢活性的相关参数,其中Pmax、Q和k与代谢活性成正相关,而Tmax与代谢活性成负相关。各处理热功率-时间曲线的相关参数(图4)经进一步的统计分析得到,百菌清处理的Pmax显著低于对照和腐殖酸处理,而Tmax显著高于对照和腐殖酸处理,表明病原菌生长代谢活性受到百菌清的显著抑制。腐殖酸-百菌清复配处理的Pmax、Q、k均显著低于其他处理,表明该处理病原菌的生长代谢活性显著低于其他处理,即病原菌生长代谢受到抑制的程度最大。腐殖酸处理与对照各参数之间无显著差异,表明病原菌的生长代谢活性没有受到抑制,同时说明腐殖酸-百菌清复配处理中生长代谢受到的抑制作用与腐殖酸本身无关。由于腐殖酸-百菌清复配处理的热排放曲线接近直线,故Tmax在初始时最大。综上,腐殖酸对百菌清杀灭尖镰孢存在显著的缓释增效作用。

图2 不同处理尖镰孢的热功率-时间曲线

1:对照control;2:百菌清处理chlorothalonil treatment;3:腐殖酸处理humic acid treatment;4:腐殖酸和百菌清复配处理humic acid-chlorothalonil combined treatment
3 讨论
通过尖镰孢体外培养和热动力学技术,本研究证实了腐殖酸对低浓度百菌清的缓释增效作用,增效作用提高的抑菌率与前人总结的10%—20%的增效范围相符[12]。目前在农业生产上,腐殖酸的主要应用包括作为土壤调节剂来改善土壤属性,以及作为植物刺激素来促进植物生长和增加作物产量[24-26]。而本研究的结果为拓展腐殖酸的应用范围提供了理论依据,即将腐殖酸作为农药增效剂来增加和延长百菌清的药效。早期的研究中,李善祥[12]就指出腐殖酸作为一种高效、无公害、低成本、多功能的农药增效剂有着广阔的发展前景,并且将腐殖酸的增效机理概括为:(1)腐殖酸与农药之间的化学作用,使得农药的化学结构发生变化从而导致其活性结构的改善;(2)腐殖酸没有明显影响农药的化学结构,但增加了农药的表面活性、膜透性、生理生化作用以及吸附作用等。金平等[15]研究证实了腐殖酸对克露的增效作用,其生理机制主要是因为腐殖酸-克露复配处理降低了黄瓜叶片脯氨酸、丙二醛的含量以及质膜透性、黄瓜霜霉病的病情指数,从而促进了黄瓜的生长,提高了黄瓜的产量及谷胱甘肽的含量;于宏伟等[9]认为黄腐酸是一种胶体物质,同时具有表面活性剂的作用,对有机农药具有强烈的吸附作用,并且使难溶于水相的农药更好地分散,以此来增加杀菌剂的杀菌效果;Abdel- Monaim等[27]利用可溶性腐殖酸钾颗粒与苯并噻二唑(benzothiadiazole,BTH)浸泡大豆种子,在大田种植条件下,腐殖酸钾-苯并噻二唑复配体系浸泡后的处理能够有效地抵抗尖镰孢对大豆植株的危害;复配处理植株的过氧化物酶(PO)、多酚氧化酶(PPO)、苯丙氨酸解氨酶(PAL)3种酶活性和酚含量最高。腐殖酸钾增效的机理为增加的PO和PPO活性可以产生氧化形式的醌,这可能有助于增加防御能力,因为氧化形式的醌可以灭活病原菌产生的果胶酶。PAL是一种苯丙类化合物的关键酶,它会导致各种与防御有关的植物次生代谢物的产生,如水杨酸、植物抗毒素和类木质素聚合物等。
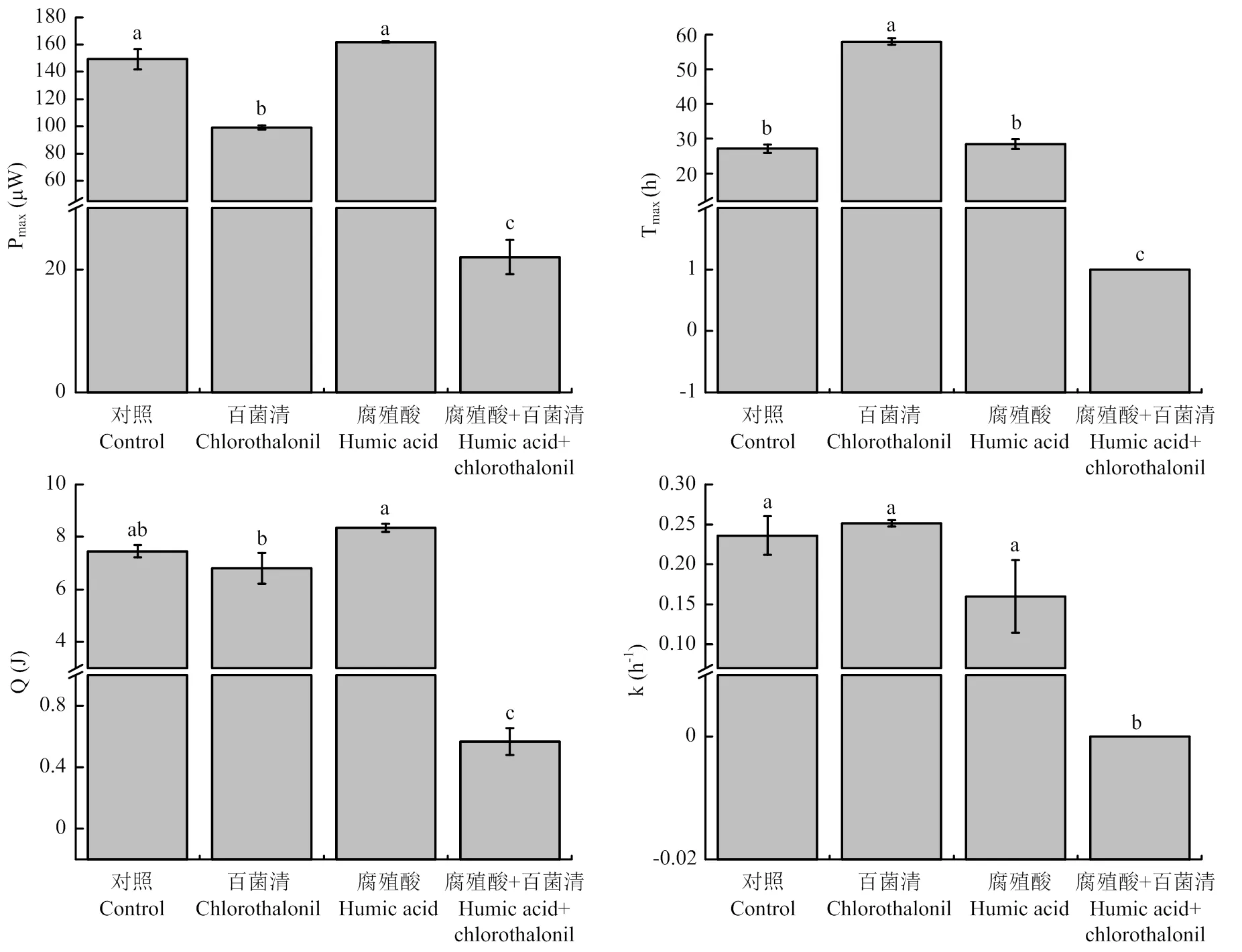
柱上不同字母表示Tukey B多重比较差异显著(P<0.05)
本研究中,百菌清处理的热功率-时间曲线从生长代谢方面较好地体现了百菌清的重要杀菌机理,即通过对病原菌糖酵解过程产生影响而起到杀灭致病菌的作用。糖酵解过程中,3-磷酸甘油醛在磷酸甘油醛脱氢酶(GAPDH)的催化下,转变为1,3-二磷酸甘油酸,同时将氧化过程产生的能量贮存到三磷酸腺苷(ATP)分子中。而百菌清分子中的活性氯能够与磷酸甘油醛脱氢酶上的-SH结合,生成一种复合物,从而使酶的活性丧失,中断糖酵解过程中3-磷酸甘油醛的脱氢氧化,影响ATP的产生[28-29]。等温培养初期百菌清抑制了病原菌的糖酵解过程,没有热量排放,故热排放曲线接近直线,后期随着百菌清药效的降低,病原菌糖酵解过程恢复,重新出现热排放峰。腐殖酸-百菌清复配处理,其热功率-时间曲线始终为近似直线排放,笔者推断在腐殖酸存在的条件下,百菌清对病原菌糖酵解过程的影响增大,且对能量产生的抑制作用更持久,从而无法出现热排放峰。这与张国生等[7]总结的农药增效剂主要作用机理相一致,即农药增效剂是通过抑制或弱化靶标(害虫、杂草、病菌等)对农药活性的解毒作用,延缓药剂在防治对象内的代谢速度,从而增加防治效果。后续还需对腐殖酸的结构以及对腐殖酸-百菌清复配体系中的相关酶活性、谷胱甘肽含量等进行研究测定,从而对作用机理有更深入的了解。同时,为了更好地诠释腐殖酸缓释增效作用的机理,下一步还需要涉及更多不同来源、结构组成的腐殖酸。
本研究中等温微量热技术与病原菌离体培养试验结果的一致性表明等温微量热技术应用于农药增效剂筛选具有可行性。在应用生物学和医学领域,等温微热技术的非标记和被动属性可以对复杂的三维结构进行测量(如微观组织),以此来代替破坏性的常规分析(如DNA或蛋白质的量化)[30]。在土壤学领域,微量热技术与高效气液相色谱、高通量测序等技术的结合,有望在土壤微生物活性与结构的地理属性、气候变化、土壤质量的空间大尺度比较和外源污染物的生物毒性评价等方面发挥其重要作用[31]。Tafin等[17]在纯培养条件下,利用等温微量热技术估算两性霉素B、卡泊芬净等组合对两株曲霉(和)的抑制活性,研究证实微量热技术具有实时评估药物组合抑真菌活性的潜力。等温微量热技术同时还具备操作方便、检测灵敏、材料消耗少且重现性好等优势,具有很好的应用前景。
4 结论
腐殖酸对低浓度百菌清存在显著的缓释增效作用。在低浓度百菌清体系中添加腐殖酸,可以显著增加低浓度百菌清对尖镰孢的抑菌率,抑制尖镰孢孢子体数量的增加和生长代谢过程。将腐殖酸作为百菌清的农药增效剂具有生产和商业应用潜力。等温微量热技术作为筛选农药增效剂新的方法及衡量指标具有可行性。
[1] 张述义, 李新凤, 韦晓艳, 王建明. 33株尖孢镰刀菌遗传多样性的ISSR分析. 生态学杂志, 2013, 32(5): 1195-1202.
ZHANG S Y, LI X F, WEI X Y, WANG J M. Genetic diversity of 33strains: an ISSR analysis., 2013, 32(5): 1195-1202. (in Chinese)
[2] LI X G, BOER W D, ZHANG Y N, DING C F, ZHANG T L, WANG X X. Suppression of soil-bornepathogens of peanut by intercropping with the medicinal herb., 2018, 116: 120-130.
[3] 伊海静, 陈艳, 刘正坪, 王有年, 杨晓, 刘俊. 草莓枯萎病菌的分离鉴定及防治药剂筛选. 西北农业学报, 2016, 25(4): 626-635.
YI H J, CHEN Y, LIU Z P, WANG Y N, YANG X, LIU J. Isolation and identification of strawberrywilt pathogen and fungicides screening., 2016, 25(4): 626-635. (in Chinese)
[4] ARUL DHAS D, HUBERT JOE I, ROY S D D, FREEDA T H. DFT computations and spectroscopic analysis of a pesticide: chlorothalonil., 2010, 77(1): 36-44.
[5] ZHANG H, NIE Y, ZHANG S Q, WANG W Z, LI H D, Wang F G, LV X, CHEN Z L. Monitoring and probabilistic risk assessment of chlorothalonil residues in vegetables from shandong province (china)., 2016, 80: 41-45.
[6] WANG J, CHOW W, CHANG J, WONG J W. Development and validation of a qualitative method for target screening of 448 pesticide residues in fruits and vegetables using UHPLC/ESI Q-orbitrap based on data-independent acquisition and compound database., 2017, 65(2): 473-493.
[7] 张国生, 汪灿明, 郑瑞琴. 浅谈农药增效剂现状及应用前景. 浙江化工, 2000, 31(4): 18-20.
ZHANG G S, WANG C M, ZHENG R Q. Brief discussion in current situation and application prospect of pesticide synergist., 2000, 31(4): 18-20. (in Chinese)
[8] 胡绍海, 胡卫军, 胡卫东, 张志成, 周社文. 茶皂素在化学农药乳油剂中增效作用研究. 中国农业科学, 1998, 31(2): 30-35.
HU S H, HU W J, HU W D, ZHANG Z C, ZHOU S W. Study on the synergism of tea saponin in the chemical insectcides EC., 1998, 31(2): 30-35. (in Chinese)
[9] 于宏伟, 段书德, 牛辉, 张东红. 绿色农药增效剂的研究进展. 江苏农业科学, 2010(2): 142-143, 167.
YU H W, DUAN S D, NIU H, ZHANG D H. Progress in research on green pesticide synergist., 2010(2): 142-143, 167. (in Chinese)
[10] 叶长东. 一种包含黄腐酸的农药增效组合物及其用途: CN 102626106 A [P]. (2012-08-08) [2018-07-10].
YE C D. Fulvic acid-containing pesticide synergistic composition and use thereof: CN 102626106 A [P]. (2012-08-08) [2018-07-10]. (in Chinese)
[11] RADHIKA S, SAHAYARAJ K, SENTHIL-NATHAN S, Hunter W B. Individual and synergist activities of monocrotophos with neem based pesticide, vijayneem againstFab., 2018, 101: 54-68.
[12] 李善祥. 腐植酸类物质与农药——研究应用与展望. 腐植酸, 2002(2): 17-25.
LI S X. Progress in research and application on interaction between humic substances and pesticides., 2002(2): 17-25. (in Chinese)
[13] 王天立, 赵永德, 赵颖, 邢黎. 黄腐酸对防治蔬菜病害的增效作用. 河南化工, 1995(4): 31-32.
WANG T L, ZHAO Y D, ZHAO Y, XING L. Synergistic effect of fulvic acid on vegetable disease prevention., 1995(4): 31-32. (in Chinese)
[14] 王任明, 张岩峰. 黄腐酸对农药杀虫脒的增效作用初探. 江西化工, 2001(1): 38-40.
WANG R M, ZHANG Y F. The positive effect of the yellow humic acid to the pesticide., 2001(1): 38-40. (in Chinese)
[15] 金平, 陶波, 张淑华. 腐殖酸对克露增效作用的生理机制初探. 东北农业大学学报, 2003, 34(1): 7-9.
JIN P, TAO B, ZHANG S H. The initial study on the biological mechanism of the humic acid to improve the effect of cours., 2003, 34(1): 7-9. (in Chinese)
[16] MANNECK T, BRAISSANT O, HAGGENMULLER Y, KEISER J. Isothermal microcalorimetry to study drugs against., 2011, 49(4): 1217-1225.
[17] TAFIN U F, ORASCH C, TRAMPUZ A. Activity of antifungal combinations againstspecies evaluated by isothermal microcalorimetry., 2013, 77: 31-36.
[18] WU M, SONG M Y, LIU M, JIANG C Y, LI Z P. Fungicidal activities of soil humic/fulvic acids as related to their chemical structures in greenhouse vegetable fields with cultivation chronosequence., 2016, 6: 32858.
[19] WEI S P, WU M, LI G L, LIU M, JIANG C Y, Li Z P. Fungistatic activity of multiorigin humic acids in relation to their chemical structure., 2018, 66(28): 7514-7521.
[20] 何笃贵, 李强国, 杨德俊, 李旭, 叶丽娟, 魏得良, 黄熠, 张辉, 刘义. RE (C7H5O3)2(C9H6NO)配合物抗真菌作用的热动力学研究. 中国稀土学报, 2007, 25(1): 107-110.
HE D G, LI Q G, YANG D J, LI X, YE L J, WEI D L, HUANG Y, ZHANG H, LIU Y. Thermokinetics study of antifungal functions of complexes of rare earths with salicylic acid and 8-hydroxyquinoline., 2007, 25(1): 107-110. (in Chinese)
[21] BARROS N, GOMEZ-ORELLANA I, FEIJOO S, BALSA R. The effect of soil moisture on soil microbial activity studied by microcalorimetry., 1995, 249: 161-168.
[22] 冯有智, 林先贵. 微量热法在土壤微生物研究中的应用进展. 土壤, 2012, 44(4): 535-540.
FENG Y Z, LIN X G. Advances in the application of microcalorimetry in soil microbiology research., 2012, 44(4): 535-540. (in Chinese)
[23] JING Z W, CHEN R R, WEI S P, FENG Y Z, ZHANG J W, LIN X G. Response and feedback of C mineralization to P availability driven by soil microorganisms., 2017, 105: 111-120.
[24] DOSKOCIL L, GRASSET L, VALKOVA D, PEKAR M. Hydrogen peroxide oxidation of humic acids and lignite., 2014, 134: 406-413.
[25] FAN H M, WANG X W, SUN X, LI Y Y, SUN X Z, ZHENG C S. Effects of humic acid derived from sediments on growth, photosynthesisand chloroplast ultrastructure in chrysanthemum., 2014, 177: 118-123.
[26] TANG Y, YANG Y, CHENG D, GAO B, WAN Y, LI Y C. Value-added humic acid derived from lignite using novel solid-phase activation process with Pd/CeO2nanocatalyst: a physiochemical study., 2017, 5(11): 10099-10110.
[27] ABDEL-MONAIM M F, ISMAIL M E, Morsy K M. Induction of systemic resistance of benzothiadiazole and humic acid in soybean plants againstwilt disease., 2011, 39(4): 290-298.
[28] 杨谦. 植物病原菌抗药性分子生物学. 2版. 北京: 科学出版社, 2011.
YANG Q.. Beijing: Science Press, 2011. (in Chinese)
[29] 付国良, 黄晓红. 甘油醛-3-磷酸脱氢酶功能的研究进展. 生物物理学报, 2013, 29(3): 181-191.
FU G L, HUANG X H. Progress on research of functions of glyceraldehyde-3-phosphate dehydrogenase., 2013, 29(3): 181-191. (in Chinese)
[30] BRAISSANT O, KEISER J, MEISTER I, BACHMANN A, WIRZ D, GOPFERT B, BONKAT G, WADSO I. Isothermal microcalorimetry accurately detects bacteria, tumorous microtissues, and parasitic worms in a label-free well-plate assay., 2015, 10(3): 460-468.
[31] 姜兰兰, 刘燕, 郑世学. 等温微量热技术在土壤微生物学研究中的应用. 应用与环境生物学报, 2016, 22(4): 732-738.
JIANG L L, LIU Y, ZHENG S X. Applications of isothermal microcalorimetry in study on soil microbial activity., 2016, 22(4): 732-738. (in Chinese)
Slow-release synergistic effect of humic acidon low concentration chlorothalonil
WEI ShiPing1, 2, WU Meng1, LI GuiLong1, JIANG ChunYu1, LIU Ming1, 2, CHEN RuiRui1,2, LI ZhongPei1,2
(1State Key Laboratory of Soil and Sustainable Agriculture, Institute of Soil Science, Chinese Academy of Sciences, Nanjing 210008;2University of Chinese Academy of Sciences, Beijing 100049)
【Objective】The objective of this study is to clarify the slow-release synergistic effect of humic acid on low concentration (5 mg·L-1) of chlorothalonil, provide a new scientific idea for reducing pesticide use and prolonging pesticide efficacy, and to provide a theoretical basis for selecting new fungicide synergists. 【Method】was culturedsolid and liquid medium including low concentrations of chlorothalonil with or without 50 mg·L-1humic acid addition. The inhibition rate (IR) and spore number were determined through mycelium growth test and blood counting chamber. The heat released during the growth and metabolism process ofwas measured by isothermal microcalorimetry technology. 【Result】The IR of humic acid-chlorothalonil combined treatment significantly increased by 10.29% (<0.05) when IR of control was set to 0. The relative synergism was 25.33%. During liquid shake culture, there was no significant difference in spore number between the chlorothalonil treatment and humic acid-chlorothalonil combined treatment on the 3rd cultured day. On the 7th cultured day, the spore number of chlorothalonil treatment was significantly lower than that of other treatments (<0.01). On the 14th cultured day, the spore number of humic acid-chlorothalonil combined treatment was significantly lower than other treatments (<0.05), while there was no significant difference in spore number between chlorothalonil treatment and control. It showed that humic acid extended the inhibitory effect of low concentration chlorothalonil on the increase of spore number. The heat flow-time curve of each treatment showed that no heat release peak was detected in the humic acid-chlorothalonil combined treatment within 72 hours of monitoring, while that in the chlorothalonil treatment was found in later monitoring, and the heat flow-time curve of humic acid treatment was close to the control. Pmax(peak power) of the chlorothalonil treatment was significantly lower than that of the control and humic acid treatment (<0.05), while the Tmax(peak power time) was significantly higher than that of the control and humic acid treatment (<0.05). Pmax, Q (total heat evolution), and k (microbial growth rate constant) of the humic acid-chlorothalonil combined treatment were all significantly lower than other treatments (<0.05), which indicated that the pathogen metabolic activity of the combinated treatment was significantly lower than that in other treatments. That is, the growth and metabolism ofwere most inhibited. There was no significant difference in Pmax, Tmax, Q, and k between the humic acid treatment and control, that is, the inhibition effect of humic acid treatment on pathogen was not monitored, and which could verify that the inhibition effect of combined treatment was irrelevant to humic acid itself.【Conclusion】The addition of humic acid can significantly enhance the ability of low concentration chlorothalonil to inhibit the growth of mycelia, increase of spore number and heat emission during growth and metabolism process of. Using humic acid as a fungicide synergist of chlorothalonil is an effective measure to reduce the amount of chlorothalonil and extend the efficacy.
humic acid; chlorothalonil; isothermal microcalorimetry; slow-release synergistic effect
10.3864/j.issn.0578-1752.2019.01.007
2018-07-10;
2018-08-17
国家自然科学基金(41430859)、江苏省自然科学基金面上项目(BK20181510)、南京土壤研究所“一三五”计划和领域前沿项目(ISSASIP1642)
魏世平,Tel:025-86881313;E-mail:spwei@issas.ac.cn。吴萌,E-mail:mwu@issas.ac.cn。魏世平和吴萌为同等贡献作者。通信作者李忠佩,Tel:025-86881505;E-mail:zhpli@issas.ac.cn
(责任编辑 岳梅)
