甜菜夜蛾卵黄原蛋白受体基因的RNA干扰
2019-01-09赵静陶蓉郝德君肖留斌谭永安
赵静,陶蓉,郝德君,肖留斌,谭永安
甜菜夜蛾卵黄原蛋白受体基因的RNA干扰
赵静1,2,陶蓉1,郝德君1,肖留斌2,谭永安2
(1南京林业大学南方现代林业协同创新中心/林学院,南京 210037;2江苏省农业科学院植物保护研究所,南京 210014)
【目的】卵黄原蛋白受体(vitellogenin receptor,VgR)是介导昆虫卵黄原蛋白胞吞作用的主要受体,通过RNA干扰(RNAi)方法研究甜菜夜蛾()的功能,为深入了解甜菜夜蛾生殖生理的分子机制及开发有效防治新方法提供依据。【方法】以甜菜夜蛾雌成虫腹部的cDNA为模板,通过PCR克隆得到甜菜夜蛾基因片段,其包含配体结合域功能区。绿色荧光蛋白基因()片段通过特异性引物从笔者实验室保存的质粒上扩增。将和目的片段连入pMD-19T载体后进行测序,利用DNAMAN软件分析基因序列的准确性。以测序验证正确的质粒作为DNA模板,利用带T7启动子的引物进行PCR扩增。用T7 RiboMAXTMExpress RNAi System合成试剂盒合成-dsRNA和-dsRNA。应用10 μL微量进样器在化蛹第2、6天的甜菜夜蛾雌蛹腹部注射3 μL双链RNA(2 μg·μl-1)。利用RT-qPCR技术检测甜菜夜蛾刚羽化、羽化24 h、羽化48 h雌成虫的表达量变化,同时统计对照组(空白对照、注射-dsRNA)和处理组(注射-dsRNA)甜菜夜蛾的羽化率及单雌产卵量。【结果】 扩增得到和基因片段,大小分别为327和417 bp。RT-qPCR 检测结果表明,与对照组相比,注射dsRNA后甜菜夜蛾的表达水平显著下降。对于刚羽化、羽化24 h、羽化48 h的雌成虫,注射-dsRNA处理组的表达量相比注射-dsRNA的对照组分别下降了79.35%、84.22%、67.68%。通过解剖观察刚羽化、羽化24 h、羽化48 h的甜菜夜蛾卵巢,发现注射-dsRNA处理组与注射-dsRNA对照组相比, 卵巢发育进度显著推迟。对于羽化24 h的甜菜夜蛾,与注射-dsRNA组相比,注射-dsRNA处理组卵巢管长度下降了23.92%;注射-dsRNA组的卵巢成熟卵粒较多,平均直径为(0.46±0.05)mm,而注射-dsRNA处理组成熟卵粒数量较少且相对较小,平均直径为(0.23±0.02)mm。注射-dsRNA组和-dsRNA组的羽化率无显著差异。注射-dsRNA处理组的单雌平均产卵量只有170粒,而对照组(空白对照和注射-dsRNA)单雌平均产卵量可达到451粒和420粒,处理组与对照组的产卵量存在显著差异。【结论】通过体外注射dsRNA的方法研究的功能,能够显著降低表达。在甜菜夜蛾的生殖中起着不可替代的作用,直接影响甜菜夜蛾卵巢的发育与产卵量,可以作为控制甜菜夜蛾的潜在靶标。
甜菜夜蛾;卵黄原蛋白受体基因;RNA干扰;卵巢发育
0 引言
【研究意义】卵黄原蛋白(vitellogenin,Vg)的合成与摄取是昆虫卵黄形成的关键因素[1-2],其含量高低直接影响雌成虫产卵潜力。卵黄原蛋白受体(vitellogenin receptor,VgR)是介导昆虫卵黄原蛋白胞吞作用的主要受体,对昆虫卵巢的成熟起着至关重要的作用,是研究控制害虫的潜在靶标[3-4]。甜菜夜蛾()作为一种世界性分布的多食性重要害虫,由于其繁殖能力强及较高的抗药性,亟待开拓减少化学农药使用的新型无公害防控手段[5-7]。因此,开展的研究,对于深入了解甜菜夜蛾生殖生理的分子机制及开发有效防治新方法具有重要意义。【前人研究进展】目前,关于昆虫的研究非常活跃,32种昆虫的序列已被克隆和测序,其中大部分是鳞翅目、双翅目和膜翅目昆虫,包括家蚕()、斜纹夜蛾()、埃及伊蚊()、红火蚁()等[8-19]。昆虫在体内合成具有发育时期和组织的特异性。大多数昆虫的属于卵巢特异性表达蛋白,例如橘小实蝇()[14]、美洲大蠊()[15]、棉铃虫()[16]等昆虫的仅在卵巢中表达。对于一些社会性昆虫如西方蜜蜂()[12]和红斑尼葬甲()[18]的研究发现,在头部、中肠等其他组织也有表达。不同昆虫的表达启动期也不同,大多数昆虫的表达发生在蛹末期或初羽化成虫之后,例如斜纹夜蛾[9]、甜菜夜蛾[17]、马德拉蜚蠊()[19]等,但在家蚕中,在雌性家蚕的整个发育周期均有表达,幼虫期表达水平较低,随后逐渐升高,在成虫期达到最大值[8]。RNA干扰(RNA interference,RNAi)是由dsRNA或siRNA通过序列配对的方式特异性地与靶标基因mRNA序列相结合,形成沉默复合体,降解靶标基因的mRNA[20]。目前,RNAi技术已广泛地应用于鳞翅目、半翅目、膜翅目、鞘翅目等多种昆虫的基因功能研究[21-26]。通过对昆虫生长发育及繁殖关键基因的鉴定和功能分析,可为开发植物或微生物介导的RNAi 技术的防治新途径提供理论依据及新的潜在靶标基因资源。Pitino等[27]将桃蚜()的两个与生长发育相关的基因(MpC002和Rack-1)分别导入烟草和拟南芥中,用转基因植物饲喂桃蚜,导致桃蚜体内的MPC002或Rack-1的表达量降低了60%,后代数量减少。然而,目前关于昆虫的功能研究仅仅局限于少数昆虫,主要关注其对昆虫卵黄形成、卵巢发育以及生殖能力的影响。如在家蚕和褐飞虱()中,通过干扰的表达,呈现卵巢发育受阻、不能产卵或产卵量下降等表型[8,26]。【本研究切入点】笔者实验室前期研究已克隆甜菜夜蛾并明确其时空表达特性[17],但甜菜夜蛾的功能尚不明确。【拟解决的关键问题】利用体外合成的甜菜夜蛾卵黄原蛋白受体保守序列dsRNA注射甜菜夜蛾,通过荧光定量PCR(RT-qPCR)分析注射后甜菜夜蛾的表达情况,研究其对甜菜夜蛾的卵巢发育和产卵量的影响,明确在卵黄合成中的作用,以期为利用RNAi技术防治甜菜夜蛾提供理论依据。
1 材料与方法
试验于2018年在江苏省农业科学院植物保护研究所完成。
1.1 材料
供试甜菜夜蛾虫源来自江苏省农业科学院植物保护研究所经济作物虫害与生防研究室。甜菜夜蛾饲养条件为温度(26.5±1)℃,相对湿度(65±5)%,光周期L﹕D=14 h﹕10 h,成虫期补充10%蜂蜜水。
1.2 甜菜夜蛾总RNA的提取和cDNA的合成
通过液氮研磨甜菜夜蛾雌成虫的腹部组织,按照试剂盒说明书用Trizol reagent(Invitrogen)提取总RNA,用50 μL的无RNA酶水溶解,-70℃保存备用。以总RNA为模板,通过M-MLV酶(Promega)反转录获得cDNA,于-20℃保存备用。
1.3 VgR基因片段的引物设计与扩增
根据笔者实验室前期已发表的甜菜夜蛾的全长序列(GenBank登录号:KT899978)[18],利用Primer5.0 软件在基因功能区设计引物-F和-R。以甜菜夜蛾cDNA为模板扩增特异性片段。绿色荧光蛋白基因()片段通过特异性引物(表1)从笔者实验室保存的质粒上扩增。PCR反应程序:94℃预变性3 min,然后按照94℃ 45 s,60℃ 30 s,72℃ 20 s,进行35次循环反应,最后于72℃延伸10 min。通过琼脂糖凝胶电泳分离与的PCR产物,并用胶回收试剂盒(Axygen)纯化回收目的DNA片段。目的片段与pMD-19T载体(TaKaRa)连接,经PCR筛选阳性克隆后,通过AxyPrep质粒小量制备试剂盒(Axygen)提取质粒送上海生工生物工程有限公司测序。利用DNAMAN软件分析该基因序列的准确性,测序正确的质粒为pMD-19T-与pMD-19T-。
1.4 VgR及GFP-dsRNA的合成与注射
以测序验证正确的质粒作为DNA模板,利用带T7启动子的引物(-TF与-R、-F与-TR;-TF与-R、-F与-TR;表1)分别进行两个基因PCR产物正义链与反义链的扩增。用1%的琼脂糖凝胶进行电泳分离回收,用T7 Ribo MAXTMExpress RNAi System(Promega)合成试剂盒合成双链RNA(-dsRNA)和双链RNA(-dsRNA),用无RNA酶水配制成2 μg·μL-1终浓度的试剂备用。
选取甜菜夜蛾化蛹第2天、大小均一的雌蛹用于注射。应用10 μL微量进样器将3 μL-dsRNA(2 μg·μL-1)从腹部靠近尾端1/3处注射。在化蛹的第6天再次注射3 μL相同浓度的-dsRNA。注射完毕后,针头停留约30 s后缓慢拔出,以免体液过多流出。试验设注射-dsRNA和不注射两个对照组。每个处理80头雌蛹,重复3次,共计240头。
1.5 甜菜夜蛾VgR RNAi的效应检测
1.5.1 甜菜夜蛾表达量的RT-qPCR检测 注射dsRNA后,取甜菜夜蛾刚羽化、羽化24 h、羽化48 h雌成虫的卵巢组织,对所搜集组织样品进行总RNA提取,cDNA合成。以注射-dsRNA和不注射为对照,每个样本设置3个生物学重复,每个重复4头虫体。以®Taq(Takara)为染料,采用LightCycler® 480 实时PCR系统进行基因扩增以及数据分析。及的RT-qPCR引物见表1。RT-qPCR总反应体系:SYBR Premix Ex Taq(2×)12.5 μL,forward primer(10 μmol·L-1)0.5 μL,reverse primer(10 μmol·L-1)0.5 μL,cDNA 2.0 μL,ddH2O 9.5 μL,总体积25 μL。反应条件:95℃ 30 s;95℃ 5 s,60℃ 20 s,72℃ 10 s,40个循环;95℃ 15 s;60℃ 1 min;95℃ 15 s。最终结果的计算采用2-ΔΔCt法(Ct表示循环数)。
1.5.2 RNAi后甜菜夜蛾卵巢发育进度的观察以及羽化率、产卵量的统计 通过统计对照组(不注射、注射-dsRNA)和注射-dsRNA处理组羽化蛹皮的数量来计算甜菜夜蛾的羽化率。解剖对照组(不注射、注射-dsRNA)和注射-dsRNA处理组甜菜夜蛾刚羽化、羽化24 h、羽化48 h雌成虫(每个处理30头)的腹部,观察卵巢发育进度。测定不同处理组羽化24 h雌成虫(每个处理20头)的卵巢管长度及成熟卵粒直径大小。选择同日羽化的成虫20对,分别饲养,逐日统计其单雌产卵量。
1.6 数据统计与分析
相对表达量、产卵量、羽化率等数据使用SPSS软件进行统计学分析,采用单因素方差分析并用Duncan’s新复极差法进行差异显著性检测,显著性检验水平<0.05。
2 结果
2.1 目的片段的扩增
利用甜菜夜蛾卵巢的总RNA和质粒为模板,分别扩增甜菜夜蛾和,获得的PCR产物电泳结果见图1,分别得到大小为327和417 bp的单一带,与预期片段大小一致。
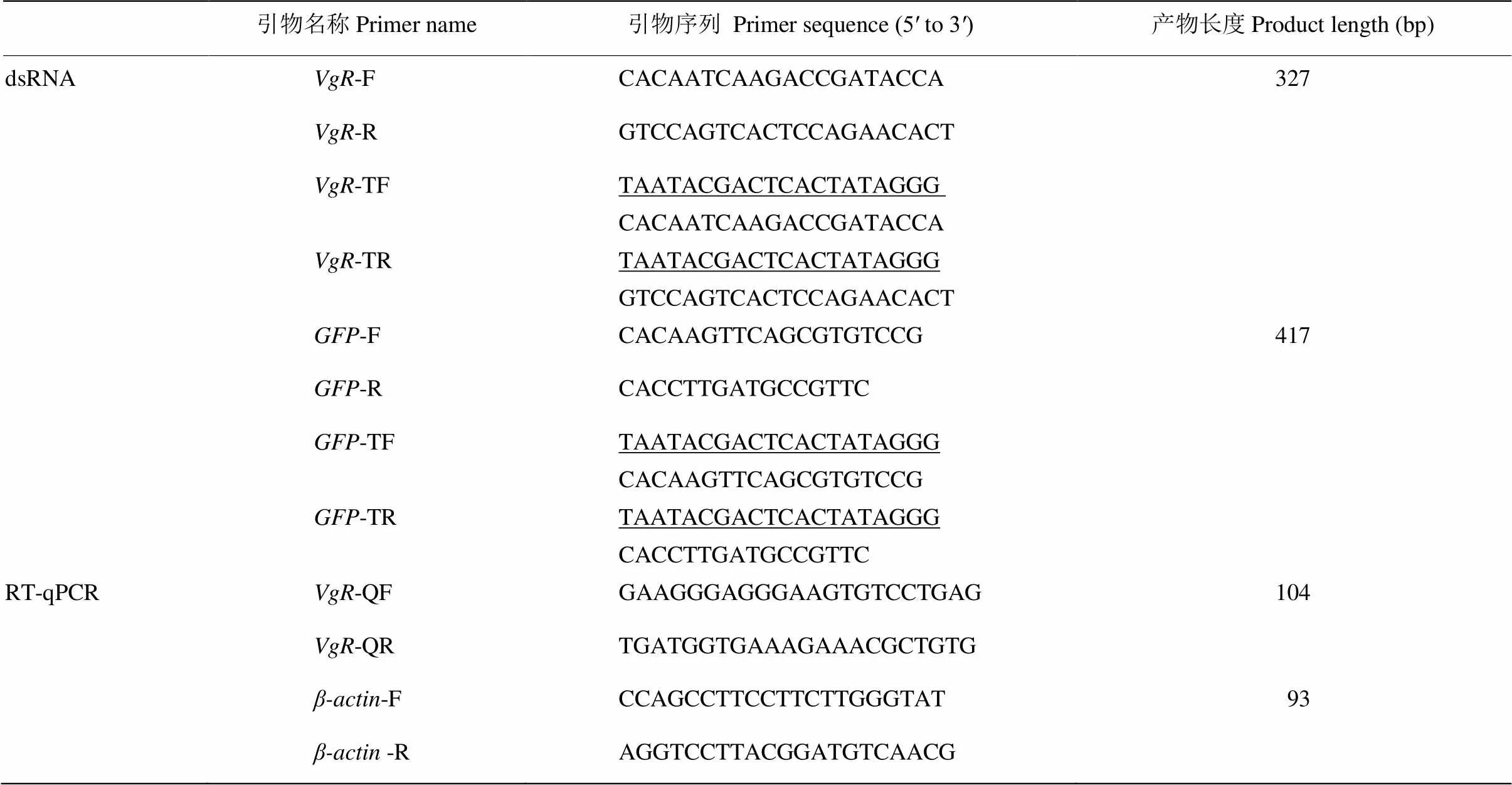
表1 本研究所用引物
下划线表示T7RNA聚合酶启动子T7RNA polymerase promoter is underlined

M: Trans2K DNA marker; 1: VgR; 2: GFP
2.2 dsRNA的合成
以pMD-19T-与pMD-19T-质粒作为DNA模板,通过PCR扩增,在目的序列的两端加上T7启动子。在T7RNA聚合酶的作用下,转录合成dsRNA,经过一系列洗涤、过柱,得到纯化的-dsRNA和-dsRNA,大小约为327和417 bp(图2),与预期片段长度大小一致。
2.3 VgR-dsRNA注射对甜菜夜蛾VgR表达量的影响
RT-qPCR检测结果表明,与对照组相比,注射-dsRNA后的表达水平显著下降(图3)。刚羽化的雌成虫,注射-dsRNA组的表达量相比注射-dsRNA的对照组下降了79.35%;羽化24 h的雌成虫,注射-dsRNA组的表达量相比注射-dsRNA的对照组下降了84.22%;羽化48 h的雌成虫,注射-dsRNA组的表达量相比注射-dsRNA的对照组下降了67.68%。表达量在不注射dsRNA(ck)和注射-dsRNA的两个对照组之间无显著差异(图3)。说明注射的dsRNA对该基因具有明显的沉默效应。

1:VgR体外转录产物dsRNA dsRNA-production of VgR transcripted in vitro;2:GFP对照Positive control of GFP
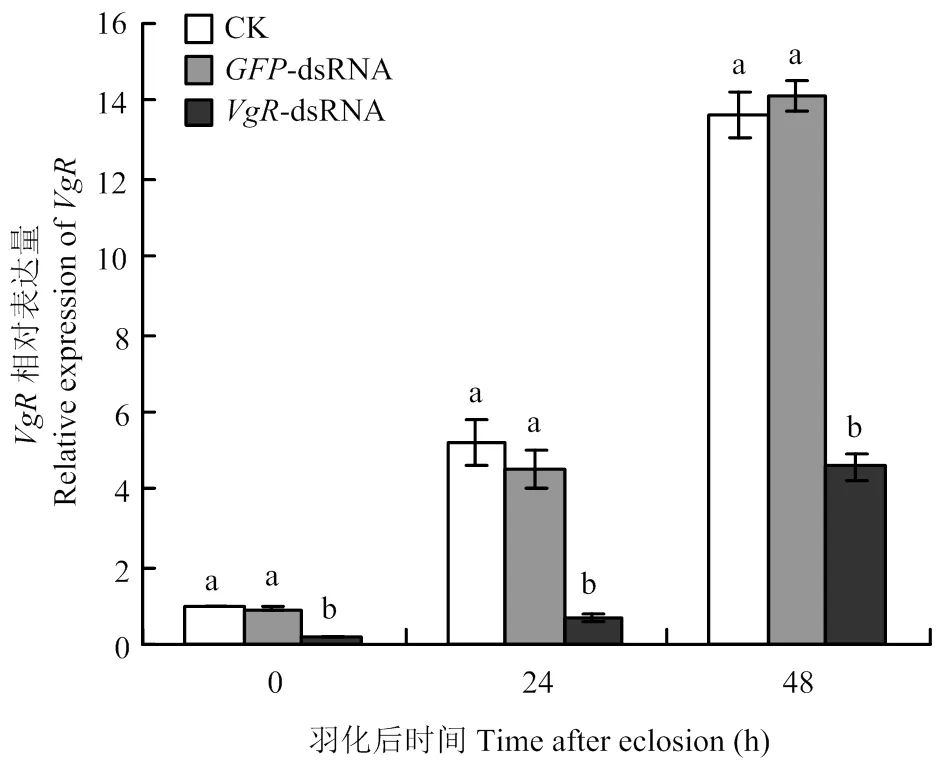
柱上标有不同小写字母表示差异显著(P<0.05)。图5同
2.4 VgR-dsRNA注射对甜菜夜蛾卵巢发育进度的影响
通过解剖观察刚羽化、羽化24 h、羽化48 h的甜菜夜蛾卵巢,发现注射-dsRNA组(图4-a、4-b、4-c)与注射-dsRNA组(图4-e、4-f、4-g)相比,甜菜夜蛾的卵巢发育进度显著推迟。测定羽化24 h的甜菜夜蛾的卵巢管长度和卵粒大小发现,注射-dsRNA组卵巢管明显缩短,成熟卵粒数量和卵粒大小明显小于注射-dsRNA对照组。注射-dsRNA组的甜菜夜蛾(羽化24 h)卵巢管长度为(24.01±1.52)mm,比注射-dsRNA组的卵巢管长度(31.56±2.03)mm下降了23.92%(图4-b、4-f);同时,注射-dsRNA组的卵巢成熟卵粒较多,平均直径为(0.46±0.05)mm(图4-h),而注射-dsRNA组成熟卵粒较少,卵粒平均直径为(0.23±0.02)mm,大部分卵粒卵黄沉积较少,处于空瘪状态(图4-d)。对于羽化48 h的甜菜夜蛾卵巢,注射-dsRNA组的干扰效率下降了67.68%,表达量有所上升(图3),此时卵母细胞中的卵黄沉积加快,卵黄含量增多,但是成熟卵粒数量还是明显少于-dsRNA对照组(图4-c、4-g)。在解剖过程中,发现注射-dsRNA组与空白对照组的卵巢发育进度并无显著差异。
2.5 VgR-dsRNA注射对甜菜夜蛾羽化率及产卵量的影响
以无注射dsRNA和注射-dsRNA的甜菜夜蛾为对照,测定注射-dsRNA后成虫的羽化率及单雌产卵量,结果见图5。可以看出,注射-dsRNA和-dsRNA的甜菜夜蛾的羽化率无显著差异,但较对照组羽化率略降低。注射-dsRNA的甜菜夜蛾单雌平均产卵量只有170粒,而空白对照和注射-dsRNA的单雌平均产卵量可达451和420粒。
3 讨论
昆虫细胞内存在将dsRNA切割成siRNA的Dicer酶,长链的dsRNA即可在昆虫中引起RNAi效应[28]。目前将体外合成的dsRNA导入昆虫活体的方法有注射法和喂食法。与喂食法相比,注射法的优点在于便于控制剂量,产生效应快,但其局限性体现在操作难度较大。迄今为止,通过注射方法实现虫体内的RNAi已经在多种鳞翅目昆虫中得以实施,如烟草天蛾()[29]、家蚕[8]、甜菜夜蛾[21]、棉铃虫[16,30]以及斜纹夜蛾[9]等。在前期研究中笔者克隆了甜菜夜蛾的全长并明确了其表达规律,发现甜菜夜蛾在卵巢特异性表达,其合成和启动期在蛹末期,表达高峰在成虫羽化48 h,这与甜菜夜蛾卵巢发育进度紧密相关[17]。因此,选择在甜菜夜蛾启动期前期(化蛹第2天)在腹部注射-dsRNA,为了加强RNAi的效果,在蛹末期又注射了相同剂量的dsRNA,表达量在甜菜夜蛾羽化24 h时降低了84%。在注射过程中,由于技术不熟练所造成的机械损伤对昆虫存活率和羽化率会有一定的影响[21]。本研究中,注射-dsRNA和-dsRNA的试虫羽化率无显著差异,但较未注射的空白对照组羽化率略降低,可能是机械损伤导致。
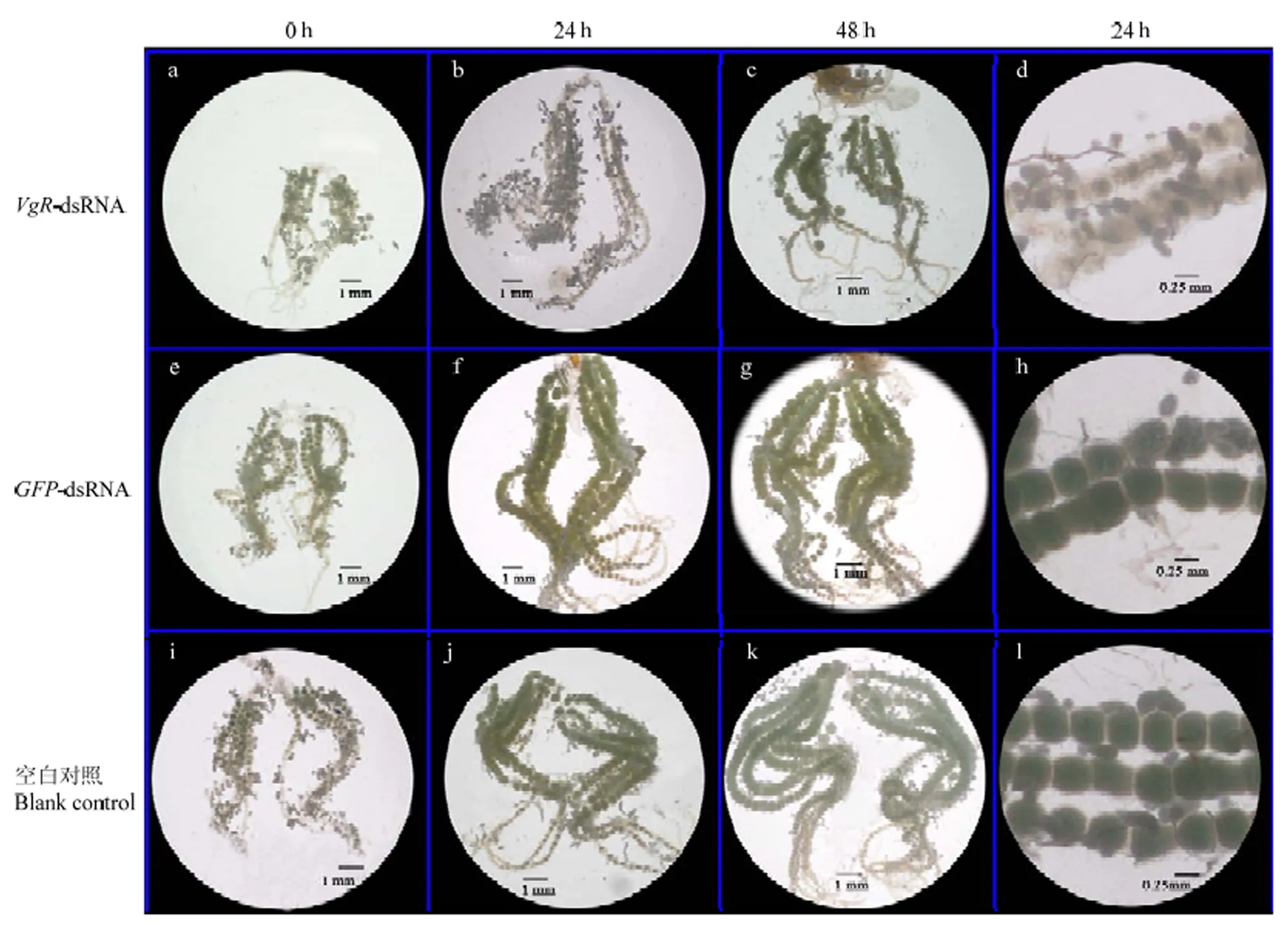
a—c:注射VgR-dsRNA后羽化不同时间段的雌成虫卵巢(0、24、48 h)the ovary of 0-, 24-, 48-hour-old adults after VgR-dsRNA injection;e—g:注射GFP-dsRNA后羽化不同时间段的雌成虫卵巢(0、24、48 h)the ovariole of 0-, 24-, 48-hour-old adults after GFP-dsRNA injection;i—k:羽化不同时间段的雌成虫卵巢(0、24、48 h)the ovary of 0-, 24-, 48-hour-old adults;d:注射VgR-dsRNA后羽化24 h的雌成虫卵巢管the ovariole of 24-hour-old adults after VgR-dsRNA injection;h:注射GFP-dsRNA后羽化24 h的雌成虫卵巢管the ovariole of 24-hour-old adults after GFP-dsRNA injection;l:羽化24 h的雌成虫卵巢管the ovariole of 24-hour-old female adults
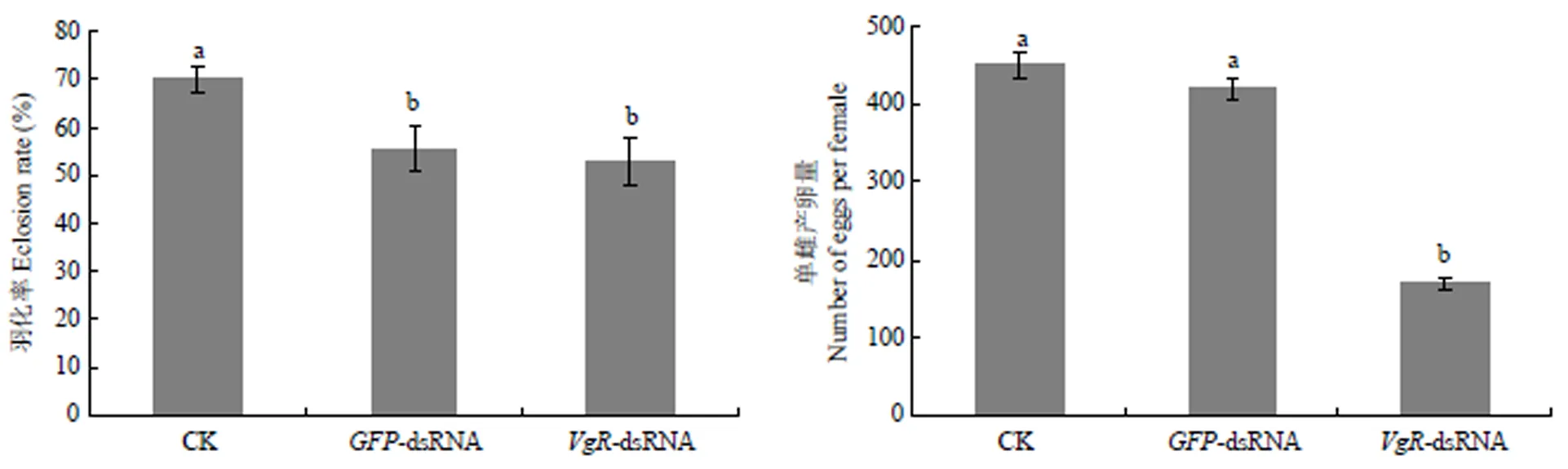
图5 注射VgR-dsRNA后甜菜夜蛾的羽化率与产卵量
昆虫有强大的生殖力,能在极短的时间内产生含有大量卵黄的成熟卵。卵黄原蛋白是卵黄的主要成分,它的存在或含量高低直接影响昆虫的生殖。目前,许多研究者为了探求合理的控制害虫生殖的方法,采用RNAi技术沉默介导Vg胞吞作用的卵黄原蛋白受体。对于昆虫进行RNAi后,重点研究其对昆虫卵黄沉积、卵巢发育进度以及生殖能力的影响。Lu等[26]通过向褐飞虱注射-dsRNA,表达量下调,卵巢表面的受体缺乏不能正常摄取Vg进入卵巢,血淋巴中Vg含量增多,最终导致褐飞虱卵巢发育停滞,不能产卵;Shang等[31]通过对蚜虫()注射-dsRNA,发现蚜虫的生殖周期有所变化,生殖前期变长,生殖期变短,后代数量下降。同时,向同一种昆虫注射不同的-dsRNA,其沉默效果也可能不同;Lin等[8]分别在家蚕蛹第1、4、7天注射两种-dsRNA,发现表达量下降程度不同,mRNA敲除率高的家蚕不能产卵,而mRNA敲除率低的家蚕最终卵粒变小变白;Shu等[9]在斜纹夜蛾的蛹期注射两种dsRNA,表型基本类似,与对照相比,血淋巴中Vg含量增多,卵巢中的Vg和VgR含量下降,产卵量显著下降。与前人研究结果相似,本研究通过用RNAi方法降低表达量后,甜菜夜蛾与生殖相关的卵巢发育受到了影响,卵母细胞中沉积的卵黄含量显著减少,卵巢管变短,直接反映生殖力的产卵量显著下降。这些结果表明mRNA表达是昆虫Vg摄取和卵发育的基础。
甜菜夜蛾是一种重要的世界性害虫,具有繁殖能力强、易产生抗药性等特点[5-6]。在昆虫的生殖中起着不可替代的作用,是卵黄发生的基础,直接影响昆虫卵母细胞的生理与形态发育、卵子的数量[3]。本研究通过体外注射dsRNA的方法研究的功能,表明通过RNAi可以显著减少甜菜夜蛾的产卵量,起到调控甜菜夜蛾生殖暴发的作用,但是如何将-dsRNA应用于甜菜夜蛾的防治(dsRNA工程微生物或转基因作物)还需要进一步深入研究。
4 结论
通过合成甜菜夜蛾功能区序列的dsRNA,体外注射后,能够显著降低表达,同时甜菜夜蛾的卵巢发育受到了影响,卵母细胞中沉积的卵黄含量显著减少,卵巢管变短,直接反映生殖力的产卵量显著下降。是甜菜夜蛾Vg摄取和卵发育的基础,可作为控制甜菜夜蛾危害的潜在靶标。
[1] 戈林泉, 吴进才. 昆虫卵黄蛋白及其激素调控的研究进展. 昆虫知识, 2010, 47(2): 236-246.
GE L Q, WU J C. Research progress in insect vitellin and its hormone regulation., 2010, 47(2): 236-246. (in Chinese)
[2] Engelmann F. Insect vitellogenin: Identification, biosynthesis and role in vitellogenesis//Treherne J E, Berridge M J, Wigglesworth V B., 1979, 14: 49-108.
[3] 王加伟, 彭露, 邹明民, 杨一帆, 汪蕾, 尤民生. 昆虫卵黄原蛋白受体(s)及其主要功能综述. 环境昆虫学报, 2016, 38(4): 831-842.
WANG J W, PENG L, ZOU M M, YANG Y F, WANG L, YOU M S. A review of insect vitellogenin receptors (s) and their fundamental functions., 2016, 38(4): 831-842. (in Chinese)
[4] TUFAIL M, TAKEDA M. Insect vitellogenin/lipophorin receptors: molecularstructures, role in oogenesis, and regulatory mechanisms., 2009, 55(2):87-103.
[5] 戴瀚洋, 孙洋, 柏立新, 赵静, 肖留斌, 谭永安. 亚致死浓度甲维盐胁迫对甜菜夜蛾幼虫解毒酶系活力及其相关基因表达量的影响. 棉花学报, 2015, 27(2): 149-158.
DAI H Y, SUN Y, BAI L X, ZHAO J, XIAO L B, TAN Y A. Activities of detoxification enzymes and expressions of related genes inlarvae treated with sublethal concentrations of emamectin benzoate., 2015, 27(2): 149-158. (in Chinese)
[6] 司升云, 周利琳, 王少丽, 江幸福, 许再福, 慕卫, 王冬升, 王小平, 陈浩涛, 杨亦桦, 吉训聪. 甜菜夜蛾防控技术研究与示范——公益性行业(农业)科研专项“甜菜夜蛾防控技术研究与示范” 研究进展. 应用昆虫学报, 2012, 49(6): 1432-1438.
SI S Y, ZHOU L L, WANG S L, JIANG X F, XU Z F, MU W, WANG D S, WANG X P, CHEN H T, YANG Y H, JI X C. Progress
in research on prevention and control of beet armyworm,in China., 2012, 49(6): 1432-1438. (in Chinese)
[7] 文礼章, 张友军. 我国甜菜夜蛾大尺度暴发频度与广域温度和广域降雨量关系的预测模型. 昆虫学报, 2010, 53(12): 1367-1381.
WEN L Z, ZHANG Y J. Modelling of the relationship between the frequency of large-scale outbreak of the beet armyworm,(Lepidoptera: Noctuidae) and the wide-area temperature and rainfall trends in China., 2010, 53(12): 1367-1381. (in Chinese)
[8] LIN Y, MENG Y, WANG Y X, LUO J, KATSUMA S, YANG C W, BANNO Y, KUSAKABE T, SHIMADA T, XIA Q Y. Vitellogenin receptor mutation leads to the oogenesis mutant phenotype “” of the silkworm,., 2013, 288(19): 13345-13355.
[9] SHU Y H, WANG J W, LU K, ZHOU J L, ZHOU Q, ZHANG G R. The firstvitellogenin receptor from a Lepidopteran insect: molecular characterization,expression patterns and RNA interference analysis., 2011, 20(1): 61-73.
[10] CHO K H, Raikhel A S. Organization and developmental expression of the mosquito vitellogenin receptor gene., 2001, 10(5): 465-474.
[11] CHEN M E, LEWIS D K, KEELEY L L, PIETRANTONIO P V. cDNA cloning and transcriptional regulation of the vitellogenin receptor from the imported fire ant,buren (hymenoptera: formicidae)., 2004, 13(2): 195-204.
[12] GUIDUGLI-LAZZARINI K R, DO NASCIMENTO A M, TANAKA E D, PIULACHS M D, HARTFELDER K, BITONDI M G, SIMOES Z L. Expression analysis of putative vitellogenin and lipophorin receptors in honey bee (L.) queens and workers., 2008, 54(7): 1138-1147.
[13] LIU Q N, ZHU B J, LIU C L, WEI G Q, WANG Z G. Characterization of vitellogenin receptor () from the Chinese oak silkworm,, 2011, 64(2): 167-174.
[14] LIN W J, CHIEN C Y, TSAI C L, CHEN M E. A nonovary-specific vitellogenin receptor from the oriental fruit fly,(hendel).2015, 90(4): 169-180.
[15] TUFAIL M, TAKEDA M. Molecular cloning, characterization and regulation ofthe cockroach vitellogenin receptor during oogenesis., 2005,14(4): 389-401.
[16] ZHANG W N, MA L, XIAO H J, XIE B T, SMAGGHE G, GUO Y Y, Liang G M. Molecular characterization and function analysis of the vitellogenin receptor from the cotton bollworm,(Hübner) (Lepidoptera, Noctuidae)., 2016, 11(5): e0155785.
[17] ZHAO J, SUN Y, XIAO L B, TAN Y A, JIANG Y P, BAI L X. Vitellogenin and vitellogenin receptor gene expression profiles inare related to host plant suitability., 2018, 74(4): 950-958.
[18] ROY-ZOKAN E M, CUNNINGHAM C B, HEBB L E, MCKINNEY E C, MOORE A J. Vitellogenin and vitellogenin receptor gene expression is associated with male and female parenting in a subsocial insect., 2015, 282(1809): 20150787.
[19] TUFAIL M, TAKEDA M. Molecular cloning and developmental expressionpattern of the vitellogenin receptor from the cockroach,., 2007, 37(3): 235-245.
[20] 杨中侠, 文礼章, 吴青君, 王少丽, 徐宝云, 张友军. RNAi技术在昆虫功能基因研究中的应用进展. 昆虫学报, 2008, 51(10): 1077-1082.
YANG Z X, WEN L Z, WU Q J, WANG S L, XU B Y, ZHANG Y J. Application of RNA interference in studying gene functions in insects., 2008, 51(10): 1077-1082. (in Chinese)
[21] 周耀振, 修伟明, 董双林. 应用RNA干扰技术对甜菜夜蛾信息素结合蛋白功能的研究. 南京农业大学学报, 2009, 32(3): 58-62.
ZHOU Y Z, XIU W M, DONG S L. Functional study of pheromone binding protein by using RNAi in male beet armyworm,Hiibner., 2009, 32(3): 58-62. (in Chinese)
[22] TURNER C T, DAVY M W, MACDIARMID R M, PLUMMER K M, BIRCH N P, NEWCOMB R D. RNA interference in the light brown apple moth,(Walker) induced by double-stranded RNA feeding., 2006, 15(3): 383-391.
[23] CIUDAD L, PIULACHS M D, BELLES X. Systemic RNAi of the cockroach vitellogenin receptor results in a phenotype similar to that of theyolkless mutant., 2006, 273(2): 325-335.
[24] ARAUJO R N, SANTOS A, PINTO F S, GONTIJO N F, LEHANE M J, PEREIRA M H. RNA interference of the salivary gland nitrophorin 2 in the triatomine bug(Hemiptera: Reduviidae) by dsRNA ingestion or injection., 2006, 36(9): 683-693.
[25] BAUM J A, BOGAERT T, CLINTON W, HECK G R, FELDMANN P, ILAGAN O, JOHNSON S, PLAETINCK G, MUNYIKWA T, PLEAU M, VAUGHN T, ROBERTS J. Control of coleopteran insect pests through RNA interference., 2007, 25(11): 1322-1326.
[26] LU K, SHU Y H, ZHOU J L, ZHANG X Y, ZHANG X Y, CHEN M X, YAO Q, ZHOU Q, ZHANG W Q. Molecular characterization and RNA interference analysis of vitellogenin receptor from(stål)., 2015, 73: 20-29.
[27] PITINO M, COLEMAN A D, MAFFEI M E, RIDOUT C J, HOGENHOUT S A. Silencing of aphid genes by dsRNA feeding from plants., 2011, 6(10): e25709.
[28] KENNERDELL J R, CARTHEW R W. Heritable gene silencing inusing double-stranded RNA., 2000, 18(8): 896-898.
[29] LEVIN D M, BREUER L N, ZHUANG S, ANDERSON S A, NARDI J B, KANOST M R. A hemocyte-specific integrin required for hemocytic encapsulation in the tobacco hornworm,., 2005, 35(5): 369-380.
[30] SIVAKUMAR S, RAJAGOPAL R, VENKATESH G R, SRIVASTAVA A, BHATNAGAR R K. Knockdown of aminopeptidase-N fromlarvae and in transfected Sf21 cells by RNA interference reveals its functional interaction withinsecticidal protein Cry1Ac., 2007, 282(10): 7312-7319.
[31] SHANG F, NIU J Z, DING B Y, ZHANG Q, YE C, ZHANG W, SMAGGHE G, WANG J J. Vitellogenin and its receptor play essential roles in the development and reproduction of the brown citrus aphid,(Toxoptera)., 2018, 27(2): 221-233.
RNA interference of Vitellogenin Receptorgene in beet armyworm()
ZHAO Jing1,2, Tao Rong1, HAO DeJun1, XIAO LiuBin2, TAN YongAn2
(1Co-Innovation Center for the Sustainable Forestry in Southern China/College of Forestry, Nanjing Forestry University, Nanjing 210037;2Institute of Plant Protection, Jiangsu Academy of Agricultural Sciences, Nanjing 210014)
【Objective】Vitellogenin receptor (VgR) is the main receptor that mediates the endocytosis of insect vitellin. The objective of this study is to clarify the function ofof beet armyworm () through RNA interference (RNAi) method, and to provide a basis for further understanding the molecular mechanism of reproductive physiology and developing effective new methods for prevention and control.【Method】The fragment ofwas amplified from the cDNA offemale adults abdomen tissues ofby PCR which included the ligand-binding domain region. The green fluorescent protein gene () fragment was amplified from theplasmid stored in the laboratory by specific primers. The fragment ofandwas then inserted into the pMD-19T for sequencing. The nucleic acid sequence was analyzed by DNAMAN software. The correct plasmid confirmed by sequencing acted as the DNA template. PCR amplification was performed using primers with T7 promoter.anddsRNA were synthesized with T7 RiboMAXTMExpress RNAi System synthesis kit. The abdomens offemale pupae on 2nd and 6th day were injected with 3 μL double RNA by 10 μL microsyringe (2 μg·μl-1). RT-qPCR was used to detect the changes ofexpression in 0-, 24-, 48-hour-old female adults. Meanwhile, eclosion rate and eggs per female were evaluated in control groups (blank control,-dsRNA injection) and treatment group (-dsRNA injection). 【Result】Theandgene fragments obtained by amplification were 327 and 417 bp, respectively. Theexpression level of 0-, 24-, 48-hour-old female adults in the-dsRNA group decreased by 79.35%, 84.22% and 67.68% compared with the-dsRNA group, respectively. Through anatomical observation of the ovary of 0-, 24-, 48-hour-old female adults, it was found that compared with the-dsRNA group, the ovary development of the-dsRNA group was significantly delayed. Compared with the-dsRNA group, the length of the ovary tube in the-dsRNA group decreased by 23.92% for the 24-hour-old female adults. The-dsRNA group has more mature eggs in the ovary with larger average diameter of (0.46±0.05) mm while the number of mature eggs in the-dsRNA group was small with an average diameter of (0.23±0.02) mm. There was no significant difference of eclosion rate between-dsRNA group and-dsRNA group. In the-dsRNA group, the average number of eggs per female was 170, while in the control groups (blank group,-dsRNA group), the average number of eggs per female was 451 and 420, respectively. There was a significant difference in the amount of ovipositionbetween control groups and treatment group. 【Conclusion】 The function ofwas studied by dsRNA injection, which could significantly reduce the expression of.plays an irreplaceable role in the reproduction of, which directly affects the ovary development and spawning capacity, and can be used as a potential target for controlling.
beet armyworm (); vitellogenin receptor gene (); RNA interference; ovary development
10.3864/j.issn.0578-1752.2019.01.006
2018-08-13;
2018-10-02
国家重点研发计划(6111661)、国家现代农业产业技术体系(CARS-18-16)、江苏省农业科学院院基金计划(6111612、6111613)
赵静,E-mail:jingzhao0126@126.com。通信作者郝德君,E-mail:dejunhao@163.com。通信作者肖留斌,E-mail:xlbwll@sohu.com
(责任编辑 岳梅)
