近零磁场下干扰磁响应关键基因对褐飞虱寿命的影响
2019-01-09贺静澜张明刘瑞莹万贵钧潘卫东陈法军
贺静澜,张明,刘瑞莹,万贵钧,潘卫东,陈法军
近零磁场下干扰磁响应关键基因对褐飞虱寿命的影响
贺静澜1,张明1,刘瑞莹1,万贵钧1,潘卫东2,陈法军1
(1南京农业大学植物保护学院,南京 210095;2中国科学院电工研究所生物电磁学北京市重点实验室,北京 100190)
【目的】隐花色素(cryptochrome, Cry)和铁硫簇蛋白IscA(iron-sulfur cluster assembly,即MagR)是生物体内潜在的磁受体蛋白,本研究通过RNA干扰(RNAi)技术,分别敲减褐飞虱()体内的磁响应关键基因、和,旨在探明近零磁场(near-zero magnetic field,NZMF)环境下,以上3种基因在褐飞虱寿命调节过程中的作用,从而间接探讨这3种基因对磁场的响应情况。【方法】采用RNAi技术,以实验室正常磁场环境下稳定饲养的短翅初羽化褐飞虱雌雄成虫为材料,通过向其体内注射双链RNA(dsRNA)分别抑制磁响应关键基因、和,随后立即分别放入正常磁场(geomagnetic field,GMF)和近零磁场中,于每日相同时间观察记录试虫寿命。同时于注射后的1、2和3 d通过RNAiso Plus法提取GMF中褐飞虱雌成虫总RNA,反转录合成第一链DNA,后采用实时荧光定量PCR(RT-qPCR)技术检测该基因的表达情况,以确定基因干扰效率。【结果】注射ds后,褐飞虱雌雄成虫寿命在近零磁场和正常磁场间均无显著差异。注射ds后,近零磁场中褐飞虱雌雄成虫寿命比正常磁场分别显著延长27.78%和50.04%;此外,与注射ds处理相比,正常磁场下注射ds的雌成虫寿命缩短,而近零磁场下注射ds的雌成虫寿命延长,但二者差异均不显著;近零磁场和正常磁场下注射ds的雄成虫寿命均缩短(25.41%和10.73%),且正常磁场下差异显著。近零磁场中,注射ds的雌成虫寿命较注射ds的寿命显著缩短了16.48%,而雄成虫寿命在磁场间、干扰处理间的差异均不显著。【结论】磁场变化下褐飞虱雌雄成虫体内3种磁响应关键基因对其寿命的调节功能存在差异。其中,对磁场变化存在敏感响应,表现为敲减该基因与磁场变化的互作显著地影响雌雄成虫寿命,且表现出“性二型性”;也可对磁场变化产生明显响应,但该响应只存在于雌成虫;此外,对磁场变化无响应,该基因或与褐飞虱雌雄成虫寿命调节无关。
磁场强度变化;褐飞虱;磁响应基因;RNA干扰;成虫寿命;磁生物学效应
0 引言
【研究意义】磁场能以机械力的方式作用于一定范围内的磁体或运动电荷[1]。根据磁场的强度(用磁感应强度B表示,单位为特斯拉,T),可人为地将磁场划分为弱磁场(<1 mT)、中等强度磁场(1 mT—1 T)、强磁场(1—5 T)和超强磁场(>5 T)[2]。地球磁场(geomagnetic field,GMF)的平均场强为50 μT左右,属于弱磁场范围,而强度比地磁场更小的弱磁环境又可进一步被定义为亚磁场(亚磁空间),也可称近零磁场(near-zero magnetic field,NZMF)[3]。生物磁响应(magnetic response)指生物感知磁场强度及方向的信息,并直接或间接地通过行为、生理、代谢等作出从宏观表型到微观分子水平响应的现象[4]。目前对于弱磁场,尤其是地磁场,人们更侧重于研究其对生物行为的影响,如以家鸽为代表的迁徙性动物极有可能利用自地磁信息进行定向和导航[5];至于强磁场和超强磁场,人们则更关注这类磁场对人体造成的潜在威胁,如核磁共振成像时的短时强磁空间等[6];因此磁场生物学效应的研究一度集中于中等强度磁场[7];而随着近千年来地球磁场的不断衰弱,针对强度低于地磁场强度——即近零磁场的生物磁响应研究也逐渐增多。实验证实,如果长期处于该磁场环境下,动物的中枢神经系统将产生障碍[8-12],早期发育过程受到明显影响[13-14],而短期暴露近零磁场环境也会影响人体的健康[15-17]。可见进行有关近零磁场下生物的磁生理响应研究,进而推测地球磁场的变化对生物的不利效应具有重要意义。【前人研究进展】大量研究有力地证实了生物可对磁场变化作出响应,而相较于此,对于生物磁响应机制的探索却一直未有定论。事实上,生物对地磁场感知的关键在于“磁受体”(magnetoreceptor)的确定,对此学者们提出了多种假说,而其中有两种得到了广泛认可,即磁颗粒介导的磁受体假说与依赖光的自由基对假说。前者认为,生物可借助体内的磁铁矿(Fe3O4)颗粒感受磁场[18],后者则认为生物体内的隐花色素(cryptochrome,Cry)可受光激发产生自由基对反应,是理想的磁受体[19]。这两种假说均具有坚实的理论与实验基础,且目前科学家们更倾向于认同生物磁响应过程是这两种机制共同作用的结果[20]。此外,近期我国科学家发现了另一种潜在的磁受体[21],即铁硫簇蛋白IscA(iron-sulfur cluster assembly),IscA也被认为是一种潜在的磁受体蛋白(magnetoreceptor protein,MagR)。该蛋白可与隐花色素结合形成复合物,体外实验证明该复合物不仅可感受磁场,且自身具有磁特性。同时,另一项侧重于体内生物学实验的研究也支持铁硫簇蛋白中的一种:IscA1具有磁感受功能,但后者的研究结果表明该蛋白可不依赖隐花色素单独调控神经活动[22]。【本研究切入点】目前,对于昆虫的磁生理响应多集中于中等磁场和强磁场,而对于弱磁场特别是地磁场和近零磁场环境下昆虫的生理变化研究较少[23]。褐飞虱()是一种典型的夜间迁飞型害虫,而夜间迁飞的昆虫最可能利用地磁场作为其黑暗中的定向信号[24],暗示其具有磁响应的能力。利用超导量子磁强计结合普鲁士蓝染色观察发现,褐飞虱腹部含有铁磁性物质,可能为Fe3O4,且这种铁磁颗粒的含量与其翅型、性别和发育历期等有关[25]。研究表明,相较于地球磁场,近零磁场可影响褐飞虱与白背飞虱()的趋光性、飞行能力、卵及若虫历期、成虫寿命以及翅型比率等,且实时荧光定量PCR(RT-qPCR)结果显示,稻飞虱体内与表达量在两个磁场间存在显著差异[26-27],但进一步的分子验证仍是空白。【拟解决的关键问题】基于生物磁响应现象与磁感受机制的研究现状,以及前人针对稻飞虱对磁场的生理响应表型实验,选择褐飞虱雌雄成虫体内的磁响应关键基因,即、以及潜在磁受体蛋白基因(即)作为研究对象,通过RNA干扰(RNAi)技术分别敲减以上3种基因,并分别暴露于南京本地磁场(GMF:49 μT)和近零磁场(NZMF:1.8 μT)中,通过比较RNAi的褐飞虱雌雄成虫寿命的变化规律,探讨3种磁响应关键基因对磁场变化的响应及其对寿命的调控情况,为进一步明确磁受体及磁响应生物学通路打下基础。
1 材料与方法
试验于2017年在南京农业大学完成。
1.1 磁场发生装置的建立
采用自主研发的直流电亥姆霍兹线圈创造稳定的静态磁场环境(专利号:ZL201320004497.5),以中心点为球心的直径30 cm的球形范围为该线圈可控制的有效磁场范围,本研究中所使用的几组线圈可控最小值范围为500—1 800 nT,因此取1.8 μT为本试验中近零磁场磁场强度。共设置两个稳定静态磁场,即模拟南京本地磁场强度的地磁场(GMF:49 μT),以及抵消绝大部分地磁场以达到近零水平的近零磁场(NZMF:1.8 μT)。在磁场搭建调试、试验的开始、过程及结束阶段,使用磁通门计监测各磁场处理的强度,以保证控制环境试验中磁场强度设置的稳定性。
1.2 供试昆虫与试验条件
供试褐飞虱采集自位于南京市的江苏省农业科学院试验稻田,饲养于室内种植的感虫水稻品种TN1上,温室环境为温度(26±1)℃,相对湿度80%,光周期14 L﹕10 D,磁场环境为南京本地地磁场。供试种群已于该环境内连续培养10代以上,且用于寿命分析的试虫均为发育整齐的短翅型雌雄成虫。
1.3 主要试剂
总RNA提取试剂RNAiso Plus(TaKaRa)、反转录试剂盒PrimeScriptTMRT reagent Kit with gDNA Eraser(TaKaRa)、凝胶回收试剂盒AxyPrepTMDNA Gel Extraction kit(Axygen)、PCR试剂2×Fast Taq Master Mix(Gentbios)、零背景pTOPO-TA Simple克隆试剂盒(Aidlab)、感受态细胞Trans1-T1(TransGen Biotech)、质粒抽提与纯化试剂盒DNA Clean & ConcentratorTM-5(ZYMO RESEARCH)、体外转录试剂盒T7 RiboMAXTMExpress RNAi System(Promega)、RT-qPCR试剂SYBR®TM(TaKaRa)。
引物合成及测序均由南京金斯瑞科技有限公司完成。
1.4 dsRNA的制备
根据前期研究[28-29],获得褐飞虱(GenBank登录号:KM108578)、(GenBank登录号:KM108579)、()(GenBank登录号:KY026177)基因序列,经NCBI网站进行序列比对鉴定。应用Primer Premier 5.0软件设计3种基因的上下游克隆引物,同时设计绿色荧光蛋白基因的克隆引物(表1,下划线为T7启动子)。其中阴性对照的模板来自实验室保存的菌种。
取1.2中饲养的褐飞虱雌雄成虫各3只,同性别试虫冰浴中混合研磨匀浆后采用RNAiso Plus提取褐飞虱总RNA,其质量通过琼脂糖凝胶电泳进行检测,浓度通过Nanodrop2000(Thermo,USA)进行测定,随后按照反转录试剂盒PrimeScriptTMRT reagent Kit的操作要求,获得可作为模板的cDNA序列。PCR反应体系为2×FastTaq PCR Master Mix 25 μL,10 μmol·L-1的上下游引物各1.5 μL,cDNA模板4 μL,ddH2O 18 μL,总反应体系为50 μL。PCR反应条件为95℃预变性3 min,95℃变性20 s,60℃复性20 s,72℃延伸30 s,30个循环,最后72℃延伸5 min。反应产物经琼脂糖凝胶电泳检测无误后,通过凝胶回收试剂盒AxyPrepTMDNA Gel Extraction kit回收特定片段。
通过零背景pTOPO-TA Simple克隆试剂盒,将含有T7启动子的目的片段插入pTOPO-T质粒载体,转入大肠杆菌感受态细胞Trans1-T1,均匀涂布在含有1%青霉素的LB固体培养基上37℃倒置培养9 h,挑取单个菌落于1%青霉素的LB液体培养基中37℃摇菌5 h,取1 μL菌液进行PCR扩增,并送南京金斯瑞科技有限公司测序,测序结果通过MEGA软件进行比对。最终,按照DNA Clean & ConcentratorTM-5试剂盒的说明书对合格的菌液进行质粒抽提,随后按照体外转录试剂盒T7 RiboMAXTMExpress RNAi System的操作说明合成dsRNA,退火及纯化后最终获得4种dsRNA,即ds、ds、ds及ds,调整浓度至4 000 ng·μL-1储存于-80℃备用。
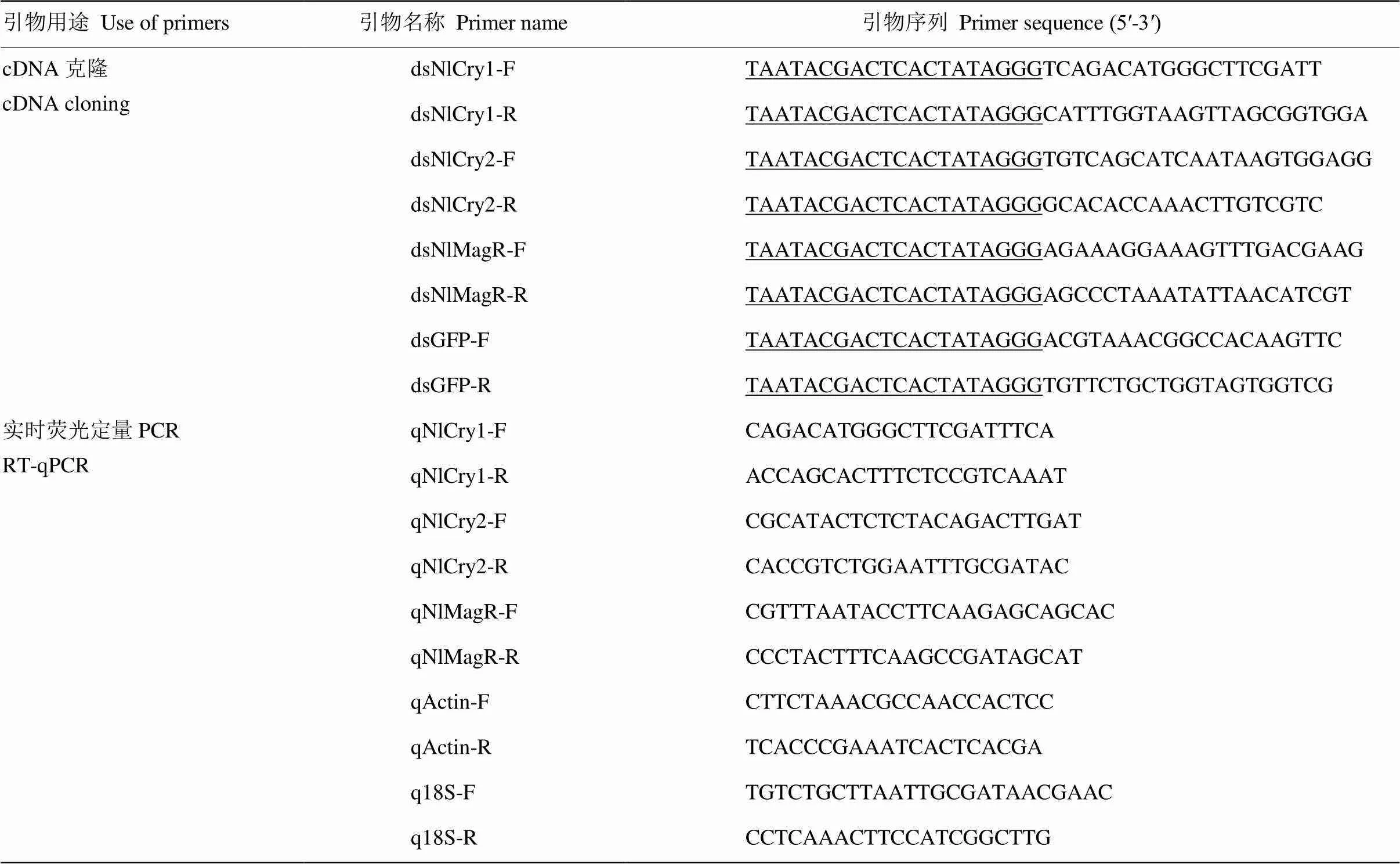
表1 本试验所用引物及序列
1.5 RNAi
随机选取于1.2中饲养至初羽化1 d的短翅型雌雄成虫进行显微注射,以其胸部中足和后足间的外侧表皮处作为注射位点,并根据雌雄虫体形差异,确定雌虫注射量为75 nL,雄虫注射量为50 nL。共设3个处理组,即注射 ds、ds和 ds;以注射ds的试虫为阴性对照组。组内再分雌雄性别和不同磁场处理。因磁场空间有限,该试验分3批进行。注射后的试虫以单头单管的形式饲养于试管内种植的15日龄TN1水稻苗上,并分别置于南京本地磁场的GMF(49 μT)和近零磁场NZMF(1.8 μT)中,温湿度和光周期等环境条件同1.2。每日记录各处理试虫死亡情况。
1.6 干扰效率检查
于RNAi处理后的24、48及72 h,随机取各处理位于GMF中的雌虫各9只,生物学重复设置3次,进行RNA抽提及基因RNAi后表达量情况测定。RT-qPCR采用20 μL体系,即SYBR®TM10 μL,上下游引物(10 μmol·L-1)各0.4 μL,ROX Reference Dey 0.4 μL,cDNA模板2 μL,ddH2O 6.8 μL。RT-qPCR反应采用两步法程序,即95℃预变性30 s,95℃变性5 s,60℃退火34 s,循环40次。扩增片段(引物列于表 1)经过测序和原序列比对,以和基因为双内参,以Comparative ΔΔCT法检测褐飞虱、及的相对表达量。
1.7 数据统计与分析
试验数据通过Excel 2010软件进行汇总整理,并采用SPSS16.0软件进行数据分析。其中,dsRNA的干扰效率通过独立样本T检验进行分析,敲减关键磁响应基因(、、)、磁场变化(NZMF vs GMF)及其交互作用对褐飞虱雌雄成虫寿命的影响分别通过双因子方差分析(Two-way ANOVA)进行比较,并采用群体T检验进行处理间差异显著性比较(<0.05为显著,<0.01为极显著)。
2 结果
2.1 dsRNA干扰效率
RT-qPCR结果显示,与注射ds的阴性对照相比,注射ds、ds和ds的雌成虫体内各对应基因1—3 d的相对表达量均显著或极显著降低(<0.05或0.01)。与注射ds的阴性对照相比,注射ds2 d后试虫体内表达量显著降低了71%(<0.05),注射3 d后该基因表达量仍维持在较低水平,但差异不显著(图1-A);注射ds1—2 d后试虫体内表达量分别极显著降低了49%和54%(<0.01,图1-B);注射ds2—3 d后试虫体内表达量分别显著降低了60%和53%(<0.05,图1-C)。可见,显微注射ds对3个磁响应关键的靶标基因具有相应的干扰效果。
2.2 敲减NlCry1后褐飞虱雌雄成虫在正常磁场和近零磁场环境下的寿命
RNAi、磁场变化及两者之间的交互作用均未显著影响褐飞虱雌雄成虫的寿命(≤2.87,≥0.092,表2)。与注射ds的对照相比,GMF下注射ds的雌雄成虫寿命分别缩短了8.36%(图2-A)和20.26%(图2-B),NZMF下注射ds的雌雄成虫寿命分别延长了11.97%(图2-A)和7.23%(图2-B);与GMF相比,NZMF下注射ds的雌成虫寿命缩短了6.70%(图2-A),而雄成虫寿命延长了5.00%(图2-B)。但以上RNAi处理以及磁场处理间差异均不显著(>0.05,图2)。
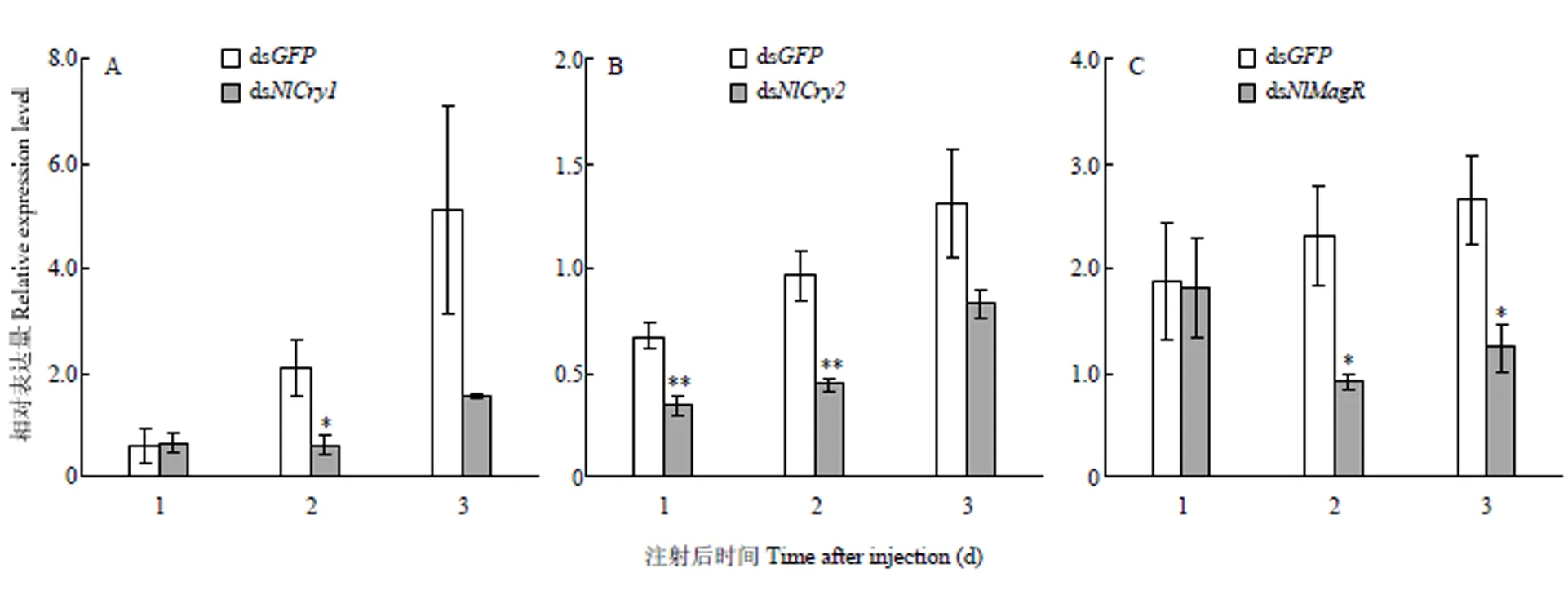
试虫均为初羽化短翅型雌成虫,置于B=49 μT的GMF中;*和**分别表示经T检验处理间差异达P<0.05和P<0.01的显著水平
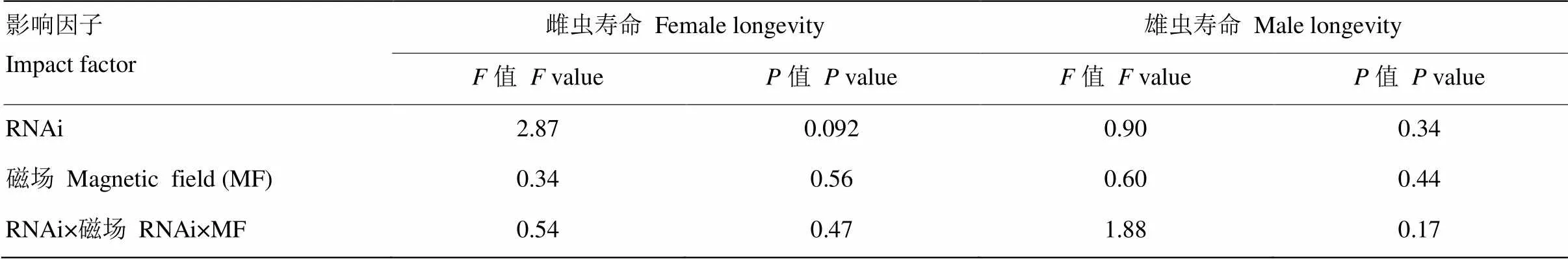
表2 RNAi(dsNlCry1 vs. dsGFP)和磁场处理(GMF vs. NZMF)对褐飞虱雌雄成虫寿命影响的双因素方差分析
2.3 敲减NlCry2后褐飞虱雌雄成虫在正常磁场和近零磁场环境下的寿命
磁场变化显著影响了褐飞虱雄成虫寿命(=4.14,=0.044<0.05),且RNAi和磁场变化之间的交互作用还显著影响了雌成虫寿命(=4.45,=0.037<0.05),并极显著地影响了雄成虫寿命(=7.08,=0.009<0.01,表3)。与注射ds的对照相比,GMF下注射ds的雌成虫寿命缩短了2.59%,而NZMF下注射ds的雌成虫寿命延长了13.07%,但差异均不显著(>0.05,图3-A);GMF下注射ds的雄成虫寿命显著缩短了25.41%(<0.05),而在NZMF下注射ds的雄成虫寿命缩短了10.73%,但差异不显著(>0.05,图3-B)。与GMF相比,NZMF下注射ds的褐飞虱雌雄成虫寿命分别显著延长了27.28%和50.04%(<0.05,图3)。
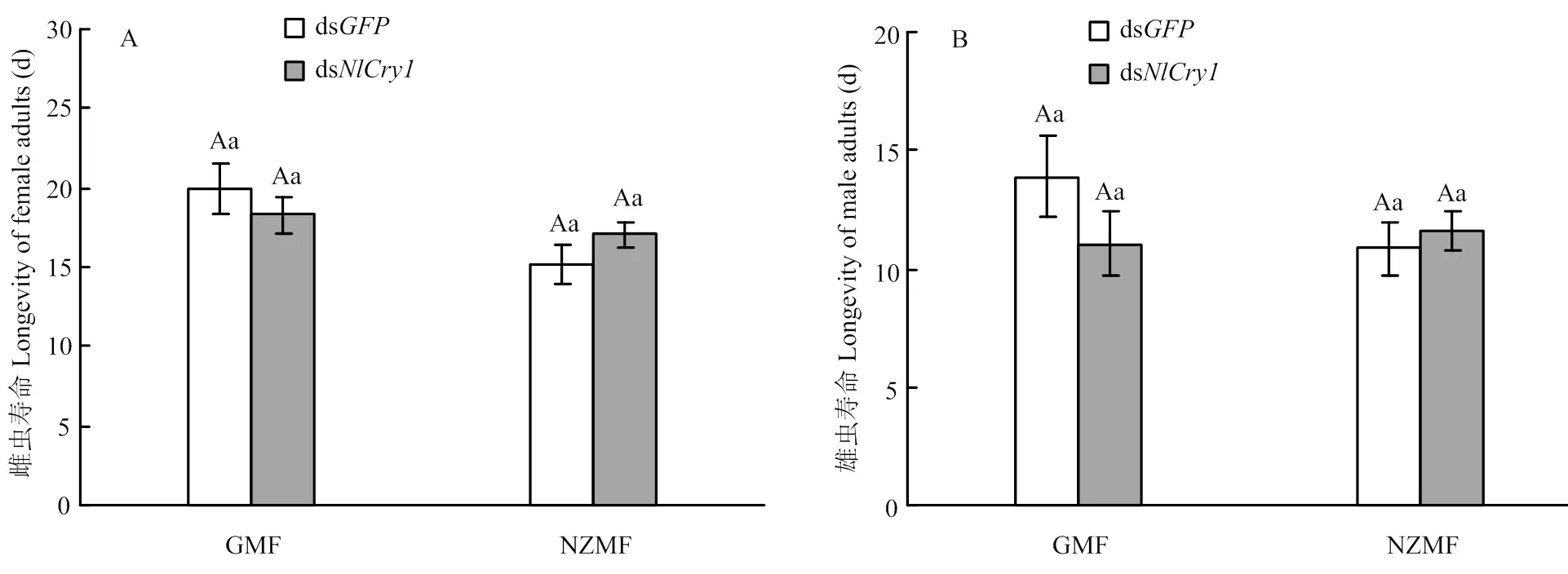
相同小写字母和相同大写字母分别表示同一磁场同一性别褐飞虱成虫寿命在dsNlCry1与dsGFP处理之间,以及同一性别同一RNAi干扰处理下GMF和NZMF处理之间经T检验差异不显著(P>0.05)
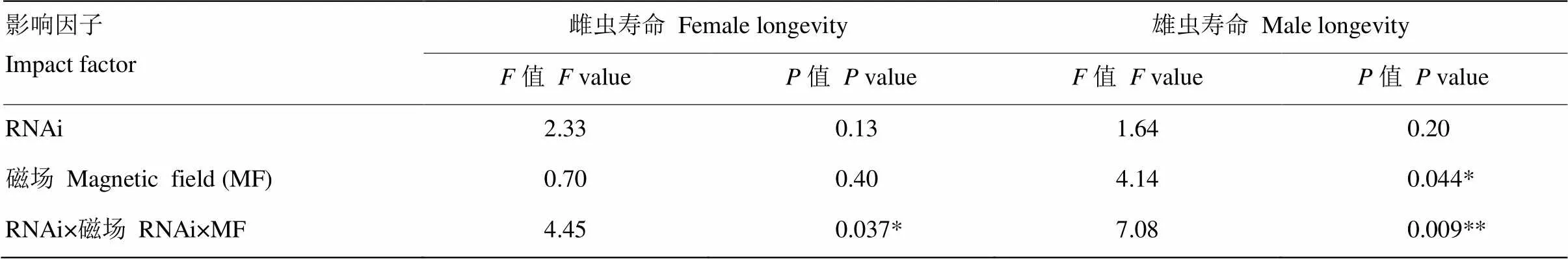
表3 RNAi(dsNlCry2 vs. dsGFP)和磁场处理(GMF vs. NZMF)对褐飞虱雌雄成虫寿命影响的双因素方差分析
*<0.05,**<0.01。表4同The same as Table 4
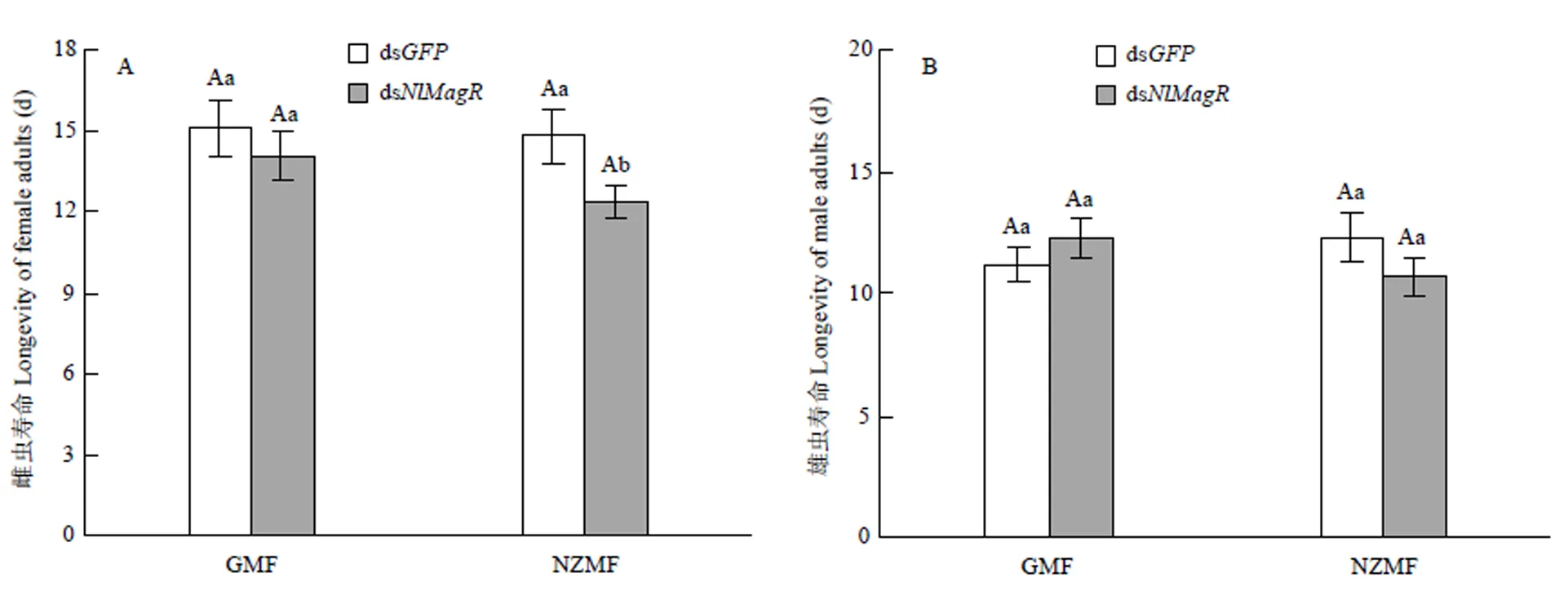
2.4 敲减NlMagR后褐飞虱雌雄成虫在正常磁场和近零磁场环境下的寿命
RNAi及其与磁场变化之间的交互作用均未显著影响褐飞虱雌雄成虫寿命(≤2.59,≥0.11),敲减仅在NZMF下显著影响了雌成虫寿命(=3.97,=0.048<0.05,表4)。与注射ds的对照相比,GMF下注射ds的雌成虫寿命缩短6.69%,NZMF下则显著缩短16.48%(<0.05,图4-A);GMF下注射ds的雄成虫寿命延长9.32%,而NZMF下则缩短12.98%,但二者差异并不显著(>0.05,图4-B);与GMF相比,NZMF下注射ds的褐飞虱雌雄虫寿命分别缩短了12.16%和12.68%,但差异并未达到显著水平(>0.05,图4)。

不同小写字母和不同大写字母分别表示同一磁场同一性别褐飞虱成虫寿命在dsNlCry2与dsGFP处理之间,以及同一性别同一RNAi干扰处理下GMF和NZMF处理之间经T检验差异显著(P<0.05)
不同小写字母和不同大写字母分别表示同一磁场同一性别褐飞虱成虫寿命在dsNlMagR与dsGFP处理之间,以及同一性别同一RNAi干扰处理下GMF和NZMF处理之间经T检验差异显著(P<0.05)
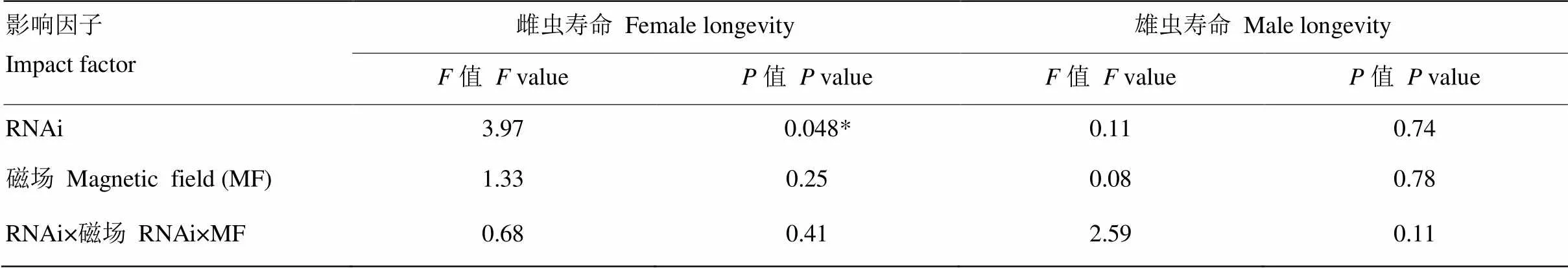
表4 RNAi(dsNlMagR vs. dsGFP)和磁场处理(GMF vs. NZMF)对褐飞虱雌雄虫寿命影响的双因素方差分析
3 讨论
近年来,大量研究表明隐花色素(Cry)可作为潜在磁受体参与生物的磁场响应过程。昆虫中的果蝇只含有一种隐花色素,可作为研究该蛋白响应磁场变化的模式生物。有关行为学实验表明,全光照下野生型果蝇可对磁场作出显著反应,而隐花色素缺陷的果蝇突变体则对磁场无响应,有趣的是,当屏蔽蓝紫光(即隐花色素可接收的光谱)后,即使是野生型果蝇也不再响应磁场的变化,证实了隐花色素的存在是果蝇进行磁响应活动的必要条件,也为基于隐花色素的磁敏系统提供了首个遗传学证据[30]。随后,在有关昼夜节律的研究中发现,蓝光光谱下磁场可增强隐花色素对果蝇生物钟节律的“减缓”现象,而隐花色素突变体果蝇中则未观察到这一现象[31]。此外,另有研究发现,果蝇的负趋地性会受到磁场的干扰,而这种“干扰”又受隐花色素的调节,具体而言,破坏隐花色素的羧基端后,磁场对果蝇负趋地性的影响消失,证明隐花色素在这一信号通路中发挥着重要的作用[32]。近期一项针对磁场对稻飞虱生物学效应的研究表明,与GMF相比,NZMF使白背飞虱若虫历期延长,并显著缩短了长翅未交配白背飞虱成虫寿命;且RT-qPCR结果显示,NZMF下5龄若虫体内的和均上调表达[33]。本研究中,注射ds后,相比GMF,NZMF中褐飞虱雌雄成虫寿命均显著延长,而作为阴性对照的ds处理组雌雄虫寿命在磁场间均无显著差异,且双因素方差分析显示,磁场与干扰互作对褐飞虱成虫寿命有极显著影响,表明该基因可对磁场变化产生敏感响应。此外,磁场与敲减的交互作用对不同性别的褐飞虱成虫寿命的影响不同,具体表现为注射ds后,NZMF下褐飞虱雌雄成虫寿命均呈现延长趋势;注射ds后,NZMF下褐飞虱雌雄成虫寿命均出现缩短的趋势;而注射ds后,NZMF下雌成虫寿命延长,雄成虫寿命缩短,即表现“性二型性”。综上所述,参与了褐飞虱成虫的寿命调控,且该过程受到磁场影响,符合隐花色素可响应磁场变化的假说。
本研究中,干扰后褐飞虱的成虫寿命在不同磁场处理间存在显著差异,而干扰后褐飞虱的成虫寿命在磁场处理间无显著差异,可见不同磁场环境下两种隐花色素调控褐飞虱成虫寿命的功能不同。隐花色素主要在动物的生物钟调控方面发挥重要作用,可分为两类,即光敏的Ⅰ型隐花色素和非光敏的Ⅱ型隐花色素;其中,Ⅰ型为蓝光受体,在生物钟系统中起着感光作用,而Ⅱ型为昼夜节律调节过程中的反馈回路抑制子[34]。褐飞虱的两种隐花色素基因与分别属于动物Ⅰ型与动物Ⅱ型隐花色素。有研究表明,与在褐飞虱的发育生理中扮演着不同的角色,前者在褐飞虱的迁徙行为中发挥作用,而后者对昼夜节律的适应显示出更明显的动态变化[29]。可见更有可能作为动物生物钟的核心组件。而生物钟又可与神经内分泌系统协同作用[35-37],二者可能间接调控昆虫体内激素稳态,如蜕皮激素、保幼激素的分泌等[38-40]。因此,可能作为关联磁场效应与激素信号传导的“桥梁”,进而在褐飞虱的生物钟系统中发挥潜在作用。另一方面,或与稻飞虱的趋光行为有关。Wan等研究表明,NZMF显著提高了初羽化2日龄的白背飞虱内的正趋光性;且RT-qPCR结果显示,该时段内其体内上调表达,进而推测NZMF提高白背飞虱正趋光性或与羧基端多效性有关[27]。因此,作为Ⅰ型隐花色素,可能更多发挥感光受体作用,或参与调节磁场影响下的起飞或趋光等行为,而不参与磁场对褐飞虱寿命的调控。
铁硫簇蛋白IscA属于铁硫蛋白亚家族hesB,是一类高度保守的蛋白。近期,Qin等研究发现该蛋白在离体条件下具有磁性,推测可能是一种全新的磁受体蛋白[21-22]。Qin等[21]以离体实验为主,认为铁硫簇蛋白与隐花色素结合,前者感磁,后者感光,协同发挥“生物指南针”功能;而Long等[22]以线虫为研究对象,认为铁硫簇蛋白不需与隐花色素结合便可发挥磁受体功能。但该理论提出后受到质疑,且缺乏活体验证,至今仍无后续相关报道。本研究中,NZMF下干扰的褐飞虱雌虫寿命显著短于对照处理,而雄虫中虽有相似趋势,却未达显著水平,推测NlMagR或对磁场存在一定的感知,且它的缺失可缩短雌虫寿命,进而影响其生长发育。铁硫簇蛋白是一类重要的线粒体内蛋白,MagR(IscA)对于维持线粒体稳定以及调控呼吸能量代谢具有重要生物学意义。有研究表明,缺失该基因会导致铁元素在酵母菌线粒体内累积,进而使其无法正常生长[41-43]。此外MagR(IscA)也是线粒体铁硫蛋白成熟所必需的组装蛋白,敲除斑马鱼体内的会导致其血红蛋白缺失,从而造成重度贫血[44]。最近有关该基因在人类疾病方面的研究也表明,IscA的异常表达会导致某些疾病的发生,如脑白质病变与神经退行性疾病[45]以及槭糖尿病[46]。本试验中,GMF条件下干扰后,相较于dsGFP处理,褐飞虱雌成虫寿命缩短但不显著,但NZMF条件下干扰该基因后的试虫寿命进一步缩短达并到显著水平,这可能暗示了:(1)NlMagR(即铁硫簇蛋白)的缺失对褐飞虱雌成虫有消极影响,原因可能是上文提到的线粒体或铁硫蛋白受损等;(2)NZMF“放大”了NlMagR缺失带来的消极影响。据此推测NlMagR可以感受磁场的变化,并在褐飞虱雌成虫的寿命这一体征中有所体现,符合“生物磁受体”的理论要求。
4 结论
对于迁飞型害虫褐飞虱而言,其体内对磁场变化存在响应,表现为敲减该基因与磁场变化的互作可对褐飞虱雌雄虫寿命产生显著影响,且具有“性二型性”;()也可对磁场产生一定响应,但该响应只存在于雌虫中,雄虫的影响不明显;而以寿命为指标不能判定对磁场变化是否存在响应,该基因或与褐飞虱寿命调节无关。研究结果可为进一步明确生物磁受体以及磁响应生物学通路提供有力的理论支撑。
[1] 朱晓璐, 王江云. 地磁场与生物的磁感应现象. 自然杂志, 2013, 35(3): 200-206.
Zhu X L, Wang J Y. The effect of geomagnetism on biomagnetism., 2013, 35(3): 200-206. (in chinese)
[2] Dini L, Abbro L. Bioeffects of moderate-intensity static magnetic fields on cell cultures., 2005, 36(3): 195-217.
[3] 莫炜川, 刘缨, 赫荣乔. 亚磁场及其生物响应机制. 生物化学与生物物理进展, 2012, 39(9): 835-842.
Mo W C, Liu Y, He R Q. A biological perspective of the hypomagnetic field: from definition towards mechanism., 2012, 39(9): 835-842. (in chinese)
[4] 贺静澜, 万贵钧, 张明, 潘卫东, 陈法军. 生物地磁响应研究进展. 生物化学与生物物理进展, 2018, 45(7): 689-704.
He J L, Wan G J, Zhang M, Pan W D, Chen F J. Progress in the study of giomagnetic responses of organisms., 2018, 45(7): 689-704. (in chinese)
[5] Lohmann K J, Lohmann C M, Putman N F. Magnetic maps in animals: nature’s GPS., 2007, 210(21): 3697-3705.
[6] Schenck J F. Safety of strong, static magnetic fields., 2000, 12(1): 2-19.
[7] Rosen A D. Mechanism of action of moderate-intensity static magnetic fields on biological systems., 2003, 39(2): 163-173.
[8] 王学斌, 徐慕玲, 李兵, 李东风, 蒋锦昌. 亚磁空间中孵化的一日龄小鸡味觉回避长时记忆受损. 科学通报, 2003, 48(19): 2042-2045.
Wang X B, Xu M L, Li B, Li D F, Jiang J C. Long-term memory was impaired in one-trial passive avoidance task of day-old chicks hatching from hypomagnetic field space., 2003, 48(19): 2042-2045. (in chinese)
[9] Zhang B, Lu H, Wang X, Zhou X J, XU S Y, ZHANG K, JIANG J C, LI Y, GUO A K. Exposure to hypomagnetic field space for multiple generations causes amnesia in., 2004, 371(2/3): 190-195.
[10] Prato F S, Robertson J A, Desjardins D, Hensel J, Thomas A W. Daily repeated magnetic field shielding induces analgesia in CD-1 mice., 2005, 26(2): 109-117.
[11] Mo W C, Fu J P, Ding H M, LIU Y, HUA Q, HE R Q. Hypomagnetic field alters circadian rhythm and increases algesia in adult male mice., 2015, 42(7): 639-646.
[12] Bliss V L, Heppner F H.Circadian activity rhythm influenced by near zero magnetic field., 1976, 261(5559): 411-412.
[13] Fesenko E E, Mezhevikina L M , Osipenko M A, GORDON R Y, KHUTZIAN S S.Effect of the “zero” magnetic field on early embryogenesis in mice., 2010, 29(1/2): 1-8.
[14] Mo W C, Liu Y, Cooper H M, HE R Q. Altered development ofembryos in a hypogeomagnetic field., 2012, 33(3): 238-246.
[15] Binhi V N, Sarimov R M. Zero magnetic field effect observed in human cognitive processes., 2009, 28(3): 310-315.
[16] Binhi V N, Sarimov R M. Effect of the hypomagnetic field on the size of the eye pupil., 2013, arXiv:1302.2741.
[17] Gurfinkel Y I, Vasin A L, Matveeva T A, Sasonko M L. Evaluation of the hypomagnetic environment effects on capillary blood circulation, blood pressure and heart rate., 2016, 42(7): 809-814.
[18] SHAW J, BOYD A, HOUSE M, WOODWARD R, MATHES F, COWIN G, SAUNDERS M, BAER B. Magnetic particle-mediated magnetoreception., 2015, 12(110): 0499.
[19] Ritz T, Adem S, Schulten K. A model for photoreceptor-based magnetoreception in birds., 2000, 78(2): 707-718.
[20] Wiltschko R, Wiltschko W.. Berlin Heidelberg: Springer-Verlag, 1995: 33-41.
[21] Qin S Y, Yin H, Yang C L, Dou Y F, Liu Z M, Zhang P, Yu H, Huang Y L, Feng J, Hao J F, Hao J, Deng L Z, Yan X Y, Dong X L, Zhao Z X, Jiang T J, Wang H W, Luo S J, Xie C.A magnetic protein biocompass., 2016, 15(2): 217-226.
[22] Long X, YE J, ZHAO D, Zhang S J. Magnetogenetics: remote non-invasive magnetic activation of neuronal activity with a magnetoreceptor., 2015, 60(24): 2107-2119.
[23] Zhang X, LI J F, WU Q J, LI B, JIANG J C.Effects of hypomagnetic field on noradrenergic activities in the brainstem of golden hamster., 2007, 28(2): 155-158.
[24] Chapman J W, Drake V A, Reynolds D R. Recent insights from radar studies of insect flight., 2011, 56: 337-356.
[25] Pan W D, Wan G J, Xu J J, Li X M, Liu Y X, Qi L P, Chen F J.Evidence for the presence of biogenic magnetic particles in the nocturnal migratory brown planthopper,., 2016, 6: 18771.
[26] Wan G J, Jiang S L, Zhao Z C, Xu J J, Tao X R, Sword G A, Gao Y B, Pan W D, Chen F J. Bio-effects of near-zero magnetic fields on the growth, development and reproduction of small brown planthopper,and brown planthopper,., 2014, 68: 7-15.
[27] Wan G J, Yuan R, Wang W J, Fu KY, Zhao J Y, Jiang S L, Pan W D, Sword G A, Chen F J. Reduced geomagnetic field may affect positive phototaxis and flight capacity of a migratory rice planthopper., 2016, 121: 107-116.
[28] Xu J J, Zhang Y C, Wu J Q, WANG W H, LI Y, WAN G J, CHEN F J, SWORD G A, PAN W D. Molecular characterization, spatial-temporal expression and magnetic response patterns of the iron-sulfur cluster assembly1 (IscA1) in the rice planthopper,., 2017, DOI 10.1111/1744-7917. 12546.
[29] Xu J J, Wan G J, Hu D B, He J, Chen F J, Wang X H, Hua H X, Pan W D. Molecular characterization, tissue and developmental expression profiles of cryptochrome genes in wing dimorphic brown planthoppers,., 2016, 23(6): 805-818.
[30] Gegear R J, Casselman A, Waddell S, Reppert S M. Cryptochrome mediates light-dependent magnetosensitivity in., 2008, 454(7207): 1014-1018.
[31] Yoshii T, Ahmad M, Helfrich-Förster C. Cryptochrome mediates light-dependent magnetosensitivity of’s circadian clock., 2009, 7(4): e1000086.
[32] Fedele G, Green E W, Rosato E, Kyriacou C P. An electromagnetic field disrupts negative geotaxis invia a CRY-dependent pathway., 2014, 5: 4391.
[33] Wan G J, Wang W J, Xu J J, Yang Q F, Dai M J, Zhang F J, Sword G A, Pan W D, Chen F J. Cryptochromes and hormone signal transduction under near-zero magnetic fields: New clues to magnetic field effects in a rice planthopper., 2015, 10(7): e0132966.
[34] Zhu H, Yuan Q, Froy O, casselman a, reppert s m. The two CRYs of the butterfly., 2005, 15(23): R953-R954.
[35] Henrich V C, Rybczynski R, Gilbert L I.Peptide hormones, steroid hormones, and puffs: mechanisms and models in insect development., 1998, 55: 73-125.
[36] Stay B.A review of the role of neurosecretion in the control of juvenile hormone synthesis: a tribute to Berta Scharrer., 2000, 30(8/9): 653-662.
[37] Yamanaka N, Rewitz K F, O’Connor M B. Ecdysone control of developmental transitions: lessons fromresearch., 2013, 58: 497-516.
[38] Dubrovsky E B. Hormonal cross talk in insect development., 2005, 16(1): 6-11.
[39] Sandrelli F, Costa R, Kyriacou C P, Rosato E. Comparative analysis of circadian clock genes in insects., 2008, 17(5): 447-463.
[40] Yamanaka N, Romero N M, Martin F A, Rewitz K F, Sun M, O’Connor M B, Léopold P. Neuroendocrine control oflarval light preference., 2013, 341(6150): 1113-1116.
[41] Jensen L T, Culotta V C. Role ofandin iron homeostasis., 2000, 20(11): 3918-3927.
[42] Kaut A, Lange H, Diekert K, Kispal G, Lill R. Isa1p is a component of the mitochondrial machinery for maturation of cellular iron-sulfur proteins and requires conserved cysteine residues for function., 2000, 275(21): 15955-15961.
[43] Pelzer W, Muhlenhoff U, Diekert K, Siegmund K, Kispal G, Lill R. Mitochondrial Isa2p plays a crucial role in the maturation of cellular iron-sulfur proteins., 2000, 476(3): 134-139.
[44] Nilsson R, Schultz I J, Pierce E L, Soltis K A, Naranuntarat A, Ward D M, Baughman J M, Paradkar P N, Kingsley P D, Culotta V C, Kaplan J, Palis J, Paw B H, Mootha V K. Discovery of genes essential for heme biosynthesis through large-scale gene expression analysis., 2009, 10(2): 119-130.
[45] Al-Hassnan Z N, Al-Dosary M, Alfadhel M, Faqeih E A, Alsagob M, Kenana R, Almass R, Al-Harazi O S, Al-Hindi H, Malibari O I, Almutari F B, Tulbah S, Alhadeq F, Al-Sheddi T, Alamro R, Al-Asmari A, Almuntashri M, Alshaalan H, Al-Mohanna F A, Colak D, Kaya N.mutation causes infantile neurodegenerative mitochondrial disorder., 2015, 52(3): 186-194.
[46] Gelling C, Dawes I W, Richhardt N, Lill R, Mühlenhoff U. Mitochondrial Iba57p is required for Fe/S cluster formation on aconitase and activation of radical SAM enzymes., 2008, 28(5): 1851-1861.
Effects of the interference of key magnetic response genes on the longevity of brown planthopper () under near-zero magnetic field
He JingLan1, Zhang Ming1, Liu RuiYing1, Wan GuiJun1, Pan WeiDong2, Chen FaJun1
(1College of Plant Protection, Nanjing Agricultural University, Nanjing 210095;2Beijing Key Laboratory of Bioelectromagetics, Institute of Electrical Engineering, Chinese Academy of Sciences, Beijing 100190)
【Objective】cryptochrome (Cry) and iron-sulfur cluster protein IscA (iron-sulfur cluster assembly, MagR) are potential magnetic receptor proteins in organisms. In this study, key magnetic response genes of the brown planthopper () were knocked-down by RNA interference (RNAi), including,and. The objective of this study is to investigate the role of these three magnetic response genes in the longevity mediation ofin near-zero magnetic field (NZMF). Thus, the response of these three genes to magnetic field could be studied indirectly.【Method】Newly emerged brachypterous female and male adults offed in the lab magnetic field were chosen as the experimental material, and RNAi technology was used to inhibit the key magnetic response genes’ (,and) expression by injection of double stranded RNA, respectively. Then the RNAi treated adults were immediately transformed into the geomagnetic field (GMF) and NZMF respectively to observe their longevity. the total RNA of the RNAi treated adults under GMF was extracted by using the RNAiso Plus method on the 1st, 2nd and 3rd day after the microinjection, respectively. And then the gene expressions of,andwere measured by using the RT-qPCR (real-time quantitative polymerase chain reaction) after the reverse transcription synthesis of first strand DNA in order to test the efficiency of RNAi. 【Result】There was no significant difference in the longevity of female and male adults after the injection of dsbetween the treatments of NZMF and GMF, while after the injection of ds, the longevity of female (27.78%) and male (50.04%) adults under NZMF was significantly longer than that of the individuals under GMF, respectively. Moreover, the longevity of female adults injected with dswas shorter under GMF while longer under NZMF than that of individuals injected with ds, even if the difference was not significant. The longevity of male adults injected with dswas shorter than that of individuals injected with dsunder NZMF (25.41%) and GMF (10.73%), respectively, and the difference under GMF reached the significant level. Furthermore, the longevity of female adults injected with dswas significantly shorter (16.48%) than that of individuals injected with dsunder the NZMF. 【Conclusion】There is a difference in the regulation of the key genes of magnetic susceptibility (,and) on the female and male longevity forunder the change of magnetific field. Hereinto, thesusceptibly responses to the changes of magnetic fields, which shows that the gene knock-down and its interaction with magnetic field changes can significantly influence the longevity of female and male adults, and characterized as “sexual dimorphism”. Similarly, the()also sensitively responds to magnetic field changes, but just for the female adults ofunder the NZMF in contrast to the GMF. However, there is no response ofto magnetic field changes, and this gene may not be involved in the regulation of female and male longevity for.
magnetic field changes;brown planthopper ();magnetic response gene; RNA interference (RNAi); adult longevity; magnetic bio-effect
10.3864/j.issn.0578-1752.2019.01.005
2018-08-02;
2018-09-11
国家自然科学基金(31670855)、国家自然科学基金青年科学基金(31701787)、江苏省自然科学基金青年基金(BK20160717)、中央高校基本科研业务费青年科技创新基金(KJQN201820)
贺静澜,E-mail:2016102054@njau.edu.cn。通信作者陈法军,E-mail:fajunchen@njau.edu.cn
(责任编辑 岳梅)
