淫羊藿苷对小鼠巨噬细胞和淋巴细胞免疫功能的影响
2019-01-08刘君雯刘天明李敬双于凤梅段权倩
刘君雯,刘天明,李敬双,于凤梅,段权倩,张 杨,吴 琼,李 敏
(锦州医科大学,辽宁 锦州 121001)
淫羊藿,又称仙灵脾,为小檗科植物淫羊藿的全草,具有增强机体免疫力、延缓衰老等作用。淫羊藿苷是淫羊藿的主要活性成分,属于黄酮类化合物[1],在药典的记载中,淫羊藿苷不仅具有降血压、补肾壮阳、祛风除湿等作用,而且对腰部和膝盖无力以及中年健忘也有一定的治疗作用。近年来,淫羊藿苷的免疫调节作用在人类医学上研究较多,其中调节细胞信号通路发挥免疫调节作用已成为研究热点之一,在保健品领域也已经有了很广泛的应用[2]。然而,淫羊藿苷在动物医学研究中的应用却很少,淫羊藿在我国分布广泛,将淫羊藿苷做为饲料添加剂会有很好的应用前景。本研究通过体外分离小鼠腹腔巨噬细胞和脾淋巴细胞,检测淫羊藿苷对小鼠腹腔巨噬细胞吞噬功能和脾淋巴细胞增殖以及对小鼠脾淋巴细胞分泌细胞因子的影响,探讨淫羊藿苷对小鼠巨噬细胞和淋巴细胞的免疫功能的调节作用,为淫羊藿苷的开发和利用提供试验依据。
1 材料与方法
1.1 材料
1.1.1 试验动物8周龄,体重为20±2 g,SPF级Balb/c小鼠,由锦州医科大学提供。
1.1.2 试验菌株 金黄色葡萄球菌(菌种号:AB91093),购自中国微生物研究院。
1.1.3 药品和主要试剂 淫羊藿苷标准品成都曼思特生物科技有限公司产品,左旋咪唑广东华南药业集团有限公司产品,新生牛血清、台盼蓝、四甲基偶氮唑盐(MTT)、RPMI-1640培养基和二甲基亚砜(DMSO)Solarbio公司产品,IL-2、IL-4、IL-10和IL-12试剂盒博士德公司产品,营养琼脂培养基、营养肉汤培养基北京奥博星生物技术有限责任公司产品。
1.2 方法
1.2.1 淫羊藿苷试剂的制备 称取淫羊藿苷标准品10 mg,溶于1.0 mL DMSO中,摇匀至全部溶解,加入10 mL RPMI-1640培养液进行稀释,将上述液体吸取10 μL与10 mL RPMI-1640培养液混匀,按照此方法得到了淫羊藿苷药液母液,其终浓度为1.0 μg/mL,0.22 μm滤膜过滤除菌,4℃保存。试验时所需要的淫羊藿苷浓度用RPMI-1640培养液进行稀释。
1.2.2 腹腔巨噬细胞悬液制备 小鼠颈椎脱臼法处死,浸泡于75%酒精消毒约3 min,用5 mL注射器抽取3 mL RPMI-1640培养基注入腹腔内,轻揉拍打腹部3 min后,用注射器抽取腹腔内培养基于离心管中,1 500 r/min离心5 min,弃上清,重复上述操作2次。吹匀后静置5 min,1 000 r/min离心5 min,弃上清,重复1次。将细胞沉淀用RPMI-1640完全培养基悬起,台盼蓝染色,细胞计数板计数,活细胞数达到95%以上,调整细胞密度为5×106个/mL[3-4]。
1.2.3 脾淋巴细胞悬液制备 小鼠颈椎脱臼法处死,浸泡于75%酒精消毒约3 min,在超净台内剪开小鼠腹壁,取出脾置于盛有磷酸盐缓冲(PBS)的培养皿中,反复冲洗2次后置于RPMI-1640培养基中,用5 mL注射器抽取培养基吹打,重复上述操作直至脾被膜透明。将细胞悬液收集于离心管中,1 500 r/min离心5 min,弃上清,加入3 mL Tris-NH4Cl,吹匀,静置5 min,离心,重复上述操作直至红细胞全部裂解。细胞沉淀用RPMI-1640完全培养基悬起,台盼蓝染色,细胞计数板计数,活细胞数达到95%以上。调整细胞密度为5×106个/mL,制成脾淋巴细胞悬液[5-7]。
1.2.4 淫羊藿苷对巨噬细胞吞噬功能的影响96孔细胞培养板,每孔加入100 μL巨噬细胞悬液,设空白对照组、阳性对照组及淫羊藿苷组,每组均设5复孔。空白对照组每孔加100 μL RPMI-1640完全培养基,阳性对照组每孔加100 μL左旋咪唑溶液(终浓度为5 μg/mL),淫羊藿苷不同浓度组每孔分别加入100 μL含不同浓度的淫羊藿苷(使其终浓度分别为1.5、3、6和12 μmol/L)溶液。37℃、5%CO2培养箱中培养24 h后,每孔加入50 μL金黄色葡萄球菌悬液。继续培养9 h,每孔加20 μL MTT。继续培养4 h,1 800 r/min离心10 min,弃上清,每孔加入150 μL DMSO,振荡10 min直至形成紫色溶液,酶标仪于570 nm波长处检测OD值[8]。
1.2.5 淫羊藿苷对淋巴细胞增殖的影响 按照上述方法制备淫羊藿苷诱导的脾淋巴细胞,37℃、5%CO2培养箱中培养35 h,每孔再加入50 μL金黄色葡萄球菌悬液。培养9 h,每孔再加入20 μL MTT,振荡混匀。继续培养4 h,1 500 r/min 4℃离心10 min,弃上清。每孔分别加入150 μL DMSO液,酶标仪检测570 nm处OD值。结果应用公式计算:刺激指数SI=药物刺激孔OD值/空白对照孔OD值[9]。
1.2.6 淫羊藿苷对淋巴细胞分泌细胞因子的影响 用24孔培养板制备淫羊藿苷诱导的脾淋巴细胞,37℃、5%CO2培养箱中培养42 h后1 500 r/min离心5 min,收集上清于试管中。按ELISA试剂盒说明书操作测定分泌液中IL-2、IL-4、IL-10和IL-12浓度[10-11]。
1.2.7 统计学处理 数据用平均数±标准差表示,用统计软件SPSS 17.0进行一维方差分析,P<0.05表示组间差异显著,P<0.01表示组间差异极显著。
2 结果与分析
2.1 淫羊藿苷对巨噬细胞吞噬功能的影响 如表1所示,淫羊藿苷各剂量组和阳性对照组巨噬细胞的OD值均极显著高于空白对照组(P<0.01),淫羊藿苷为3 μmol/L剂量组巨噬细胞的OD值与阳性对照组相比无明显差异(P>0.05),表明淫羊藿苷能增强巨噬细胞的吞噬能力。淫羊藿苷各剂量组之间进行比较,3 μmol/L剂量组巨噬细胞的OD值显著高于1.5 μmol/L剂量组(P<0.05),极显著高于6 μmol/L和12 μmol/L剂量组(P<0.01),表明淫羊藿苷对巨噬细胞的吞噬功能呈双重调节作用,3 μmol/L剂量组效果较佳。
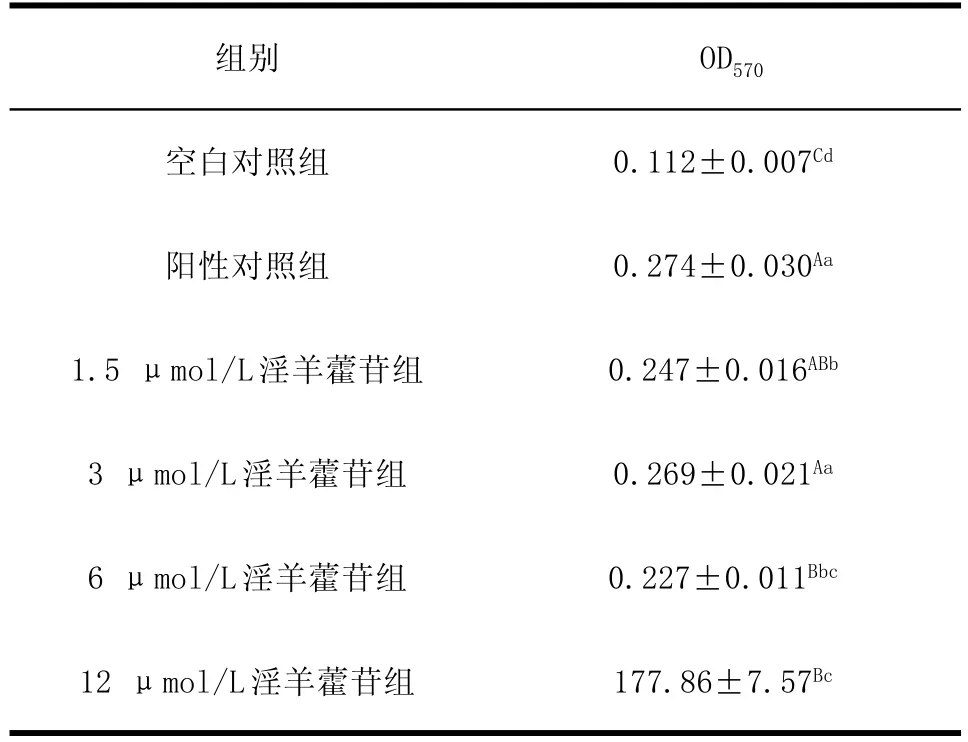
Table 1Effect of icariin on macrophages phagocytic表1淫羊藿苷对巨噬细胞吞噬功能的影响
2.2 淫羊藿苷对淋巴细胞增殖的影响 如表2所示,淫羊藿苷各剂量组和阳性对照组淋巴细胞的刺激指数均极显著高于空白对照组(P<0.01),淫羊藿苷为1.5、3和6 μmol/L剂量组淋巴细胞的刺激指数与阳性对照组相比无明显差异(P>0.05),表明淫羊藿苷能够刺激淋巴细胞的增殖。淫羊藿苷各剂量组之间进行比较,3 μmol/L剂量组淋巴细胞的刺激指数与1.5 μmol/L和6 μmol/L剂量组相比无明显差异(P>0.05),但显著高于12 μmol/L剂量组(P<0.05),表明淫羊藿苷对刺激淋巴细胞的增殖呈双重调节作用,淫羊藿苷为3 μmol/L剂量组效果较佳。

表2 淫羊藿苷对淋巴细胞增殖的影响Table 2Effect of icariin on lymphocyte proliferation
2.3 淫羊藿苷对淋巴细胞分泌细胞因子的影响ELISA法测定淫羊藿苷对淋巴细胞IL-2、IL-4、IL-10和IL-12的分泌的影响,结果如表3所示。淫羊藿苷各剂量组和阳性对照组各细胞因子的分泌水平均极显著高于空白对照组(P<0.01),淫羊藿苷为3 μmol/L剂量组淋巴细胞IL-2、IL-4和IL-12的分泌与阳性对照组相比无明显差异(P>0.05),淫羊藿苷为1.5 μmol/L和3 μmol/L剂量组淋巴细胞IL-10的分泌与阳性对照组相比无明显差异(P>0.05),表明淫羊藿苷能够刺激淋巴细胞IL-2、IL-4、IL-10和IL-12的分泌。淫羊藿苷各剂量组之间进行比较,3 μmol/L剂量组IL-2分泌显著高于1.5 μmol/L剂量组(P<0.05),极显著高于6 μmol/L和12 μmol/L剂量组(P<0.01);该组IL-4和IL-12的分泌水平也均极显著高于其他剂量组(P<0.01);但IL-10的分泌水平虽稍高于其他剂量组,但无明显差异(P>0.05)。表明淫羊藿苷对刺激淋巴细胞IL-2、IL-4、IL-10和IL-12的分泌呈双重调节作用,淫羊藿苷为3 μmol/L剂量组效果较佳。
3 讨论
淋巴细胞增殖、巨噬细胞的吞噬以及细胞因子的分泌是评价细胞免疫功能的重要指标。李书桐等[12]研究了淫羊藿苷对小鼠腹腔巨噬细胞功能的影响,结果显示淫羊藿苷能增强巨噬细胞吞噬中性红的功能。对巨噬细胞吞噬功能的研究,多数都利用中性红,本研究显示淫羊藿苷能够提高腹腔巨噬细胞的吞噬金黄色葡萄球菌能力,表明淫羊藿苷增强了机体对于外来病原体的固有免疫反应能力,此类报导甚少。Zhao L M等[13]通过观察淫羊藿苷对化疗后小鼠免疫细胞的影响,结果淫羊藿苷能够增强淋巴细胞的增殖能力、增强巨噬细胞的吞噬能力。潘晓明[14]研究了淫羊藿苷对免疫细胞及免疫系统的影响,结果淫羊藿苷能够促进IL-12的产生。肖幸丰等[15]的研究表明淫羊藿苷能够促进Con A诱导的小鼠脾淋巴细胞增殖以及IL-2的生成。本研究结果显示淫羊藿苷能够提高腹腔巨噬细胞的吞噬功能,促进脾淋巴细胞增殖,刺激淋巴细胞IL-2、IL-4、IL-10和IL-12的分泌。与已报道的试验结果一致,提示淫羊藿苷可能通过激活静止的T细胞和巨噬细胞,使其活化,增强巨噬细胞的吞噬功能,增强淋巴细胞分化增殖产生细胞因子,从而发挥免疫增强的作用。
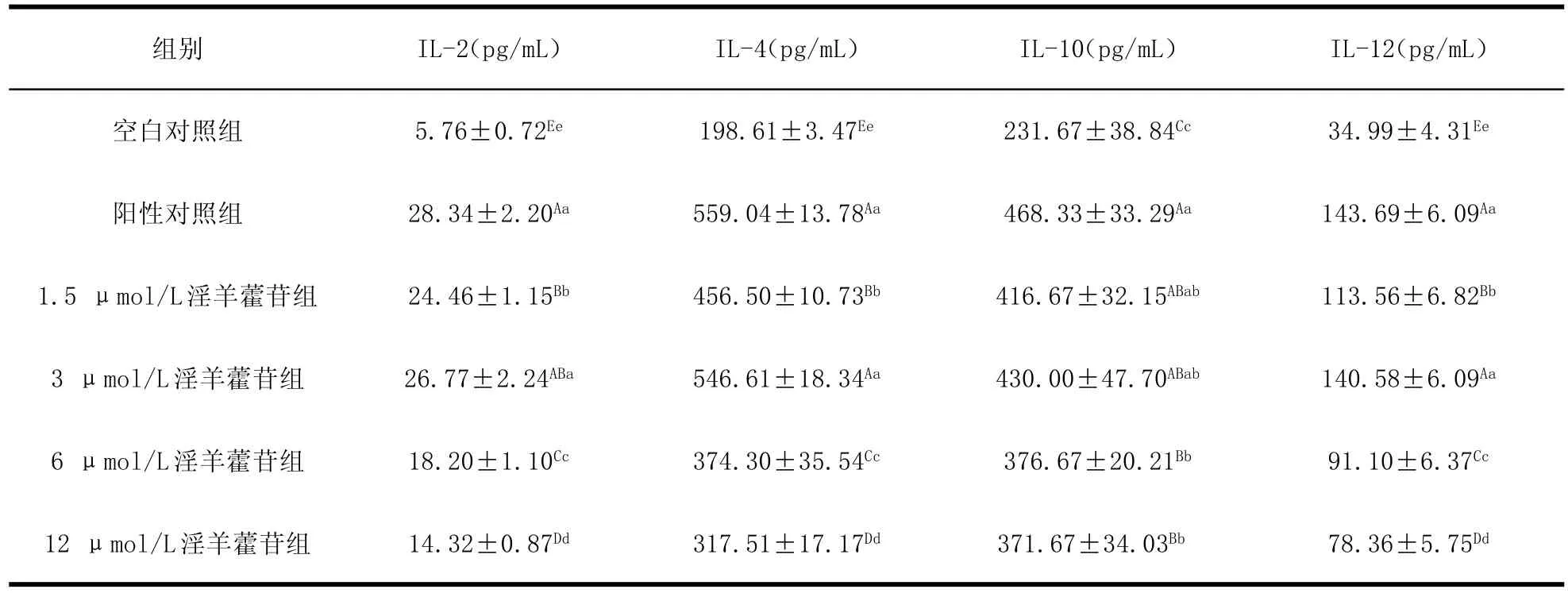
Table 3 Effect of icariin on cytokines secreted by lymphocyte表3 淫羊藿苷对淋巴细胞分泌细胞因子的影响
