Co/C催化剂的制备及其催化硼氢化钠水解制氢性能的研究
2019-01-08杨在兴徐嘉宝黄起竟林艳红张启家
杨在兴, 徐嘉宝, 黄起竟, 季 禾, 林艳红, 邓 茜, 张启家
(沈阳大学 师范学院, 辽宁 沈阳 110044)
当前社会,能源问题是人类社会关注的焦点,随着人们对科技的不断探索,越来越多的能源被开采和利用.目前能源结构中大量使用的石油、天然气、煤等石化能源均属于不可再生能源,储量有限,同时又不可避免的带来一定程度的环境污染问题.因此,研究和开发储量丰富、环境友好的可再生绿色能源是当前能源领域的重点研究方向.氢能作为一种能量密度高、燃烧产物无污染、来源广的能源载体,氢能的开发和利用被认为是未来能源结构向低碳转型的重要方式.氢气的制取和存储都已成为当今世界的重大热门研究课题[1-2].
在众多制氢方法中,含有负氢的硼氢化钠可以在水溶液迅速放氢,在燃料电池以及车载移动储氢领域具有明显的优势,因此被科研工作者广泛关注[3-7].硼氢化钠制氢具有如下优点:①质量储氢容量高(质量分数达10.8%);②产氢纯度高;③制氢反应温度低;④储存和运输方便安全;⑤能源循环利用率高.通过对硼氢化钠水解制氢研究发现室温条件下,硼氢化钠与水发生反应如下:
由此可知,反应溶液pH值对反应速率有很大影响,在强碱性条件下,硼氢化钠与水反应的反应速率非常慢,因此在强碱性溶液中,NaBH4能够稳定存在.在中性水溶液中,NaBH4放氢过程不受控制,所以难以在储氢领域得以实际应用.若利用NaBH4碱性溶液作为氢源,则必须有高效的水解催化剂促进硼氢化钠在工作条件下快速稳定的释放出氢气.当前对于NaBH4水解制氢催化剂的研究主要分为两类:贵金属催化剂[8-12]和非贵金属催化剂[13-18].贵金属催化剂如Rh和Pt等催化活性很高,但是成本较高,是阻碍其商业应用的主要原因;非贵金属催化剂如Co、Ni和Cu等都具有催化活性,普遍认为过渡金属催化剂最具工业应用前景.
大量的对比研究表明,在制备方法相同,结构组成相似的的前提下,钴基催化剂和镍基催化剂普遍具有较高的催化活性[19-22].Liu等[23]的研究表明雷尼钴和雷尼镍都具有较高的催化活性,并且两者形成的合金催化性能显著提高.Xu[24]等使用活性炭作为载体,应用钴盐作为催化剂来源,硼氢化钠作为还原剂制备了硼化钴/活性炭负载型催化剂,研究结果显示这种催化剂的催化性能依赖于对催化剂的后期高温处理,400 ℃煅烧后催化剂表现出最佳的催化性能.Dai等人[25]对传统化学镀的方法进行了改进,以泡沫镍为基底电镀了一层无定形的硼化钴作为水解制氢的催化剂,催化性能提高,改进后的催化剂性能受到制备方法与后处理工艺的影响.Kwon等人[26-27]以Cu片为基底分别采用电沉积法和化学沉积法制备了硼化钴和单质钴催化剂,并研究了催化剂的结构和催化性能之间的关系,发现Co在催化剂中的纳米尺寸越小,催化性能越好.Zhang等人[28]采用化学镀的方法制备了硼化钴催化剂,并系统的研究了不同反应条件对催化剂性能的影响,发现在最优化条件下制备的催化剂催化硼氢化钠水解制氢速率达到1 846 mL·g-1·min-1.Wei等人[29]以三氧化二铝为基底采用化学沉积法制备了Co/Al2O3催化剂,并研究了其催化硼氢化钠的放氢性能,结果表明最优条件下制备的催化剂催化硼氢化钠水解制氢的表观活化能为64.4 kJ/mol.目前的制备方法工艺复杂,生产成本相对较高.因此,开发制备过程简单,催化性能高的过渡金属催化剂具有重要的研究价值.本文采用一步烧结法制备了Co/C过渡金属催化剂,并研究了不同含量钴对催化剂性能的影响.同时选择催化性能最好的催化剂进行了循环催化性能的测试,并通过不同温度下的催化放氢曲线计算了其催化硼氢化钠水解制氢的活化能.
1 实验材料与方法
1.1 实验材料
柠檬酸(C6H8O7)、草酸铵((NH4)2C2O4)、氯化钴(CoCl2)、氢氧化钠(NaOH)和无水乙醇(C2H5OH)均为分析纯试剂.
1.2 催化剂的制备
分别称取1 g柠檬酸,1 g草酸铵,以及适量的氯化钴,置于100 mL烧杯中,向烧杯中加入少量去离子水搅拌溶解30 min,然后超声波震荡30 min.随后将烧杯转移到200 ℃恒温干燥箱中,恒温2 h以后取出,自然冷却至室温.此时所得样品为棕褐色固体粉末,将样品用去离子水进行超声分散,超声洗涤后将所得溶液在10 600 r·min-1的高速离心机上离心分离20 min,此过程重复3次.所得固体再用无水乙醇超声洗涤1次,在室温下干燥,得到Co/C催化剂样品.
本实验中根据氯化钴用量不同(0.2、0.4和0.6 g),所制备的Co/C催化剂样品分别标记为1#、2#和3#催化剂.催化剂所需制备条件列于表1.

表1 不同催化剂的制备条件Table 1 Preparation conditions of different catalysts
1.3 催化剂的表征
采用 D8-ADVANCE X射线衍射分析仪[30-31]对所制备的3种催化剂样品进行物相组成测试, 测试条件:CuKα射线,功率为40 kV/100 mA,扫描范围为 10°~80°,扫描速度为2°/min.
1.4 催化性能测试
催化剂催化硼氢化钠的放氢量可由排水法准确测出, 本实验装置图如图1所示. 首先配置质量分数10%的NaOH和质量分数3%的硼氢化钠溶液作为水解制氢溶液.将10 mL上述溶液加入到三口烧瓶中, 随后放置于恒温水浴槽中, 待温度稳定后向其中加入10 mg所制备的催化剂固体.从加入催化剂时开始计时, 同时记录硼氢化钠水解反应的产氢量, 反应产生的氢气用排水法进行收集及记录产生氢气的体积. 产氢过程结束后将催化剂用蒸馏水和无水乙醇冲洗3次,烘干备用.

图1 氢气产生收集装置图Fig.1 Hydrogen production and collection device diagram
1.5 催化放氢速率计算
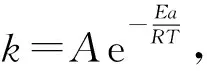
2 结果与讨论
2.1 物相分析
为了研究所制备催化剂的晶体结构以及物相组成,我们选取了3#催化剂进行了XRD测试,结果如图2所示.通过和标准PDF卡片库进行对比发现,所制备的Co/C催化剂主要物相组成为C2CoO4·2H2O,PDF卡片号为25-0250,主要衍射峰的位置列于图中.同时从图中可以看出所制备的催化剂物相组成中草酸钴的衍射峰较弱并且有宽化的现象,这说明所制备的草酸钴可能为非晶状态.另外,在XRD图谱中可以看出强度较低的宽化峰存在,这些衍射峰变宽主要是由于在催化剂的制备过程中柠檬酸的炭化所致.
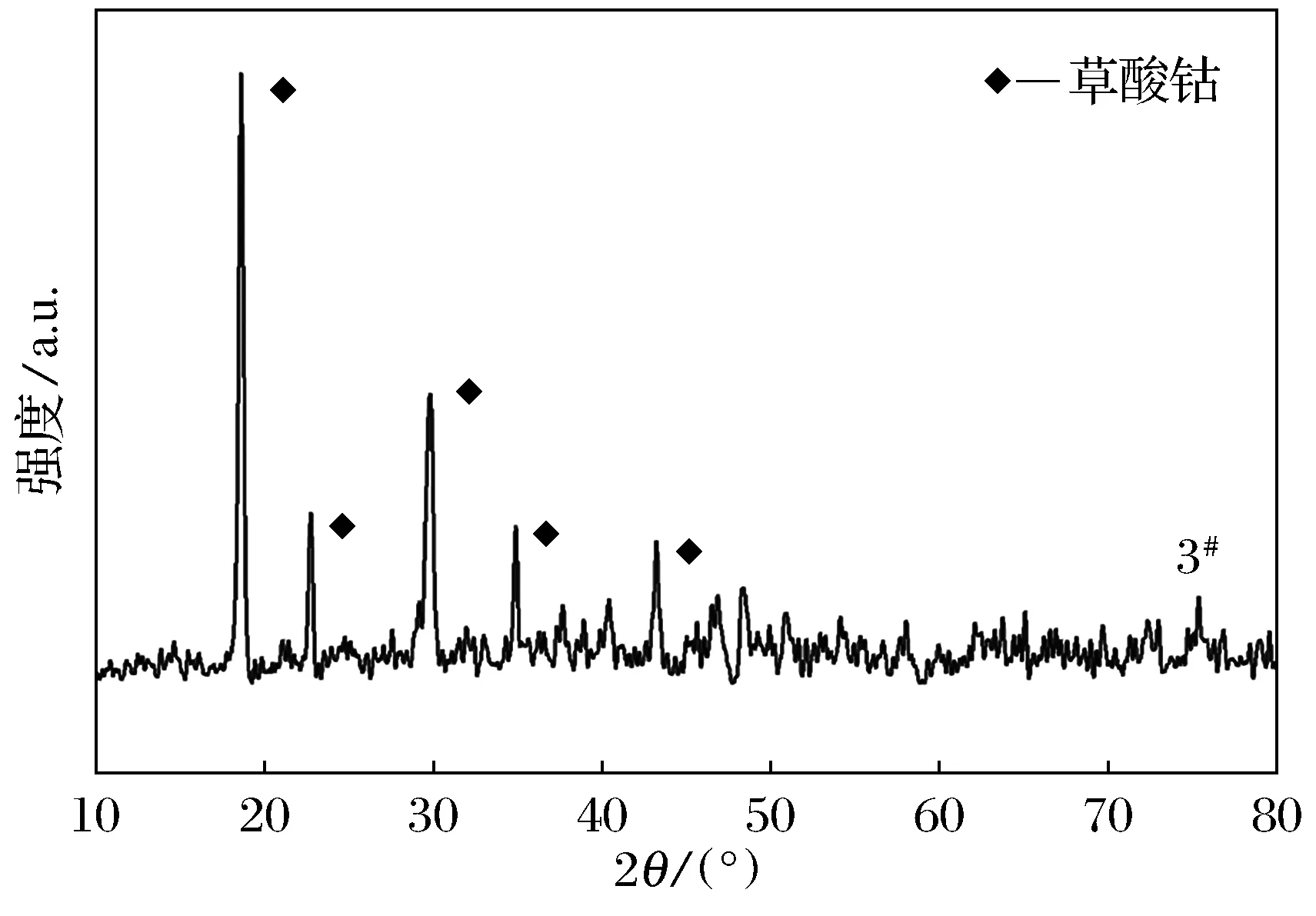
图2 3#催化剂的XRD图谱Fig.2 The XRD pattern of No.3 catalyzer
2.2 放氢性能测试
为了测试不同Co含量对硼氢化钠催化放氢性能的影响,我们选取3种催化剂在相同温度下进行催化放氢性能测试.图3为3种Co基催化剂在反应体系为50 ℃时,分别催化硼氢化钠的水解放氢曲线.从图中可以看出,在相同温度下的3种Co基催化剂的催化性能不同,其中以3#催化剂的催化效果最好,放氢速率达到2 356.5 mL·g-1·min-1,而1#催化剂相同条件下,催化放氢速率仅为1 178.3 mL·g-1·min-1.这说明对于Co/C催化剂来说,催化性能随着Co含量的增加而增加,这也说明在催化剂结构组成中起到活性位点作用的为钴原子.同时从图中可以看出,3种催化剂在催化硼氢化钠制氢时都有一段诱导期,其中3#催化剂诱导时间最长,为3 min,1#催化剂诱导期最短,为1.5 min,产生诱导期应该是受到催化剂分散性的影响,Co含量低时被碳化后的柠檬酸分散的更好,因此诱导期时间更短.

图3 1#、2#、3#催化剂在50 ℃下的产氢量Fig.3 Hydrogen production of Co catalysts No.1, 2 and 3 at 50 centigrade
催化剂的循环催化性能也是实际应用中非常重要的参数指标.笔者选取上述3种催化剂中催化性能最好的3#催化剂在反应体系温度为50 ℃下进行循环催化水解制氢反应测试.催化剂经过洗涤、过滤等步骤,重复催化反应3次.图4为3#催化剂3次循环催化硼氢化钠的水解放氢曲线,可以看出,3#催化剂第1次的催化制氢速率最高为2 356.5 mL·g-1·min-1,第2次循环的催化放氢速率最低为128.6 mL·g-1·min-1,第3次循环放氢速率为367.7 mL·g-1·min-1,循环后放氢速率的下降应该是催化剂发生了团聚,影响了活性位点与硼氢化钠的接触.这里需要注意的是,从放氢曲线可以看出经过2次循环后,3#催化剂第3次催化放氢没有任何诱导期,并且放氢速率比第2次循环明显提高,这主要是因为经过2次循环后,草酸钴被原位还原为零价钴,因此3#催化剂在第3次循环表现出较好的循环催化性能.
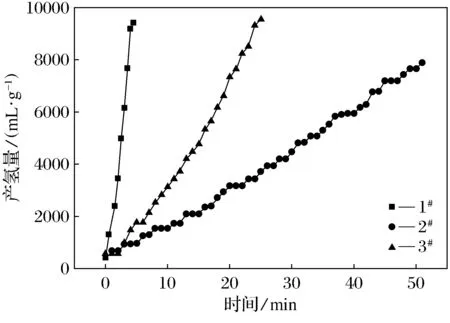
图4 50 ℃下3#催化剂重复使用3次的产氢量Fig.4 Hydrogen production of No.3 catalyst reused for three times at 50 ℃
2.3 催化放氢动力学测试
为了进一步研究3#催化剂的催化放氢的动力学性能,我们对其进行了不同温度下的催化放氢性能测试.如图5所示,为3#催化剂分别在反应体系温度为30、40和50 ℃时的放氢曲线.从图中可以看出,在短时间内,50 ℃下的3#催化剂的放氢速率(2 356.5 mL·g-1·min-1)明显高于3#催化剂在30和40 ℃体系下的放氢速率.并且反应体系温度在30 ℃时,3#催化剂催化的诱导时间明显长于温度为50和40 ℃时,达到60 min.这说明,在相同条件下温度越高,催化放氢速率越快.
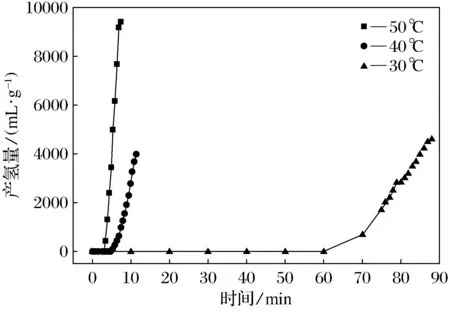
图5 30 ℃、40 ℃、50 ℃下3#催化剂的产氢量Fig.5 Hydrogen production of No.3 catalyst at 30 ℃, 40 ℃ and 50 ℃
根据不同温度下的放氢曲线,可由反应速率方程得到不同温度下的硼氢化钠水解反应速率常数k.以lnk对1 000/T作图,所得数据点绘制于直角坐标系当中,同时对数据点进行线性拟合,如图6所示.根据线性拟合结果,所得直线的斜率为-0.076 2,再通过阿伦尼乌斯公式k=Aexp(-Ea/RT),计算得到3#催化剂催化硼氢化钠水解制氢反应的活化能为63.4 kJ/mol.这一数据与负载型Co基催化剂的数值接近,说明3#催化剂具有较高的催化活性.

图6 3#催化剂在不同温度下的Arrhenius曲线Fig.6 Arrhenius curve of No.3 catalyst under different temperatures
3 结 论
本文通过一步烧结法成功制备了草酸钴为主相的Co/C催化剂,通过排水法对硼氢化钠在不同催化剂的作用下制氢速率进行了对比研究.结果表明,催化剂的催化活性随着活性中心金属元素含量的升高而升高,3#催化剂表现出最佳的催化性能,50 ℃下放氢速率达到2 356.5 mL·g-1·min-1.通过对放氢动力学曲线分析,计算出水解制氢反应的活化能为63.4 kJ/mol.
