p38 MAPK通路在小型猪自体静脉移植模型中的作用研究
2019-01-08黄墨林郑远彪葛建军
黄墨林,张 锐,伟 俊,郑远彪,葛建军
冠状动脉旁路移植术(coronary artery bypass graft,CABG)作为冠状动脉粥样硬化型心脏病(coronary atherosclerotic heart disease,CHD)的主要方法,由于取材的限制,大隐静脉作为桥血管的主要血管使得内膜增生成为了静脉移植后通畅的主要障碍,虽然血管平滑肌细胞的迁移和增殖影响血管重塑过程,但尚未有系统预防静脉移植物内膜增生的治疗方法[1]。平滑肌细胞(smooth muscle cells,SMCs)的增殖、迁移以及合成分泌大量的细胞外基质是内膜增生和血管再狭窄的关键[2],而其中的丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)信号传导通路与CABG术后桥静脉再狭窄有着密切的关系。在MAPK家族中,p38 MAPK是较新的一个通路[3],所以目前已有许多学者对此问题展开研究并成功建立了大鼠[4]、家兔[5]、狗[6]的颈静脉移植模型,小型猪的大隐静脉-颈内动脉模型[7-8]。但在临床实践中,冠脉的情况较颈动脉仍有差别,分枝更多,血流情况更复杂,手术难度更大。但完全模拟人的冠脉搭桥手术,在不停跳情况下建立猪的冠脉搭桥模型报道较少。有研究[9]表明猪的冠脉解剖更接近于人。所以在小型猪的冠脉搭桥模型上应用p38 MAPK通路的高度选择性抑制剂SB203580(美国Selleck公司)干预,观察静脉桥血管术后增生以及p38、p-p38的表达情况,对p38 MAPK通路在CABG术后桥静脉再狭窄中的作用进行探讨,为临床上进一步防治CABG术后血管狭窄提供新的思路。
1 材料与方法
1.1实验动物健康小型巴马猪,雌雄不分,体质量35~40 kg,由泰州小型猪生产基地提供,术前正常喂养1周。
1.2主要实验器械及实验药品ZS-MV-HX动物呼吸机(上海恒勤仪器设备有限公司);JR2000D心电监护仪(山东博科科学仪器有限公司);GD350-B电刀(上海泸通电子有限公司); 7A-23B负压吸引器(江苏鱼跃医疗设备股份有限公司);BeneHeart D6除颤仪(上海三崴医疗设备有限公司);搭桥器械一套(上海医疗器械有限公司手术器械厂);KD-202石蜡切片机(金华科迪仪器设备有限公司);舒泰50(WK001,法国virbac公司);HE染色试剂盒(C0105,上海碧云天生物技术有限公司);Western blot相关仪器。
1.3实验过程动物实验于安徽医科大学动物实验中心完成,经安徽医科大学动物伦理委员会批准。
1.3.1实验前准备 正常喂养1周后,术前禁食12 h,禁水4 h,称重,准备手术台,准备多巴胺、利多卡因、阿托品等抢救药品。
1.3.2麻醉 给予舒泰2.5 mg/kg,盐酸赛拉嗪2 mg/k进行肌注麻醉。麻醉后给予手术区域备皮,固定后于耳缘静脉建立静脉通道,气管插管并连接呼吸机,参数:潮气量10~12 ml/kg,氧浓度(FiO2)60%~70 %,通气频率(f)15~20次/min。并于一侧后腿内侧根部切开行股动脉穿刺,检测动脉血压及血氧饱和度,实验组于术前1 h给予SB203580(3 mg/kg)灌胃,麻醉后在大号喉镜辅助下插入胃管,深度大约猪身长一半长度,给予配好的溶剂3 mg/kg灌入,为防止返流,灌后应抬高猪的上半身1 h后开始手术。
1.3.3取大隐静脉 取碘伏消毒胸前及双侧大腿内外侧,铺巾及无菌洞巾,于右侧后腿背侧关节外科行纵行切口,下至后腿第二关节,上至大腿根部,长约15~20 cm,组织剪剪开皮下筋膜,钝性分离脂肪及结缔组织,可见一条暗紫色粗长大隐静脉,充分游离周围组织,暴露静脉,用组织剪剪开血管鞘膜,并用蚊氏钳钝性分离;然后用橡皮筋穿过血管下方,轻提血管,由远心端向近心端缓慢游离静脉;游离过程中尽量避免破坏血管外膜,用0号丝线或1号丝线结扎大隐静脉细小分支,分支结扎完毕以后,以血管钳夹闭远心端,剪断血管,用小型动物灌胃针插入血管内,1号线结扎固定,近端血管钳夹闭后剪断,取下后近端夹闭,远端从橄榄头注入肝素水(250 ml生理盐水加12 500 U肝素),观察有无破口,破口处可用6-0prolene或7-0prolene线缝合,待检查无破口后放入肝素水中备用。
1.3.4搭桥 胸前区常规消毒铺巾,20号刀片沿胸骨中线切开皮肤,电刀逐层切开皮下组织、脂肪、肌肉层,分离并暴露胸骨,胸骨劈刀沿胸骨正中劈开胸骨,电刀止血,胸撑撑开胸骨,分离结缔组织、胸腺组织、充分暴露心包和主动脉;剪开心包并悬吊,在左上肺静脉上方缝一条纱条,悬吊并充分暴露心脏,侧壁钳夹闭部分主动脉,待心率血压稳定后用打孔器于夹闭部分打孔,修剪桥静脉,并用6-0prolene线缝合桥静脉远端与主动脉侧孔,夹闭桥静脉近端,松开侧壁钳并检查缝合口有无漏血。暴露冠脉左前降支中远端,选择分支较少的一段,以心表固定器固定,有口刀片分离靶血管周围结缔组织,冠脉刀切开小切口并以前扬剪刀扩大切口,塞入合适分流栓;二氧化碳吹管辅助暴露切口;用6-0prolene或7-0prolene线缝合桥静脉近端与靶血管;吻合完成后开放血管,检查吻合口有无漏血、狭窄。以1号丝线结扎原前降支,待心率,血压稳定后,止血,放入持续负压引流管;钢丝固定胸骨,逐层关胸。
1.3.5术中管理 术中每小时追加一次舒泰(计量为初始计量的1/3),每小时追加一次肝素(计量为初始计量的1/2),丙泊酚6~8 ml/h持续泵入维持麻醉;青霉素60 mg/kg静滴预防感染,500 ml生理盐水+1 g氯化钾+1.25 g硫酸镁补充液体和电解质。
1.3.6术后管理 术后单笼喂养观察,持续静脉补液,每天静脉给予青霉素(60 mg/kg,分2次,待3 d后恢复自主进食,精神良好后可返回普通饲养笼。
1.3.7静脉获取 术后喂养4周,常规麻醉,开胸(操作同前),分离黏连组织后取血管,观察通畅情况。用于HE染色者10%的甲醛溶液浸泡固定,24 h后常规脱水,石蜡包埋切片,苏木精-伊红染色(HE染色);用于Western blot的部分放入冻存管中-80 ℃保存,提取蛋白,Westem blot法检测目的蛋白,实验猪可于心房注射Kcl处死。
1.3.8Western blot检测p38、p-p38的表达 把取出的血管组织用剪刀尽量剪碎后放入匀浆器中,加入500 U蛋白裂解液,充分碾碎组织,用移液器将裂解液移至1.5 ml离心管中然后在4 ℃下12 000 r/min 离心5 min,取上清液分装于1 ml EP管中。按照1 ∶4(上样缓冲液 ∶上清液)的比例加入配制好的上样缓冲液,放入100 ℃开水中煮30 min,固定蛋白。泠却后放入-20 ℃冰箱保存。后每组蛋白进行SDS-PAGE电泳,根据β-actin蛋白的定量配平后,加入10%的凝胶孔中,依次进行:电泳(浓缩胶60 V,分离胶120 V约2 h)、转膜(300 mA恒流1.5 h)、封闭(5%的脱脂牛奶常温封闭2 h)、孵育一抗(英国Abcam公司)4 ℃孵育过夜、孵育二抗(英国Abcam公司)常温摇床孵育2 h、Thermo Scientific SuperSignal West Pico Kit 化学发光底物显影,分析周期蛋白表达。

2 结果
2.1各组存活及血管通畅情况假手术组(n=10)均成活,对照组(n=10)及SB203580组(n=10)各死亡1只,均补做实验,术后各组动物伤口均愈合良好,未见感染、出血、伤口裂开等情况。术后静脉桥均充盈良好,波动有力,除对照组2只因血栓形成造成桥血管阻塞(以于后期补做),其余均通畅。
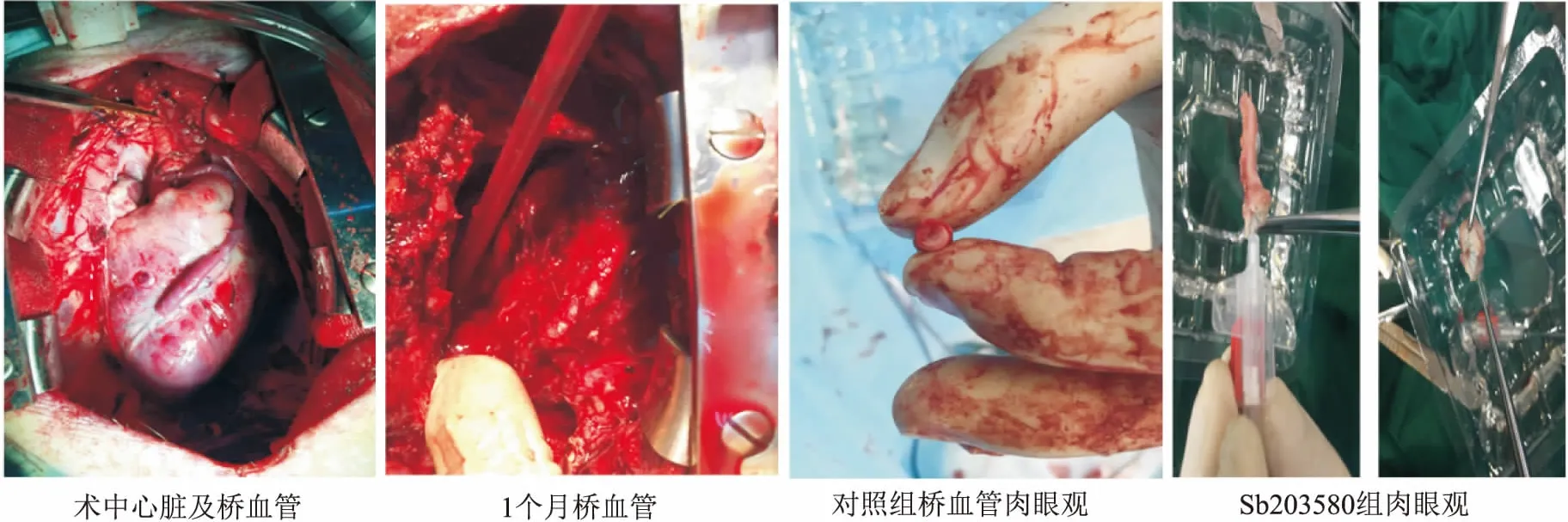
图1 手中及术后部分肉眼观图片
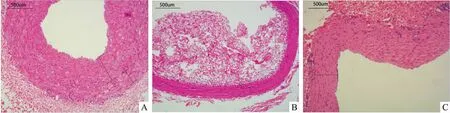
图2 HE染色结果×100
2.2桥血管内膜及中膜的病理变化
2.2.1血管肉眼观情况 大体观,移植静脉均有不同程度的扩张、增厚、管壁水肿、管腔狭窄,对照组内膜、中膜增厚最为明显,部分血管可见管腔次全闭塞,坏死物沉积。实验组也可见管腔内增生,但增生程度明显低于对照组,未见有管腔闭塞。假手术组增生情况最轻,管腔通畅情况良好,见图1。
2.2.2HE染色结果 HE染色后,观察各组内膜、中膜均有不同程度的增生,通过计算机分析显示:SB203580组与对照组相比,SB203580组内膜厚度明显低于对照组,差异具有统计学意义(t=1.45,P<0.05)。SB203580组与对照组相比,SB203580组中膜厚度明显低于对照组,差异有统计学意义(t=3.19,P<0.05)。SB203580组与假手术组相比,SB203580组内膜增生厚度高于假手术,差异具有统计学意义(t=3.12,P<0.05),见图2、表1。假手术组仅模拟手术过程,不进行血管移植;对照组于手术前进行DMSO灌胃,后进行常规冠脉搭桥术;实验组于术前1 h给予SB203580 3 mg/kg灌胃。
2.2.3Western bolt结果 各组血管均以Western bolt检测p38和p-p38的蛋白产物,测量灰度值后进行统计学分析,SB203580组与对照组相比,结果显示SB203580组的p38和p-p38的产物明显低于对照组,差异具有统计学意义(t=2.12,P<0.05),SB203580组与假手术组相比,SB203580组的p38和p-p38明显高于假手术组,差异具有统计学意义(t=3.23,P<0.05)。见图3。假手术组仅模拟手术过程,不进行血管移植;SB203580组于术前1 h给予SB203580 3 mg/kg灌胃;对照组术前给以DMSO灌胃,后进行常规冠脉搭桥手术。

表1 各组静脉术后内膜、中膜增生情况比较
与SB203580组比较:*P<0.05 ;与假手术组比较:#P<0.05
3 讨论
CABG术后静脉桥再狭窄一直是CABG手术的一个重要问题,数据显示CABG术后10年,30%的静脉桥血管会发生再狭窄,40%的静脉桥血管会发生闭塞[10]。静脉桥血管再狭窄是一个多因素、长时间、多机制、涉及多个病理变化的过程[11],目前研究机制表明:内皮细胞受损、平滑肌细胞的增殖与迁移、外膜细胞的纤维化、炎症反应、缺血再灌注损伤以及血流动力学的改变都会影响到术后桥血管的再狭窄[12]。其病理过程主要包括:血栓形成、内膜增生以及后期的粥样斑块硬化。而内膜增生是导致前中期血管狭窄的主要因素。其原因主要是在桥血管获取过程当中由于分离、结扎、离断、缝合等操作,以及静脉动脉化和血流动力学改变,都会导致血管内膜损伤,导致血小板聚集,激活炎症反应,释放大量细胞因子和炎性介质,连同受损内皮细胞分泌的一部分有丝分裂因子,促进SMCs的活化,收缩型转化为合成型,分泌细胞因子和血管活性物质,如血小板衍生因子(PDGF)、5-羟色胺(5-HT)、血管紧张素Ⅱ(AT-Ⅱ)、胰岛素生长因子等,这些活性物质及细胞因子再次促进SMCs大量增殖并向内膜迁移,同时产生高于正常水平的细胞外基质,引起血管新生内膜形成及管壁增厚,管腔狭窄,构成了冠脉旁路移植术后桥血管再狭窄的病理基础。而后受损的内皮细胞与SMCs通过细胞因子的作用形成正反馈循环。SMCs的迁移、增殖和合成分泌大量的细胞外基质是内膜增生和血管再狭窄的关键[13]。本研究显示静脉移植术后4周,使用SB203580组的内膜增生明显低于对照组,差异具有统计学意义。因此研究内膜增生的变化过程和启动基因,可以为临床预防CABG术后静脉桥的狭窄提供新的思路。

图3 Western bolt结果
A:各组p38、p-p38表达结果;B: 各组蛋白测量灰度值比较
另一方面,静脉管腔较一般冠状动脉粗,并且与动脉相比缺少具有弹性的肌肉层,当移植到冠状动脉上时,突然受到高于静脉压力约10倍的机械应力的刺激,并且在动静脉吻合口处由于手术方式和吻合方法的不同,在吻合口处易形成乱流和涡流。研究[14]表明:过高或过低的切应力以及异常的振荡频率都会引起内皮细胞功能的紊乱,内膜增生以及血管狭窄往往首先发生在接口或者发生机械应力改变处。血液中脂质、血小板、细小血栓等会持续沉积于吻合口处,而生物机械应力会改变细胞内的生理信号传导及基因表达,促进其分化、增殖和合成基质蛋白。桥静脉在剧增的血管压力下激活细胞生长所需的信号转导通路中的MAPK。本实验中SB203580组的p-p38表达明显受到抑制,低于对照组,且SB203580组的内膜、中膜较假手术组明显增生,证明静脉动脉化后P38MAPK通路激活,参与了静脉内膜的增生及血管重塑的过程。
内皮的损伤、炎症反应、血流压力产生的生物机械应力的变化,激活血小板及白细胞,并释放大量炎症介质和细胞因子,连同受损内皮细胞分泌的有丝分裂原因子,促进中膜SMCs的活化,使其表型发生变化,并分泌局部血管活性物质和细胞因子,这些活性物质再次促进中膜SMCs增殖并穿过血管内弹性层向内膜迁移,同时产生过量的细胞外基质,引起新生内膜形成及管壁增厚。受损的内皮细胞与SMC通过细胞因子的作用形成正反馈。可能是由于SB203580减轻了p38的磷酸化,抑制了内膜和中膜的增厚,减轻了正反馈作用,引起了p38蛋白表达的减少。
本实验与大鼠、兔、小型猪的颈静脉-动脉移植相比,手术过程模拟现在常用的不停跳冠脉搭桥技术,不论在血管获取过程、长度、内径、吻合过程以及后期的内膜增生过程,都更接近于临床,证明在冠脉的复杂血流条件下,p38 MAPK通路对于CABG术后桥血管的再狭窄起到重要的作用,为进一步预防CABA术后血管再狭窄,提高术后桥血管通畅率提高理论依据。
