犬牙槽骨干细胞与髂骨骨髓干细胞成骨能力的体内实验比较研究
2019-01-08徐孟丹王默涵郑文龙邹多宏王元银
顾 旷,周 洁,周 咏,吴 涛,徐孟丹,王默涵,郑文龙,邹多宏,王元银
随着细胞生物学技术的发展,骨组织工程为骨缺损修复提供了新的方式,并且引起了广泛的关注[1-2]。获取并培养能在体内表现出较强成骨能力的干细胞是运用骨组织工程修复骨缺损的主要途径[3-4]。髂骨来源骨髓间充质干细胞 (iliac bone bone marrow mesenchymal stromal cells,I-BMSC) 具有较强的增殖能力和分化潜能,是目前骨缺损研究中重要干细胞来源之一[5]。除此以外,来自于牙体组织的干细胞也表现出与I-BMSC相似的细胞特性[6-8]。近年来,有研究[9]显示牙槽骨干细胞 (alveolar bone-derived stem cells,Al-BMSC) 在成骨诱导后,高表达成骨相关基因,为骨组织工程提供一种新的干细胞来源。Al-BMSC相较于其他牙源性干细胞具有诸多优点,取材方便,容易获得;位置表浅,取材时创伤较小等。基于此,该研究创建拉布拉多犬下颌骨种植体近中临界骨缺损模型,将Al-BMSC和I-BMSC分别与支架材料复合后,植入种植体近中骨缺损区,观察二者的成骨能力差异。
1 材料与方法
1.1材料
1.1.1实验动物 拉布拉多犬10只,36周龄,体重约1.5 kg,购自上海甲干生物实验动物有限责任公司,饲养于安徽医科大学实验动物中心。
1.1.2主要试剂和仪器 高糖DMEM、胎牛血清(美国Gibco公司);PBS缓冲液(美国Solarbio公司);胰蛋白酶、戊巴比妥钠(美国Sigma公司);β-TCP(上海贝奥路生物材料有限公司);BLB种植体(北京莱顿生物有限公司);Bio-Gide(瑞士Geistlich公司);种植机(奥地利W&H公司);CO2恒温恒湿孵育箱(美国Thermo公司);荧光倒置显微镜、倒置相差显微镜(德国Leica公司)。
1.2方法
1.2.1Al-BMSC和I-BMSC的原代获取与培养 Al-BMSC的培养:使用30 g/L的戊巴比妥溶液静脉注射麻醉拉布拉多犬6只,麻醉起效后,将拉布拉多犬固定于操作台,常规备皮、消毒,拔除双侧下颌前磨牙(第一前磨牙、第二前磨牙、第三前磨牙),从牙槽窝以及其周围区域使用咬骨钳获取牙槽骨的碎片共约3 g左右,放入含有PBS的离心管中,细胞房即刻培养。在超净工作台中,使用无菌PBS缓冲液轻轻冲洗下颌牙槽骨碎片,去除表面口腔唾液的污染。使用无菌器械仔细去除骨块外侧的皮质骨,只保留含有骨小梁的松质骨及包含的血液成分,修剪成2 mm×2 mm大小的碎片,置于含10%FBS的DMEM培养皿中,37 ℃、5% CO2的恒温恒湿孵育箱中进行培养。5~7 d后进行首次观察,换液,后每隔3 d细胞换液1次,倒置显微镜下观察细胞生长状态。I-BMSC的培养:另取2只拉布拉多犬,静脉注射麻醉,对犬的髂骨进行常规备皮消毒铺巾,使用骨髓穿刺针内接含肝素钠注射液的注射器,进行穿刺,抽取骨髓约3 ml注入无菌50 ml离心管,轻轻摇晃均匀,采用全骨髓贴壁法进行细胞培养,5 d后首次换液后每隔3 d细胞换液1次,倒置显微镜下观察细胞生长状态。当Al-BMSC和I-BMSC细胞生长融合至80%时,使用0.25%胰酶,挑选单个细胞克隆进行传代,选择生长状态良好的第3代细胞进行后续实验。
1.2.2构建种子细胞与支架材料复合物 高温高压消毒108块直径5 mm、厚度2 mm的β-TCP材料,浸泡于不含胎牛血清的DMEM中24 h,收集生长状态良好的第三代Al-BMSC与I-BMSC细胞,稀释混匀,以1×107个/ml浓度滴加于β-TCP中,在每片材料滴加100 μl细胞悬液,每片材料上的细胞数:1×107个/ml×0.1 ml=1×106个。恒温恒湿培养箱培养4 h后,加入含10%FBS的DMEM培养基继续培养,3 d后取部分样本于电子显微镜下观察材料表面细胞形态。
1.2.3犬下颌骨种植体近中临界骨缺损模型的建立与修复 拉布拉多犬前磨牙拔除后3个月,可以观察到拔牙区创口愈合良好,牙槽嵴平坦。使用30 g/L的戊巴比妥溶液静脉注射麻醉,麻醉起效后,将拉布拉多犬固定于操作台,常规备皮、消毒、铺巾。使用直径5 mm的环钻在下颌骨缺牙区制备临界骨缺损模型(5 mm×5 mm×6 mm,近远中径×颊舌径×深度),每个骨缺损中心间距为12 mm,一侧做3个标准的骨缺损。在每个骨缺损区域的远中进行种植窝洞的预备,按种植钻头逐级预备至3.5 mm,植入3枚BLB亲水性种植体,直径4.1 mm,长度10 mm,种植体的一侧壁暴露于骨缺损区。在创建的骨缺损区,分别植入β-TCP+Al-BMSC复合物(n=6),β-TCP+I-BMSC复合物(n=6)和单纯β-TCP(n=6),每个缺损区位点放入3块细胞材料复合物 (每个缺损位点细胞数:1×106×3=3×106个)。使用Bio-Gide覆盖骨缺损区,间断缝合创口。术后,每只实验动物肌肉注射青霉素(1.5万IU)2周,每3 d一次。
1.2.4序列荧光标记 术后第4周、第8周、第10周,使用30 g/L的戊巴比妥腹腔麻醉实验动物,在骨缺损区域分别注射盐酸四环素(TE,25 mg/kg)、钙黄绿素(CA,20 mg/kg)茜素红(AL,30 mg/kg)。
1.2.5组织学分析 术后第12周,处死实验动物,取拉布拉多犬下颌骨标本,置于5%中性福尔马林溶液中进行标本固定,梯度脱水,树脂包埋后,制备硬组织切片。使用激光共聚焦显微镜对标本进行荧光标记物的观察。螯合荧光激发/发射波长分别为405/560~590 nm (TE,黄), 488/500~550 nm (CA,绿), 和 543/580~670 nm (AL,红)。利用Image-Pro PlusTM图像分析软件分析各组术后8周、10周和12周的骨矿化情况。将进行荧光标记物分析的标本使用Van Gieson染色剂进行染色,检测各组骨形成情况。

2 结果
2.1种子细胞与支架材料复合后的观察复合物培养3 d后,取部分样本,清洗,4%多聚甲醛溶液固定,干燥,于扫描电子显微镜下观察细胞生长形态,可见Al-BMSC与I-BMSC在支架材料上较均匀分布,生长状态良好,见图1。

图1 扫描电镜下β-TCP上细胞生长情况
2.2序列荧光标记物分析激光共聚焦显微镜下观察可见,β-TCP+I-BMSC组、β-TCP+Al-BMSC 组和单纯 β-TCP组的荧光表达量不同:单纯 β-TCP组TE (黄色) 的表达量低于β-TCP+I-BMSC组和β-TCP+Al-BMSC 组,CA (绿色) 和AL (红色) 具有与TE (黄色) 相同的趋势,见图2A。使用Image-Pro PlusTM图像分析软件分析荧光表达面积并进行统计学处理后显示:单纯 β-TCP 组TE 的荧光表达量(1.32%±0.12%) 低于β-TCP+I-BMSC组 (5.12%±0.93%) 和β-TCP+Al-BMSC组 (9.12%±0.21%),差异有统计学意义 (P<0.05),β-TCP+Al-BMSC 组的TE表达量高于β-TCP+I-BMSC组,差异有统计学意义(P<0.05)。单纯β-TCP 组CA的荧光表达量 (2.51%±0.09%) 低于β-TCP+I-BMSC组 (12.52%±0.95%) 和β-TCP+Al-BMSC组 (12.48%±2.42%),差异有统计学意义(P<0.05),β-TCP+I-BMSC组与β-TCP+Al-BMSC组CA表达量之间的差异无统计学意义(P>0.05)。单纯β-TCP组AL的荧光表达量 (1.52%±0.08%) 低于β-TCP+I-BMSC组 (2.52%±0.12%) 和β-TCP+Al-BMSC组 (3.43%±0.13%),差异具有统计学意义 (P<0.05),β-TCP+I-BMSC组与β-TCP+Al-BMSC组AL表达量之间的差异无统计学意义 (P>0.05),见图2B。

图2 荧光标记组织学分析
A:连续荧光标记后不同时期荧光表达:TE (黄色),CA (绿色),AL (红色) ×63;B:各组荧光表达量的统计学分析;与单纯β-TCP组比较:*P<0.05;与β-TCP+I-BMSC组比较:#P<0.05
2.3硬组织切片VanGieson染色组织学分析普通正置显微镜下观察,可见各组骨缺损区域均有新骨形成。β-TCP组骨缺损处新骨形成较少,种植体表面仅有少量的新生骨结合。β-TCP+Al-BMSC组与β-TCP+I-BMSC组中,骨缺损区域有广泛的新骨形成,且已形成较为成熟的编织骨状态,种植体表面有大量的新骨结合。统计学结果显示,β-TCP+Al-BMSC组新骨形成面积为(21.51%±1.61%),β-TCP+I-BMSC组新骨面积为(29.82%±3.23%),β-TCP组的新骨形成面积为(9.93%±2.43%), β-TCP+Al-BMSC组和β-TCP+I-BMSC组的新骨形成面积均高于β-TCP组的新骨形成面积,差异有统计学意义(P<0.05),而β-TCP+Al-BMSC组与β-TCP+I-BMSC组新骨形成量差异无明显统计学意义(P>0.05)。 β-TCP+Al-BMSC组种植体周围骨结合率(0.61±0.07)与β-TCP+I-BMSC组种植体周围骨结合率 (0.87±0.04)均大于β-TCP组 (0.04±0.01),差异有统计学意义(F=394.82,P<0.05),而β-TCP+I-BMSC组骨结合率高于β-TCP+Al-BMSC组,差异具有统计学意义 (P<0.05),见图3。
3 讨论
牙种植体的植入和稳定依赖足够的颌骨骨量支持和有效的种植体骨结合。因肿瘤、外伤、牙周病等因素导致的上下颌骨骨组织缺损越来越常见,严重影响了牙种植体的有效植入。对于小范围的骨缺损,通过同期植入颗粒型小牛基质骨,结合骨组织自身的再生能力可在种植体植入的同时实现缺损骨修复。临界骨缺损,是指无法通过机体自身再生能力进行愈合的缺损,目前广泛认可的动物模型中骨缺损的临界尺寸为直径5 mm[10]。对于治疗临界骨缺损以及超过临界范围的严重骨缺损,自体骨移植是金标准,但自体骨的获取常常受到供体区骨量不足、供区二次损伤、手术疼痛增加等限制,因此,骨组织工程为修复较大骨缺损提供了新的治疗方式。
骨组织工程主要包括4个要素:种子细胞、生物材料、生长因子和血管化。随着组织工程学的发展,将种子细胞与支架材料复合后促进骨缺损修复,是骨组织工程学的热点之一[4]。而种子细胞的选择直接关系到最终的修复效果。I-BMSC具有较强的细胞增殖能力、优秀的分化潜能,是骨组织工程主要的种子细胞之一。Al-BMSC也具有较强的干细胞增殖分化能力,且取材方便,在拔牙或牙槽嵴修整手术同时即可获得足够量的牙槽骨,不会给患者造成二次创伤。大量研究[11]显示,I-BMSC与Al-BMSC均有较强的成骨分化能力。Lloyd et al[12]将迷你猪Al-BMSC与胫骨来源的BMSC同时使用FGF-2进行诱导培养,结果显示Al-BMSC的ALP活性高于胫骨来源的BMSC。Matsubara et al[9]利用成骨诱导培养液诱导培养犬Al-BMSC和I-BMSC后,Al-BMSC 组中ALP的活性与钙离子的含量均与I-BMSC组相近。Pekovits et al[13]将采集到的人Al-BMSC与I-BMSC使用成骨诱导液诱导2周后,Al-BMSC组与I-BMSC组间BGLAP (骨γ羧基谷氨酸蛋白) 与SPARC (富含半胱氨酸的酸性分泌蛋白) 基因表达水平无明显差异。
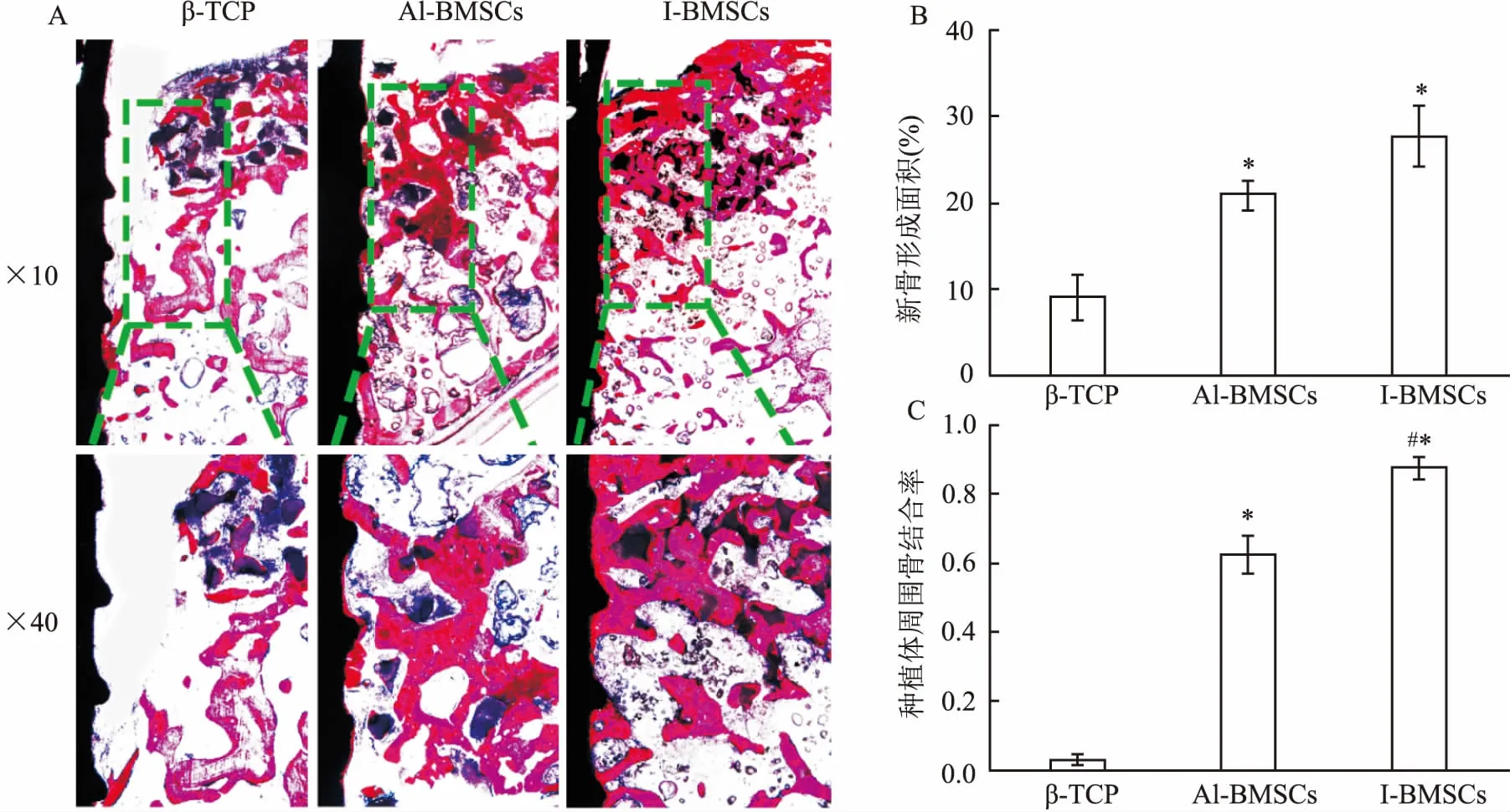
图3 术后12周Van Gieson染色组织学分析
A:Van Gieson染色后各组骨形成情况;B:统计学分析新骨形成面积;C:种植体周围骨结合率;与单纯β-TCP组比较:*P<0.05;与β-TCP+Al-BMSC组比较:#P<0.05
与上述实验结果类似,本课题组前期体外实验[11]显示,通过成骨诱导液骨向诱导犬Al-BMSC以及I-BMSC,诱导后第7天、第14天以及第21天提取细胞总RNA进行RT-PCR检测,结果显示,Al-BMSC组中ALP、COL-I以及OCN的基因表达略高于I-BMSC组,差异具有统计学意义(P<0.05)。但是,Al-BMSC与I-BMSC促进体内缺损骨再生的能力还未见相关报道。基于此,该研究对犬Al-BMSC和I-BMSC促进种植体近中临界骨缺损修复的能力以及与种植体实现骨结合的能力进行了比较研究。结果表明,犬Al-BMSC与I-BMSC均可促进下颌骨种植体近中临界骨缺损修复,在新骨形成能力方面,两者无明显差别,而I-BMSC可促进更多的骨质与种植体实现骨结合,这种差异可能源自于Al-BMSC的获取方式与I-BMSC不同。Al-BMSC的获取主要有两种方式:骨髓抽吸法和骨块培养法。骨髓抽吸法:Lloyd et al[12]通过 CT扫描和组织学检测发现,迷你猪下颌骨正中联合处近下颌骨下缘1/3处骨组织中含有丰富的松质骨,可使用穿刺针直接抽取获得下颌骨骨髓血,培养获得Al-BMSC。 Matsubara et al[9]直接使用穿刺针在比格犬下颌磨牙附近骨组织进行穿刺采集下颌骨骨髓血,培养获得Al-BMSC。骨块培养法:Pekovits et al[13]和Akintoye et al[14]将采集到的牙槽骨碎片直接培养在含有培养基的培养皿中,待细胞爬出增殖后传代。本课题组在获取犬原代Al-BMSC时,通过穿刺几乎抽取不到拉布拉多犬下颌骨骨髓血,为了获得犬Al-BMSC,本研究参考骨块培养法,用咬骨钳获取犬下颌骨磨牙处骨质,去除密致骨,保留松质骨和骨髓血进行体外培养,待细胞爬出结合挑克隆技术对细胞进行纯化,尽可能保证所获取细胞具有干细胞特性,但是难免少量牙槽骨成骨细胞混入,导致骨向分化能力不足,影响其与种植体实现骨结合。
