饲料β-葡聚糖和灭活乳酸菌的添加对泥鳅幼鱼生长性能、肠脂肪酸组成及免疫性能的影响
2019-01-07陈靖雯郭道远曹小娟
陈靖雯 郭道远 赵 冰 曹小娟 高 坚 ,
(1. 华中农业大学水产学院, 武汉 430070; 2. 武汉百科金典生物科技有限公司;3. 华中农业大学, 水产养殖国家级实验教学示范中心, 武汉 430070)
泥鳅(Misgurnus anguillicaudatus)是我国重要的小型淡水经济鱼类。由于其肉质鲜滑, 营养丰富,具有较高的药用价值, 素有“水中人参”的称号, 深受消费者喜爱。近几年, 泥鳅养殖业规模不断发展,高密度集约化养殖程度不断扩大, 养殖单位产量逐年提升。然而水产集约化养殖导致养殖环境的恶化, 各种应激胁迫因子增加, 鱼体质变弱免疫力下降, 养殖过程中鱼病频发[1]。虽然抗生素在水产养殖疾病防治中有较好的应用效果, 但是抗生素对人和动物所产生的一系列负面影响也频繁发生[2]。随着人们生活水平的日益提高, 对水产品的质量安全意识不断增强, 寻求其他安全有效的途径来提高水产养殖业的可持续发展显得刻不容缓。
近年来, 益生菌作为饲料添加剂可提高鱼类免疫, 在水产养殖业得到广泛的关注[3]。然而在饲料中活益生菌的添加可能会被引进到开放的水环境,引发人们对水产业新的担忧。灭活菌不会影响其他水生生物生存环境, 因此被逐渐应用于水产养殖过程中替代活菌制剂[4]。乳酸菌不耐受高温高压环境, 但是热灭活乳酸菌(HK-LP)能够抵抗饲料制粒过程中的高温高压[5]。在过去的研究中发现, 加热灭活的酪酸菌在鮸鱼(Miichthys miiuy)身上有明显的免疫调节性能[6]。加热灭活的创伤弧菌疫苗比福尔马林灭活的疫苗能更有效地引起牙鲆(Paralichthys olivaceus)的免疫应答[7]。灭活乳酸杆菌P-8对大菱鲆(Scophthatmus maximu)幼鱼血清生化指标和抗氧化能力有显著性影响[8]。
β-葡聚糖属于非淀粉多糖, 存在于酵母细胞壁和真菌的菌丝体中, 是一种具有增强免疫力的多糖[9]。酵母来源的β-葡聚糖因其免疫促进作用而被广泛应用于畜禽和水产动物饲料中。在鱼类中, β-葡聚糖不仅能够刺激巨噬细胞, 提高其杀灭病原菌的能力, 还可以提高鱼类非特异性免疫机制的其他因子,如溶菌酶和补体系统[10]。目前有研究表明, 在饲料中添加β-葡聚糖可以提高凡纳滨对虾(Litopenaeus vannamei)的增重率并有效地降低了饲料系数[11], 促进锦鲤(Cyprinus carpio)的生长性能[12], 提高南亚野鲮(Labeo rohita)的特定生长率[13], 提高海参(Apostihopus japonicus)抗灿烂弧菌(Vibrio splendidus)的能力[14]以及提高花鲈(Lateolabrax japonicus)增重率、免疫性能和抗氨氮应激能力[15]。
同时, 有研究表明BG和HK-LP具有一定的相互作用, Dawood等[16]发现BG和HK-LP的相互作用显著影响了真鲷(Pagrus major)幼鱼的表观消化率及血液中相关的生理生化指标。关于饲料添加BG和HK-LP对泥鳅生长、免疫性能影响的研究还鲜有报道。因此, 本研究以泥鳅为实验对象, 在饲料中添加不同水平BG和HK-LP, 研究对泥鳅幼鱼生长性能、肠道脂肪酸组成, 免疫相关酶活性和基因表达的影响, 确定BG和HK-LP在泥鳅饲料中的最佳添加量, 为泥鳅专用饲料研制提供参考。
1 材料与方法
1.1 实验设计及实验饲料配制
泥鳅饲料配方设计参照Gao等[17]。以脱脂鱼粉、大豆浓缩蛋白及酪蛋白为主要蛋白源; 阿尔法淀粉为糖源, 鱼油、大豆油和大豆卵磷脂为脂肪源。实验设计为双因素实验设计, 即在基础饲料中分别添加0和0.1% β-葡聚糖, 在此基础上再分别添加0.025%、0.05%和0.1%的灭活乳酸杆菌, 热灭活植物乳酸杆菌购于Bioforte Biotechnology Corp (中国深圳)。微粒子饲料(0.1—0.3 mm)的制作方法参照Gao等[18]。制作后的饲料放入密封袋中, 于-20℃冰箱中保存待用。饲料营养成分见表 1。
1.2 实验鱼及投喂实验
实验用泥鳅幼鱼在本实验室繁殖获得, 具体方法参照Gao等[18]。饲养实验在华中农业大学水产学院养鱼房的流水养殖系统中进行。在开始正式实验前, 泥鳅幼鱼暂养2周。实验开始时, 实验鱼饥饿24h, 然后称取鱼体质量(平均初始体质量约为0.17 g),并挑选出规格一致的泥鳅进行分组实验, 在18个流水养殖系统中进行, 养殖箱体积为50 L (80 cm×40 cm×50 cm), 水体积为40 L, 放养密度为50尾/箱,水流为1 L/min, 每种饲料随机投喂3组实验鱼。每天饱食投喂3次(09:00、13:00和20:00)。养殖周期80d。每天记录投饲量, 如有死鱼记录数量并称重。实验期间水体温度在26—28℃, 溶氧保持>5 mg/L。
1.3 样品采集
在80d养殖实验结束后, 禁食24h, 对每个水箱的鱼进行称重和计数, 用于计算增重率、特定生长率、存活率等指标。从每个水箱中随机抽取10尾鱼取体表黏液用于免疫活性检测[19]; 另取10尾鱼解剖取肠道, 用于脂肪酸组成分析; 再另取10尾鱼解剖取内脏, 用作免疫相关基因表达水平的测定。免疫活性检测的黏液样品采集后立即开始, 用于肠道脂肪酸组成分析及基因表达分析样品分别混合后冻存于-80℃。
1.4 营养组成分析
实验饲料的常规营养分析参照AOAC[20]的方法进行: 水分含量测定采用105℃烘干法, 粗蛋白含量测定采用凯氏定氮法, 粗灰分含量测定用马福炉550℃灼烧法。实验饲料和全鱼体的全脂肪含量分析参照Bligh和Dyer[21]的方法进行。
1.5 肠道脂肪酸组成分析
从实验鱼肠道提取的总脂肪经过皂化后, 采用气相色谱(Agilent Technologies Inc., Santa Clara,California, USA; column: OmegawaxTM320)对样品脂肪酸组成进行分析, 方法参照Li等[22]所述。
1.6 免疫相关酶活性检测
按照南京建成生物工程研究所生产的试剂盒所示要求和操作, 进行体表黏液中蛋白浓度的测定并采用酶促反应速度的方法检测溶菌酶(LZM)、酸性磷酸酶(ACP)及碱性磷酸酶(AKP)的活性。
1.7 荧光实时定量PCR检测免疫相关基因表达
提取各实验组泥鳅肝脏中RNA以液氮为介质,在研钵中将组织研磨成粉末状, 按照RNAiso Plus说明书提取并纯化总RNA。琼脂糖凝胶电泳法检测其完整性, 超微量分光光度计法检测其浓度和纯度。参照逆转录试剂盒(TaKaRa, China)说明进行反转录。实时定量检测利用Mini Option实时定量PCR检测系统 ( Bio-Rad, USA) 进行, 反应体系为10 μL∶0.4 μL 10 mmol /μL的上下游引物、1 μL逆转录产物、5 μL 2 ×SYBR Premix ExTaqTMⅡ S、3.2 μL灭菌水。根据本实验泥鳅转录组数据获得泥鳅Hsp70、Hsp90α和Tlr1基因序列, 用Primer premier 5 设计实时定量PCR特异引物(表 2)。反应条件为 95℃, 10s; 95℃, 15s; 60℃, 15s; 40个循环。根据扩增曲线得到的Ct值(荧光信号达到设定的阈值时所经历的循环数), 计算出目标基因和对照基因βactin和Gapdh Ct值的差异ΔCt; 以差异最大的样本作为参照样本, 计算出不同样品相对于参照样本的基因表达倍数2-ΔΔCt, 从而制作出相对定量的图表。

表 1 实验用饲料配方及营养组成Tab. 1 Formulation and proximate composition of the experimental diets (%)

表 2 荧光实时定量PCR引物Tab. 2 Nucleotide sequences of the primers for reverse transcription polymerase chain reaction (RT-PCR).
1.8 相关指标计算公式
数据采用SPSS19.0 统计软件进行处理, 所有实验组(2因素3水平, 2×3)进行双因素方差分析(Twoway ANOVA)的基础上, One-way ANOVA方差分析和Duncan' s均值多重比较法对试验结果差异显著性进行分析处理。P<0.05, 认为差异显著 。统计结果以平均值±标准差(Mean±SD)的形式表示。
2 结果
2.1 生长性能
通过双因素方差分析, 饲料添加BG或HKLP分别显著调高了泥鳅幼鱼的最终均重, 增重率和特定生长率, 显著减低了饲料系数(P<0.05), 但是BG和HK-LP的相互作用对各实验组泥鳅幼鱼的终末体重、增重率、特定成长率和存活率皆无显著性差异(表 3)。与BG0/HK-LP0.025组相比较,BG1/HK-LP0.1组的最终均重、增重率、特定生长率和饲料系数出现显著差异(P<0.05)。在BG同等添加情况下, HK-LP的添加量为0.1%时与添加量为0.025%和0.05%的两个实验组在最终均重、增重率及特定生长率表现出显著上升(P<0.05), 而在饲料系数显示为无显著差异。
2.2 泥鳅幼鱼肠道脂肪酸组成分析
泥鳅肠道脂肪酸组成见表 4。结果显示饲料中添加BG和HK-LP两者之间的相互作用对泥鳅肠道内的脂肪酸组成无显著性影响。但是添加1.0%BG饲料显著降低了泥鳅肠道C16∶1n-7、C18∶2n-6以及总n-6系脂肪酸的比率。随着HK-LP添加量的升高显著降低了C22∶ 1n-11的比率(P<0.05)。
2.3 泥鳅幼鱼皮肤黏液中免疫相关酶表达情况分析
各组实验泥鳅幼鱼皮肤黏液中LZM、ACP、AKP三种免疫相关酶进行酶活性结果见图 1。BG、HK-LP及两因素的相互作用显著影响了体表黏液中AKP活性(P<0.05), 随着HK-LP的添加浓度增加, AKP活性显著增强。然而添加1%BG与不添加组相比, AKP活性出现显著降低趋势。而HKLP显著影响了LZM活性(P<0.05), 且LZM的活性随HK-LP的浓度上升而增强。
2.4 泥鳅幼鱼肝脏中免疫相关基因表达变化
添加BG及HK-LP显著影响了泥鳅肝脏免疫相关基因的表达水平(图 2)。当饲料中添加1%BG和0.05%HK-LP显著上调了Hsp70及Hsp90α表达水平。双因素方差分析表明: BG的添加显著降低了Tlr1基因表达水平(P<0.05)。
3 讨论
在本研究中, 经过80d饲喂后, 饲料中添加了BG和HK-LP显著降低了饲料系数, 提高了泥鳅幼鱼的增重率、特定成长率及最终均重。这表明2种添加物质均能够有效地改善泥鳅幼鱼的生长性能。同样结果也发现在其他鱼种, 陈超然等[23]在异育银鲫(Carassius auratus gibelio)的研究中发现, 饲料中添加一定量的BG提高了其增重率。在迟淑艳等[24]的研究中也发现, 在奥尼罗非鱼(Oreochromis aureus ♂ × O. niloticus♀)中添加1.0%—1.5%的BG能够显著改善其生长性能以及抗嗜水气单胞菌侵染的免疫能力。HK-LP常作为饲料添加剂, 通过定殖于生物体胃肠道等部位后大量繁殖, 可抑制病原菌的生长, 产生维生素和促进生长因子等物质,增加机体对饲料的消化和吸收, 提高生长与成活[25]。斜带石斑鱼(Epinephelus coiodes)摄食添加一定量的植物乳酸杆菌的饲料4周后, 增重率显著高于对照组[26]。
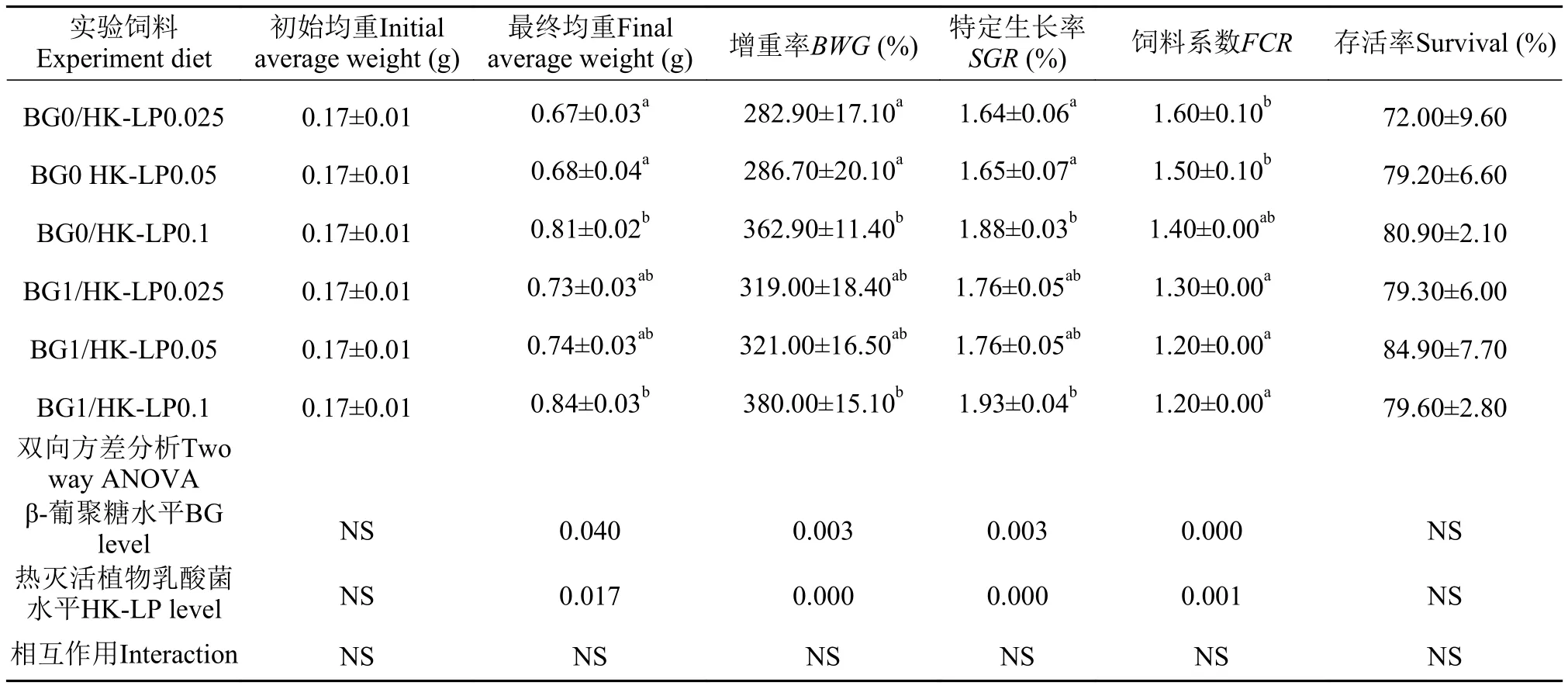
表 3 喂养实验饲料80d后对各实验组泥鳅幼鱼生长性能的影响Tab. 3 Growth performance of juvenile loach fed with test diets for 80 days*

表 4 饲养实验80d后泥鳅幼鱼肠道脂肪酸组成Tab. 4 Fatty acid composition (% of total fatty acids) in intestine of loach after 80 days

图 1 泥鳅体表黏液中酸性磷酸酶、碱性磷酸酶及血清溶菌的活性(U/mg prot), 数据为取样测得的平均值Fig. 1 The activities of alkaline phosphatase (AKP), acid phosphatase (ACP), lysozyme (LZM) (U/mg protein) in skin mucus of loach

图 2 肝脏中Hsp70, Tlr1和Hsp90α的表达情况Fig. 2 Relative mRNA expression levels of Hsp70, Tlr1 and Hsp90α gene in liver of loach
在我们之前的研究中发现, 饲料中添加适量BG改变了泥鳅肠道微生物菌群, 进而降低了泥鳅脂肪的沉积[27], 表明肠道菌群与鱼体脂肪吸收和代谢密切相关。在本研究中发现, 饲料中添加BG显著减低了泥鳅肠道C16∶1n-7及C18∶2n-6的比率, 这可能是因为添加BG改变了肠道微生物菌群, 而影响了肠道对饲料脂肪酸的吸收和转运, 从而影响了肠道脂肪酸组成。
BG是一种不能被动物肠道自然消化的碳水化合物, 通常与益生菌一起使用, 通过调节肠道微生态和刺激免疫系统来促进生物长期健康生长。在Dawood等[16]对真鲷的研究中则发现, 饲料中添加HK-LP和BG的相互作用影响了真鲷非特异性免疫活性。本研究结果也发现了, 在不添加BG组随着HK-LP添加量的增加, ACP呈现下降趋势, 而在BG添加组随着HK-LP添加量的增加, ACP呈现出升高的趋势。这表明了饲料BG可影响HK-LP对泥鳅体表黏液中的ACP活性。LZM广泛存在于鱼类各种体液、血清和巨噬细胞中的一种水解酶, 是生物机体在免疫反应过程中分泌的具有溶解细菌作用的非特异性免疫因子。LZM活性是决定吞噬细胞能否杀灭所吞噬的致病菌的物质基础之一[28]。在本研究中, 随着BG和HK-LP添加量的增加,LZM活性出现上升, 且1%BG和0.1%HK-LP组显著高于其他实验组, 表明了饲料添加1%BG和0.1%HKLP对泥鳅非特异性免疫具有良好的添加效果。
热应激蛋白(Heat shock protein, HSP)是细胞在应激刺激下生成的一组蛋白质, 对胁迫环境的应答等起到了重要作用[29]。Hsp70和Hsp90α是HSP家族的重要成员,Hsp70对于应激条件可产生耐受和保护作用, 具有高度保守和交叉耐受性[30], 而Hsp90α通过和抗原的结合, 参与免疫反应, 向免疫细胞提呈抗原肽[31]。在本研究中, 以β-actin和Gapdh作为双内参基因检测泥鳅肝脏组织中Hsp70,Hsp90α和T l r1的相对表达量。当饲料添加1%B G和0.05%HK-LP时, 泥鳅肝脏Hsp70和Hsp90α表达水平显著高于其他实验组, 表明了1%BG和0.05%HKLP的添加对泥鳅产生了应激反应, 激发了泥鳅肝脏中热应激蛋白的保护作用。Toll样受体(Tlr1)是胚系编码的模式识别受体, 来识别病原相关分子模式。在本实验中, 在无添加BG组, 随着HK-LP添加量的增加, 上调了Tlr1表达水平, 这可能是因为添加HK-LP, 诱发了泥鳅对病原体的识别系统。而当饲料中添加1%BG时, 添加HK-LP没有对Tlr1产生影响, 关于BG对Tlr1表达水平的影响还需进一步研究。
综上所述, 本研究结果表明, 饲料添加BG和HK-LP可改善泥鳅幼鱼的生长及免疫性能, 影响了肠道脂肪酸组成, 激发了泥鳅Hsp70、Hsp90α及Tlr1基因的表达水平。因此, 在泥鳅养殖过程中BG和HK-LP可作为有效的饲料免疫增强剂, 在泥鳅幼鱼饲料中的最适添加量为: BG 1%和HK-LP 0.1%。
