东北七鳃鳗TRAF6基因克隆、表达分析及亚细胞定位研究
2019-01-07丁少青周泽斌王雅倩何缘圆任建峰李伟明张庆华
丁少青 周泽斌 王雅倩 罗 鑫 何缘圆 任建峰 李伟明 张庆华
(1. 上海海洋大学水产种质资源发掘与利用教育部重点实验室, 上海 201306; 2. 上海海洋大学中国科学技术部海洋生物科学
国际联合研究中心, 上海 201306; 3. 上海海洋大学国家水生动物病原库, 上海 201306;4. 密歇根州立大学渔业与野生生物系, 东兰辛, 密歇根, 美国 48824)
高等脊椎动物如哺乳类和鸟类主要依靠适应性免疫系统抵御病原菌的入侵, 而昆虫和低等脊椎动物(鱼类和两栖类)主要依靠反应速度更快、非特异性的先天免疫系统[1,2]。先天免疫系统是机体抵御病原微生物入侵的第一道防线, 依靠细胞表面表达的模式识别受体(Pattern-recognition receptors,PRRs)来识别病原相关分子模式(Pathogen-associated molecular patterns, PAMPs)。Toll样受体(Tolllike receptors, TLRs)作为重要的模式识别受体, 能够识别保守的PAMPs并触发信号通路, 在先天免疫系统中发挥重要作用[3]。
在TLRs识别PAMPs后, 募集接头蛋白髓样分化因子88 (Myeloid differentiation factor 88, MyD 88), 其死亡结构域与白介素1受体相关激酶4 (IL-1R associated kinase 4, IRAK4)的死亡结构域相互作用, 然后IRAK4将IRAK1募集到复合物中, 导致其磷酸化和活化[4]。接着IRAK1和IRAK4从复合物中解离出来并与肿瘤坏死因子受体相关因子6 (Tumor necrosis factor receptor-associated factor 6,TRAF6)相互作用[5]。信号经过传导, 最终激活核因子-κB (Nuclear factor kappa B, NF-κB)和丝裂原激活蛋白激酶(Mitogen-activated protein kinases, MAPKs)[6]。TRAF6在脊椎动物和无脊椎动物中也相继被发现, 如鲤(Cyprinus carpio)[7]、斑马鱼(Daniorerio)[8,9]、草鱼(Ctenopharyngodon idella)[10]、栉孔扇贝(Chlamys farreri)[11]、虾夷扇贝(Mizuhopecten yessoensis)[12]、凡纳滨对虾(Litopenaeus vannamei)[13]以及刺参(Apostichopus japonicus)[14]等。TRAF6除了介导免疫信号传导外, 还在各种生理过程中发挥重要作用, 例如破骨细胞形成, 树突状细胞、皮肤附属组织和乳腺的发育, 淋巴结的形成以及中枢神经系统的发育等[15—21]。
七鳃鳗(Lamprey)属于圆口纲(Cyclostomata),七鳃鳗目(Petromyzoniformes), 七鳃鳗科(Petromyzontidae), 是一种古老的无颌类动物, 在进化上处于无脊椎动物和脊椎动物之间, 对其免疫系统的研究有着重要的进化意义。与高等脊椎动物相比, 七鳃鳗没有完整的胸腺, 其类淋巴细胞中尚未分化出T淋巴细胞和B淋巴细胞[22,23], 其免疫应答模式落后于硬骨鱼(具有部分或完整的获得性免疫), 是研究免疫系统进化的一个良好模型。本研究首次克隆东北七鳃鳗(Lethenteron morii)TRAF6基因的cDNA全长序列, 分析了其在不同生长阶段各组织中的组成型表达和病原菌感染后的诱导表达, 以及在HEK293T细胞中的定位情况, 为TRAF6基因在免疫系统中的进化及功能的研究提供理论依据。
1 材料与方法
1.1 实验材料
健康东北七鳃鳗取自辽宁省丹东市鸭绿江支流, 暂养期间养殖水温保持在(8±1)℃。幼鱼体长(11.5±0.8) cm, 体重(5.2±0.6) g, 成鱼体长(30.1±3.2) cm, 体重(36.1±2.1) g。铜绿假单胞菌(Pseudomonas aeruginosa) PA11株是本实验室分离自患病东北七鳃鳗, 保存于-80℃冰箱。
1.2 试剂
DNA聚合酶、限制性内切酶、DNA Marker、克隆载体pMD19-T、PrimeScriptTMRT reagent Kit with gDNA Eraser等购买于TaKaRa公司; Lipofectamine®2000、Trizol购买于Invitrogen公司; PCR产物回收试剂盒、普通琼脂糖凝胶DNA回收试剂盒、质粒小提试剂盒、感受态细菌DH5α购买于北京天根生物科技有限公司; LightCycler 480 SYBR Green I Master购买于Roche公司; Hoechst 33342购自于Solarbio公司, LB培养基、甘油、乙醇等其他药品购买于上海生工生物工程技术有限公司。
1.3 RNA提取及cDNA合成
分别选取3尾健康东北七鳃鳗的幼鱼和成鱼,取脑、肠、心、鳃、肝、肌肉、肾、脂肪体和皮肤等9个组织。利用Trizol法提取总RNA, 并用1%琼脂糖凝胶电泳和NanoDrop 2000分光光度计检测其浓度和质量, 然后保存于-80℃冰箱。攻毒组以500 μL/100 g剂量, 浓度为1.96×106CFU/mL铜绿假单胞菌对东北七鳃鳗成鱼进行腹腔注射, 分别于注射后0、6h、12h、24h、48h和72h取脂肪体、鳃、肠、肾等组织提取RNA, 检测浓度和质量后保存于-80℃冰箱。用PrimeScriptTMRT reagent Kit with gDNA Eraser试剂盒进行反转录, 实际操作根据试剂盒说明书进行。
1.4 TRAF6基因引物设计与PCR扩增
根据已有的日本七鳃鳗和海七鳃鳗转录组和基因组数据, 通过生物信息学方法初步筛选到TRAF6的mRNA序列以及DNA序列, 然后根据七鳃鳗物种间基因的高度保守性设计引物, 其中TRAF6-F1/R1是在该基因的5′端和3′端设计的, 得到包含5′UTR和3′UTR的全长序列; 为获得更长的TRAF6基因的3′端序列, 设计了3′端分段扩增的引物TRAF6-F2/R2和TRAF6-F3/R3。并由上海生工生物技术有限公司合成(表 1)。以东北七鳃鳗的肌肉、鳃、肠等混合cDNA为模板进行PCR扩增, 25 μL PCR体系如下: Premix 12.5 μL, ddH2O 9.5 μL, 上游引物1 μL, 下游引物1 μL, cDNA模板1 μL。反应条件如下: 98℃预变性2min, 98℃变性30s, 58℃退火30s, 72℃延伸1min, 共35个循环; 72℃延伸5min,12℃保存。PCR产物用2%的琼脂糖凝胶电泳检测,切胶纯化回收目的片段, 然后将产物与pMD19-T载体连接, 并转化至DH5α中, 氨苄抗性平板筛选阳性克隆并进行菌液PCR鉴定, 最后送往上海生工生物技术有限公司测序。
1.5 TRAF6基因序列分析
利用NCBI (http://www.ncbi.nlm.nih.gov/BLAST)的BLASTP工具进行同源基因序列的查找,利用Getorf软件(http://emboss.bioinformatics.nl/cgibin/emboss/getorf)预测开放阅读框, 利用ExPASy(http://web.expasy.org/protparam/)软件预测蛋白分子量及等电点, 利用SMART (http://www.cbs.dtu.dk/services/TMHMM-2.0/)和PROSITE (https://prosite.expasy.org/)软件预测和分析蛋白结构域。利用PSORT II (https://psort.hgc.jp/form2.html)软件预测亚细胞定位。利用DNAMAN6.0进行氨基酸序列比对以及MEGA7.0软件中的邻接法(Neighbor-joining)构建系统进化树。
1.6 TRAF6基因组织表达分析
利用实时荧光定量方法(qPCR)检测TRAF6基因在东北七鳃鳗幼鱼和成鱼不同组织中的表达, 以β-actin基因做为内参基因。TRAF6特异性引物为TRAF6-qF和TRAF6-qR;β-actin特异性引物为βactin-qF和β-actin-qR (表 1)。在LightCycler 480 II荧光定量PCR仪上进行qPCR反应。反应体系为:Master Mix 10 μL, ddH2O 7 μL, 上游引物1 μL, 下游引物1 μL, cDNA 1 μL; 反应条件为: 50℃ 2min,95℃ 10min; 95℃ 10s, 60℃ 30s, 40个循环; 95℃30s, 60℃ 30s, 40℃ 30s。每个样品3个重复, 阴性对照设置3个无cDNA模板的样品, 用2-ΔΔCt法计算相对表达量, 实验结果用平均值±标准误(Mean±SEM)表示, 图形制作及数据分析由GraphPad Prism 5软件完成,P<0.05表示具有显著性差异。
1.7 TRAF6基因在铜绿假单胞菌感染后的组织表达分析
检测脂肪体、鳃、肠、肾等组织中TRAF6基因在不同时间点的表达变化, 分析TRAF6基因在细菌感染后的相对表达量。所用定量引物和分析方法同1.6。
1.8 TRAF6基因细胞定位
pEGFP-TRAF6重组质粒构建使用本实验室保存的绿色荧光蛋白质粒pEGFP-N1, 用含有酶切位点的引物(表 1)扩增去掉终止密码子(TGA)的TRAF6基因, 经HindⅢ和BamHⅠ双酶切后, 通过T4连接酶将其连接至pEGFP-N1真核表达载体。将连接产物转化至感受态DH5α中, 挑选阳性克隆, 并通过双酶切鉴定。
(3)资金使用绩效有待提高。部分项目实施单位对项目资金使用绩效管理工作认识不足,现阶段监管制度也不够完善,导致“重争取、轻绩效”,“重分配、轻管理”的现象仍然存在,造成部分项目资金使用没有达到预期绩效目标。
pEGFP-TRAF6转染HEK293T细胞转染前24h将细胞接种于6孔板, 融合率达到80%时进行转染。设置pEGFP-N1为空载对照, 转染12h后换液,48h后用Hoechst 33342进行细胞核染色, Olymapus显微镜进行荧光拍照。
2 结果
2.1 东北七鳃鳗TRAF6基因序列分析
LmTRAF6的cDNA全长为2751 bp, 包含127 bp的5′端非编码区、1785 bp的开放阅读框(ORF)和839 bp的3′端非编码区, 共编码594个氨基酸, 具有典型的AATAAA加A尾信号。其相对分子质量为65.596 kD, 理论等电点(Isoelecric point)为6.25。序列提交至GenBank获得的登录号为MH016957。SMART和InterProScan软件预测分析了TRAF6的蛋白结构域, 结果表明该蛋白包含了4个结构域: N端的RING结构域(65—103 aa)、2个锌指结构域(146—187 aa、199—248 aa)、C端的环-环(Coiled-coil)α螺旋结构域(352—388 aa)以及TRAF同源结构域MATH (392—543 aa)。PSORT II软件预测分析了Lm-TRAF6的亚细胞定位情况, 结果发现, 该蛋白位于细胞核的概率为47.8%, 位于细胞质的概率为30.4%, 位于高尔基体、分泌系统小囊泡的概率均为4.3%。
2.2 东北七鳃鳗TRAF6氨基酸序列的同源性及系统进化树分析
将LmTRAF6的氨基酸序列与其他物种的同源序列进行比对分析, LmTRAF6的氨基酸序列与其他物种的一致性(Identity)均在43%—48%, 其中与美丽硬仆骨舌鱼(Scleropages formosus)(KPP69926.1)和矛尾鱼(Latimeria chalumnae)(XP_005987021.2)的一致性最高, 均达到48%。与人(Homo sapiens)(NP_665802.1)、小鼠(Mus musculus)(NP_001290202.1)的一致性分别为43%和45%。利用16个物种的TRAF6氨基酸序列构建系统进化树表明, 哺乳类、鸟类、爬行类和两栖类TRAF6聚为一大支, 硬骨鱼类TRAF6聚为一大支, 东北七鳃鳗又与这两支聚为一大支(图 1)。
2.3 东北七鳃鳗TRAF6基因的组织表达分析
东北七鳃鳗TRAF6基因的正常组织表达分析幼鱼的TRAF6基因在心脏、脑、皮肤、肌肉、鳃、肠、肝、肾和脂肪体(Supraneural body,SN)中均有表达, 其中在心脏、皮肤、鳃和肝中的表达量相对较高, 而在肠中的表达量相对较低。成鱼的TRAF6基因在上述组织中均有表达, 其中在肾、鳃和肌肉中的表达量相对较高, 而在心脏中的表达量相对较低(图 2)。
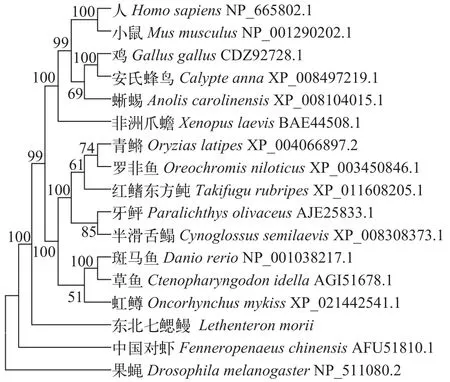
图 1 NJ法构建LmTRAF6氨基酸系统进化树Fig. 1 Phylogenetic tree constructed from LmTRAF6 amino acid with Neighbor-joining method
东北七鳃鳗TRAF6基因在铜绿假单胞菌感染后在成鱼组织的表达分析成鱼的鳃、肠和肾组织中TRAF6基因表达量在铜绿假单胞菌感染24h后显著升高, 且与对照相比差异显著(P<0.05);随着时间的增加TRAF6基因的表达量逐渐下降并趋于稳定。而脂肪体组织中TRAF6基因表达量在铜绿假单胞菌感染12h后有所升高但差异不显著(P>0.05)(图 3)。
2.4 东北七鳃鳗TRAF6基因的细胞定位
经酶切鉴定, 成功构建表达绿色荧光蛋白和目的基因融合蛋白(pEGFP-TRAF6)的重组质粒(图4A),将pEGFP-TRAF6重组质粒转染HEK293T细胞。结果表明, pEGFP-TRAF6的表达与pEGFP-N1类似, 在细胞质和细胞核中均有表达(图 4B)。
3 讨论
3.1 LmTRAF6生物信息学分析
3.2 LmTRAF6的组织表达分析
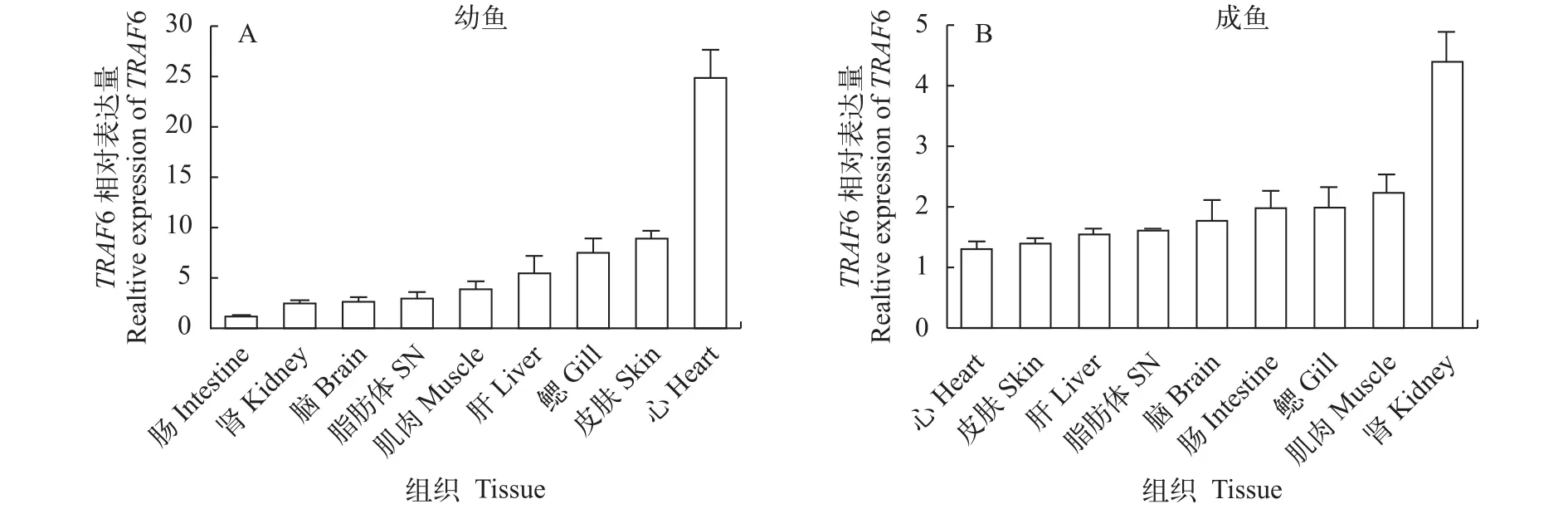
图 2 LmTRAF6基因在幼鱼和成鱼不同组织中的相对表达量Fig. 2 Relative expression of LmTRAF6 in difference tissues between juvenile and adult
本研究表明,LmTRAF6基因在检测的各个组织中均有表达, 与其他鱼类中TRAF6基因的表达对比,发现不同物种的组织表达图谱并不完全一致。TRAF6在斑马鱼的鳃组织中[9], 在鲤的肝和鳃组织中[7], 在麦瑞加拉鲮(Cirrhinus mrigala)的肾组织中[31], 在草鱼的头肾组织中[10]表达量最高, 而在巨石斑鱼(Epinephelus tauvina)的肠和胃组织中表达量较高[32]。本研究表明, 幼鱼在免疫相关组织(皮肤、鳃、肝、肾)中表达量较高, 在肠、脑等组织中表达量较低。成鱼在免疫相关组织(肾、鳃、肠)中表达量较高, 在心脏、皮肤、肝、脂肪体等组织中表达量较低。在不同鱼类中TRAF6在各种组织中不同的表达模式可能是因为物种差异以及不同的发育阶段造成的。在本实验中东北七鳃鳗幼鱼主要以吸食其他鱼类血肉为食物, 正处在生长发育的旺盛阶段; 而成鱼处于绝食状态, 正处在繁殖期。这可能是幼鱼和成鱼TRAF6基因表达量产生差异的原因之一。LmTRAF6基因的广泛表达表明其在宿主各组织中的免疫监视系统中发挥重要作用。一旦病原体侵入, 宿主就可以通过TRAF6介导的TLR信号通路等触发免疫应答反应。
3.3 LmTRAF6参与抗细菌感染的免疫应答
在鱼类上的研究表明,TRAF6广泛参与到TLR信号通路对细菌、病毒、寄生虫引起的免疫应答中。例如, 草鱼在被多子小瓜虫(Ichthyophthirius multifiliis)感染后,TRAF6表达量显著上调3.0—5.4倍[10]。斑马鱼在被乌鳢弹状病毒(Snakehead rhabdovirus, SHRV)和迟缓爱德华菌(Edwardsiella tarda)感染后,TRAF6表达量分别上调3.6—4.5倍和0.8—10.3倍[9]。斜带石斑鱼(Epinephelus coioides)在刺激隐核虫(Cryptocaryon irritans)感染后,TRAF6表达量上调3.0—7.0倍[33]。本研究表明,LmTRAF6可以被细菌诱导表达, 在成鱼的免疫器官如肠、肾和鳃中, 在铜绿假单胞菌感染24h后表达量显著上调, 分别上调1.7、2.4和3.6倍。相比于其他鱼类受到感染后TRAF6的表达情况, 本实验中东北七鳃鳗在铜绿假单胞菌感染后, 各免疫器官中TRAF6基因上调倍数相对较低, 可能与实验物种此时处于绝食产卵期, 机体的免疫力相对较弱有关, 因此对细菌感染的应答反应较弱, 或者与病原的种类有关。另外, 这也说明了七鳃鳗做为低等的无颌类脊椎动物,其免疫应答模式可能不同于其他鱼类。
3.4 LmTRAF6亚细胞定位分析
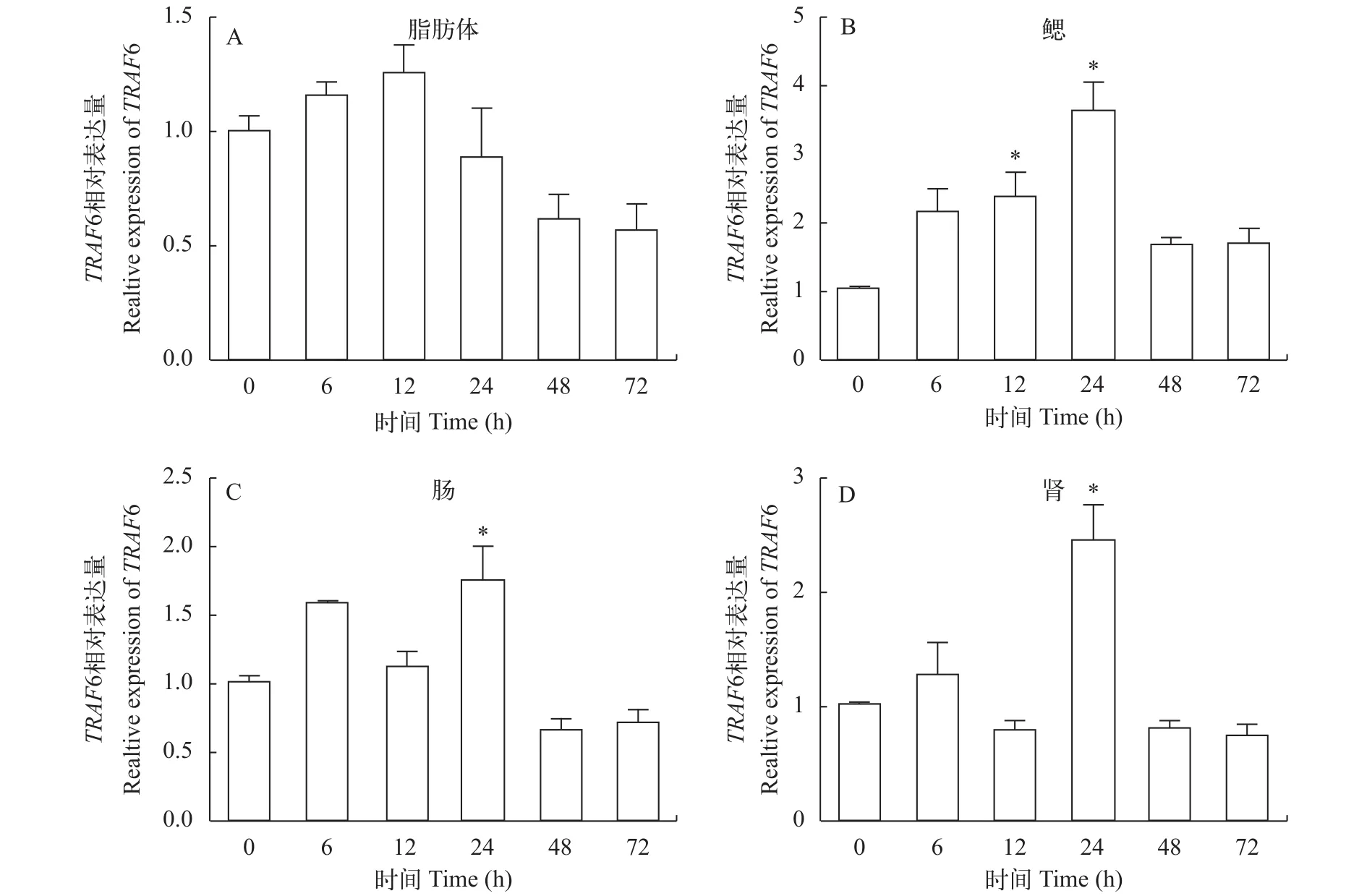
图 3 铜绿假单胞菌感染后LmTRAF6基因在成鱼各组织的表达量变化Fig. 3 LmTRAF6 expression in adult lamprey tissues challenged by P. aeruginosa
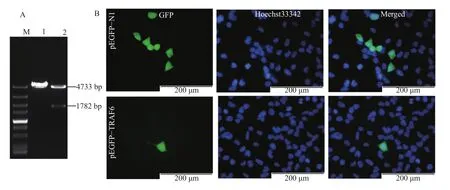
图 4 pEGFP-TRAF6重组质粒的双酶切鉴定(A)和pEGFP-TRAF6在HEK293T细胞中的定位(B)Fig. 4 Identification of pEGFP-TRAF6 recombinant plasmid (A) and intracellular localization of pEGFP-TRAF6 in HEK293T (B)
TLR信号通路中关键分子的定位对于理解蛋白质功能和分子机制具有重要作用[34]。本研究显示, pEGFP-TRAF6定位在细胞质和细胞核中, 与生物信息学分析结果一致。TRAF6在细胞质中的定位在人类中已有报道, TLR受到白细胞介素-1(Interleukin-1, IL-1)刺激后, IRAK在膜上与TRAF6形成复合物, 之后TRAF6解离, 从膜上转位到细胞质中, 在胞质中形成TRAF6-TAK1-TAB 1-TAB 2复合物, TAK1被活化, 接着TAK1、TAB 1、TAB 2磷酸化, 最终激活NF-κB和c-Jun氨基末端激酶(c-Jun N-terminal kinase, JNK)[35]。TRAF6不仅存在于细胞质中, 在正常和恶性B淋巴细胞的细胞核中也有定位[36,37], TRAF6与原癌基因c-myb(Proto-oncogene c-Myb)5′端的启动子相互作用, 负向调节B淋巴细胞核中的c-myb, 以维持细胞稳态和免疫监视[37]。
本研究克隆了东北七鳃鳗TRAF6基因的cDNA全长, 该基因与哺乳类和鱼类相比, 具有相似的结构域。LmTRAF6在检测的各组织中均有表达, 铜绿假单胞菌感染后表达量发生显著上调。这些结果表明LmTRAF6可能参与到细菌引起的免疫应答, 但LmTRAF6对细菌做出免疫应答的机制以及生物学功能有待进一步研究。
