虹鳟Fc受体FcγR的α和γ亚基基因的克隆及表达分析
2019-01-07张旭杰张永安
王 鹏 张 弩 张旭杰 张永安
(1. 中国科学院水生生物研究所淡水生态与生物技术国家重点实验室, 武汉 430072; 2. 中国科学院大学, 北京 100049;3. 西北工业大学生命学院, 西安 710072; 4. 华中农业大学水产学院, 武汉 430070)
Fc受体(Fc receptor, FcR)是一种表达在免疫细胞膜表面的免疫球蛋白超家族(Immunoglobulins superfamily, IgSF)成员, 它在免疫系统中起着联系体液免疫和细胞免疫的作用[1], 其中包括传统的FcR、多聚免疫球蛋白受体(Polymeric immunoglobulin receptor, pIgR)和Fc受体样分子(Fc receptor like, FcRL)等[2]。总体来说, FcR通过识别免疫球蛋白(Immunoglobulin, Ig)的单体或者复合物来激活或者抑制免疫反应[3]。目前在人(Homo sapiens)和小鼠(Mus musculus)中已经鉴定出能识别免疫球蛋白IgG的FcR (FcγR)、IgA的FcR (FcαR)、IgE的FcR(FcεR)、IgM的FcR (FcμR)和IgD的FcR (FcδR)[4—7]。
哺乳动物FcγR大多是以多亚基的复合体形式来发挥作用, 一般是由α(FcγRα)和γ(FcRγ)亚基组成二聚体结构[3]。FcγR表达在多种细胞类型中, 包括单核细胞、巨噬细胞、中性粒细胞和血小板[8—11],在炎症反应中起到中枢调节器的作用。当这些细胞上FcγR的FcγRα亚基与IgG的Fc段结合时, 信号传递给FcRγ亚基, 并通过其胞内免疫受体酪氨酸活化基序(Immunoreceptor tyrosine-based activation motif, ITAM)上的酪氨酸磷酸化以激活下游信号传导级联反应从而发挥免疫功能, 实现对体液免疫和细胞免疫的平衡调控[12—14]。此外, FcγR还参与包括调理吞噬、介导抗体依赖的细胞毒作用、清除免疫复合物、细胞激活、释放炎症因子和活性氧等在内的各种细胞免疫反应, 以及参与免疫球蛋白的转运和抗体中和[15—19]。总之, FcγR参与调节多种先天性和适应性免疫反应。在人和小鼠中, 根据与IgG亲和力的不同, FcγR可以分为高亲和力的FcγRI (RIA、RIB、RIC)以及低亲和力的FcγRII(RIIA、RIIB、RIIC)和FcγRIII (RIIIA、RIIIB), 此外, 在小鼠中还发现了能特异性识别IgG2a和IgG2b的受体FcγRIV[20—22]。在牛(Bos taurus)、羊(Ovis aries)、猪(Sus scrofa)和马(Equus caballus)等家畜动物中也有相关FcR被克隆鉴定[23—26], 且表现出了一些特有的序列特征。例如, 在牛中存在的只能特异识别IgG1的FcγR, 在猪中发现的FcγRIIIA包含有和抗菌肽cathelicidin家族同源的序列[27,28]。另外,也有研究发现人的郎格罕细胞能表达可溶的FcγR(sFcγRIIA)[29]。
在非哺乳动物的鸟类和两栖类中也发现了FcR的同源基因[30,31]。而有关鱼类FcγR的研究最近才有相关报道。2000年, Fujiki等[32]首次在鲤(Cyprinus carpio)中发现跟人和小鼠FcRγ高度同源的分子; 2006年, Stafford等[33]首次在斑点叉尾鱼回鮰(Ietalurus punetaus)中克隆得到在结构和功能上跟哺乳动物FcγRα具有同源性的FcRL (IpFcRI), 并且发现它能够跟IgM的Fc段特异性结合。然而迄今为止, 有关虹鳟(Oncorhynchus mykiss)FcγR基因的克隆鉴定尚未见报道。虹鳟属鲑形目鲑科冷水性鱼类, 肉质鲜嫩、味美无腥, 无小刺, 蛋白质、脂肪和不饱和脂肪酸含量高, 现已被我国列为淡水养殖的优良品种[34]。本文以虹鳟为研究对象克隆得到FcγR的α和γ亚基, 研究了其序列和结构特征以及组织和细胞亚群表达分布, 这不仅为研究FcR在脊椎动物中的进化提供了数据支持, 也为今后研究虹鳟FcγR的免疫功能奠定了分子基础。
1 材料与方法
1.1 实验材料
实验用的虹鳟来自湖北荆门漳河水库虹鳟养殖场, 实验前暂养于中国科学院水生生物研究所控温楼。虹鳟的具体饲养条件同文献[35]。
健康状态下虹鳟组织样品的采集取3尾健康虹鳟(50—70) g, 麻醉后依次取血液、头肾、脾脏、胸腺、后肠、皮肤、鳃、肝脏、心脏、肌肉和脑组织, 液氮中冻存。
诱导状态下虹鳟组织样品的采集将健康虹鳟分为三组, 第一组腹腔注射100 μL无菌PBS, 第二组腹腔注射100 μL LPS (E. coli0111∶B4; 1 mg/mL,溶解于PBS; Sigma-Aldrich), 第三组腹腔注射100 μL poly (I∶C)(1 mg/mL, 溶解于PBS; Sigma-Aldrich)。随后分别于0、12h、24h、72h和168h各取3尾鱼,麻醉后取头肾组织, 液氮中冻存。
1.2 FcγRα和FcRγ亚基cDNA全长的扩增
RNA的提取与cDNA第一链的合成用Trizol试剂(Invitrogen)从上述组织样品中提取总RNA并反转录成cDNA, 详细方法见文献[35]。
FcγRα和FcRγ亚基cDNA中间片段的同源克隆根据虹鳟的cDNA文库分别获得FcγRα和FcRγ亚基的部分cDNA序列, 设计特异性引物(表 1)。以头肾cDNA为模板分别PCR扩增FcγRα和FcRγ亚基cDNA的中间片段。PCR产物经1%琼脂糖凝胶电泳检测后, 由武汉擎科生物科技有限公司完成测序[36]。
FcγRα和FcRγ亚基cDNA序列3′-和5′-末端扩增根据获得的FcγRα和FcRγ亚基cDNA中间部分序列, 设计特异性引物(表 1)。以头肾cDNA为模板, 进行RACE-PCR, 获得3′-和5′-末端序列, 再与中间序列拼接得到全长cDNA序列, 最后在非翻译区(Untranslated region, UTR)设计引物(表 1)来验证拼接的全长cDNA序列。PCR产物经电泳、胶回收、连接、转化后将阳性克隆送交擎科公司测序, 具体操作参照本课题组前期研究[36]。

表 1 本文中所用的引物序列Tab. 1 Primers used in the present study

续表 1
1.3 FcγRα和FcRγ亚基序列的生物信息学分析
利用ExPASy在线翻译工具(http://web.expasy.org/translate/)将获得的cDNA序列翻译成对应的氨基酸序列, 用SignalP 4.1 Server程序(http://www.cbs.dtu.dk/services/SignalP/)分析信号肽, 用TMHMM Server v. 2.0程序(http://www.cbs.dtu.dk/services/TMHMM/)预测跨膜区, 用SMART在线软件(http://smart.embl-heidelberg.de/)预测蛋白质的结构域。用ClastalW2.1软件多重比对氨基酸序列; 使用MEGA 7.0中的邻接法(Neighbor-joining)构建系统进化树, 自举置换(Bootstrap)1000次计算各分支的置信度。
1.4 FcγRα和FcRγ亚基基因的表达模式分析
通过CFX ConnectTMReal-Time PCR仪(Bio-Rad)检测FcγRα和FcRγ基因在虹鳟不同组织和不同细胞亚群中的表达水平,EF-1a基因为内参基因, 实时荧光定量PCR (Quantitative real-time PCR, qRT-PCR)引物的扩增效率及特异性检测同文献[37]。qRTPCR体系及程序如下: 稀释后的cDNA模板4 μL、SsoAdvancedTMSYBR Green Supermix (Bio-Rad)5 μL、250 nmol/L反向引物各0.5 μL, 总反应体系10 μL。扩增反应条件如下: 95℃ 3min, (95℃ 20s、60℃20s、72℃ 20s)45个循环, 最后从65℃到95℃添加溶解曲线。每个组织或细胞样品设3个重复, 结果采用2-ΔΔCt法计算。
1.5 虹鳟头肾和外周血组织中白细胞亚群的流式分选
用注射器从虹鳟尾静脉取血后立即用DMEM培养液(添加100 U/mL青霉素、100 mg/mL链霉素和 25 U/mL肝素钠)按照1∶5稀释; 虹鳟头肾组织经研磨后轻轻穿过尼龙网(网眼直径为100 mm), 然后用上述DMEM培养液同比例稀释; 将4 mL细胞悬液缓慢加入连续Percoll (GE)梯度(34%/51%)上, 4℃400×g在水平转头上离心30min, 收集头肾白细胞(Head kidney leukocyte, HKL)和外周血白细胞(Peripheral blood leukocyte, PBL), 加入6 mL含肝素钠的DMEM培养液洗涤2次。分别加入mouse anti-trout IgM (IgG1亚型)和mouse anti-trout IgT (IgG2b亚型)(一抗), 冰上孵育30min, 小鼠IgG作为阴性对照,然后加入APC-goat anti-mouse IgG1和FITC-goat anti-mouse IgG2b (二抗), 避光在冰上孵育30min,PBS洗涤2次后, 用BD FACSAria Ⅲ流式细胞仪分选髓样细胞(Myeloid cells, Mye)、IgM+B细胞、IgT+B细胞和双阴性(Double negative, DN)淋巴细胞, 提取总RNA并反转录成cDNA, 采用qRT-PCR进行表达分析。具体实验操作见文献[38]。
1.6 LPS或poly (I∶C)刺激后头肾组织中FcγRα和FcRγ基因的表达变化
按照上文方法, 用LPS或poly (I∶C)刺激虹鳟,检测头肾中FcγRα和FcRγ基因在不同时间点的表达变化, 分析FcγR是否参与了虹鳟的免疫应答。qRTPCR的引物和流程同1.4, 结果采用2-ΔΔCt法计算, 实验数据采用SPSS 19.0软件统计分析(P<0.05为显著差异,P<0.01为极显著差异)。
2 结果
2.1 FcγRα和FcRγ基因cDNA序列分析
利用RACE技术克隆得到虹鳟FcγR的α亚基基因FcγRα, 其cDNA (GenBank登录号: MG993321)全长1667 bp, 包含2个多聚腺苷酸化信号(AATAAA),开放阅读框(Open reading frame, ORF)为954 bp, 编码317个氨基酸(Amino acid, aa)。蛋白结构分析显示它含有一个信号肽(aa1—aa19)和2个免疫球蛋白结构域即D1(aa36—aa117)和D2(aa125—aa200)(图1A)。虹鳟FcγR的FcRγ亚基具有2种形式, FcRγ1和FcRγ2(包含FcRγ2a和FcRγ2b两个剪接异构体), 其中FcRγ1的cDNA (GenBank登录号: MG993322)全长为665 bp, ORF为279 bp, 编码92个aa (图 1B);FcRγ2a的cDNA (GenBank登录号: MG993323)全长为701 bp, ORF为342 bp, 编码113个aa (图 1C);FcRγ2b的cDNA (GenBank登录号: MG993324)全长为509 bp, ORF为300 bp, 编码99个aa (图 1D)。蛋白结构分析显示它们均具有信号肽、跨膜区和胞内ITAM基序等特征结构。
2.2 FcγRα和FcRγ同源性比较分析与系统进化树构建

图 1 虹鳟FcγRIα (A)、FcRγ1 (B)、FcRγ2a (C)和FcRγ2b (D)的cDNA及预测氨基酸序列Fig. 1 cDNA and predicted amino acid sequences of trout FcγRIα (A)、FcRγ1 (B)、FcRγ2a (C) and FcRγ2b (D)
氨基酸序列多重比对硬骨鱼类的FcγRα亚基,结果显示虹鳟FcγRα与大西洋鲑FcγRα(Salmo salar,ACN10664.1)的相同率最高(85.92%), 与其他硬骨鱼类FcγRα相同率为30%—40%。虹鳟FcγRα的信号肽跟其他硬骨鱼类的差异较大, D1和D2结构域在不同硬骨鱼类间相对较为保守, 且所有硬骨鱼类FcγRα都缺失跨膜区和胞质区(图 2A)。虹鳟FcRγ各亚型中, FcRγ1与其余2个亚型的氨基酸序列相同率分别为40.98%和45.37%(表 2), 而FcRγ2b相比FcRγ2a仅缺失14个氨基酸(图 2B); 氨基酸序列多重比对显示, FcRγ的跨膜区和ITAM区在硬骨鱼类中非常保守, 虹鳟FcRγ1氨基酸序列与其他硬骨鱼类以及人类的同源序列的相同率为38.83%—42.57%(图 2B)。
系统进化树结果显示, 硬骨鱼类的FcγRα聚为一支, 哺乳动物的FcγRα聚为另一支, 且虹鳟与大西洋鲑的亲缘关系最近, 这与其分类地位一致(图 3A)。用不同类型的FcRγ构建系统进化树(图 3B), 结果表明虹鳟FcRγ与斑马鱼(Danio rerio)、鲤(Cyprinus carpio)和鲇(Silurus asotus)等硬骨鱼类亲缘关系较近, 而与哺乳动物的亲缘关系较远, 此外虹鳟FcRγ2a和FcRγ2b聚为一亚支, 而虹鳟FcRγ1与斑马鱼的同源序列聚为另一亚支(图 3B)。
2.3 FcγRα和FcRγ基因在虹鳟组织和细胞中的表达分析
虹鳟FcRγ存在FcRγ1和FcRγ2两种形式, 其基因分别位于9号和8号染色体上, FcRγ2a和FcRγ2b是FcRγ2基因转录表达的不同剪接异构体(图 4)。与FcRγ2a相比, FcRγ2b在其ITAM基序前面仅缺失14个氨基酸残基(图 2B), 因此我们只能采用一对qRT-PCR引物来检测FcRγ2a和FcRγ2b的共表达模式。结果显示FcRγ1在各组织中表达量最高, 其次是FcRγ2a/2b, 且FcRγ1和FcRγ2a/2b在淋巴组织中的表达量要显著高于非淋巴组织, 其中脾脏表达量最高, 其次是头肾和外周血; 而FcγRα仅在外周血、头肾和脾脏等淋巴组织中有较高表达, 其余组织仅有微弱表达(图 5)。

图 2 虹鳟FcγRα与其他鱼类相应分子氨基酸序列比对(A)和虹鳟FcRγ与其他物种相应分子氨基酸序列比对(B)Fig. 2 Amino acid alignment of trout FcγRα with the related sequences in other fish (A); Amino acid alignment of trout FcRγ with the related sequences in other species (B)
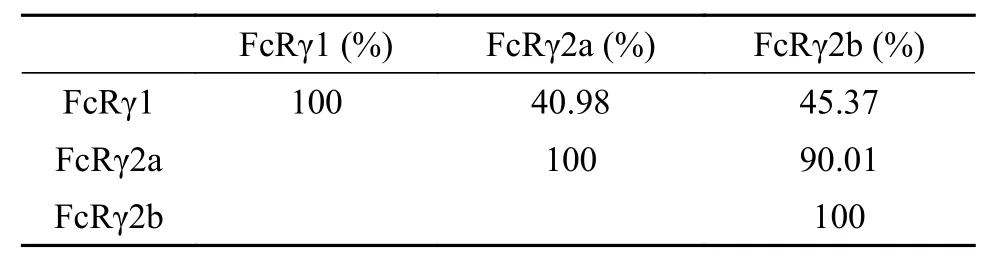
表 2 虹鳟FcRγ各亚型间氨基酸序列相同率Tab. 2 Amino acid sequence identity between the subunit of FcRγ in rainbow trout
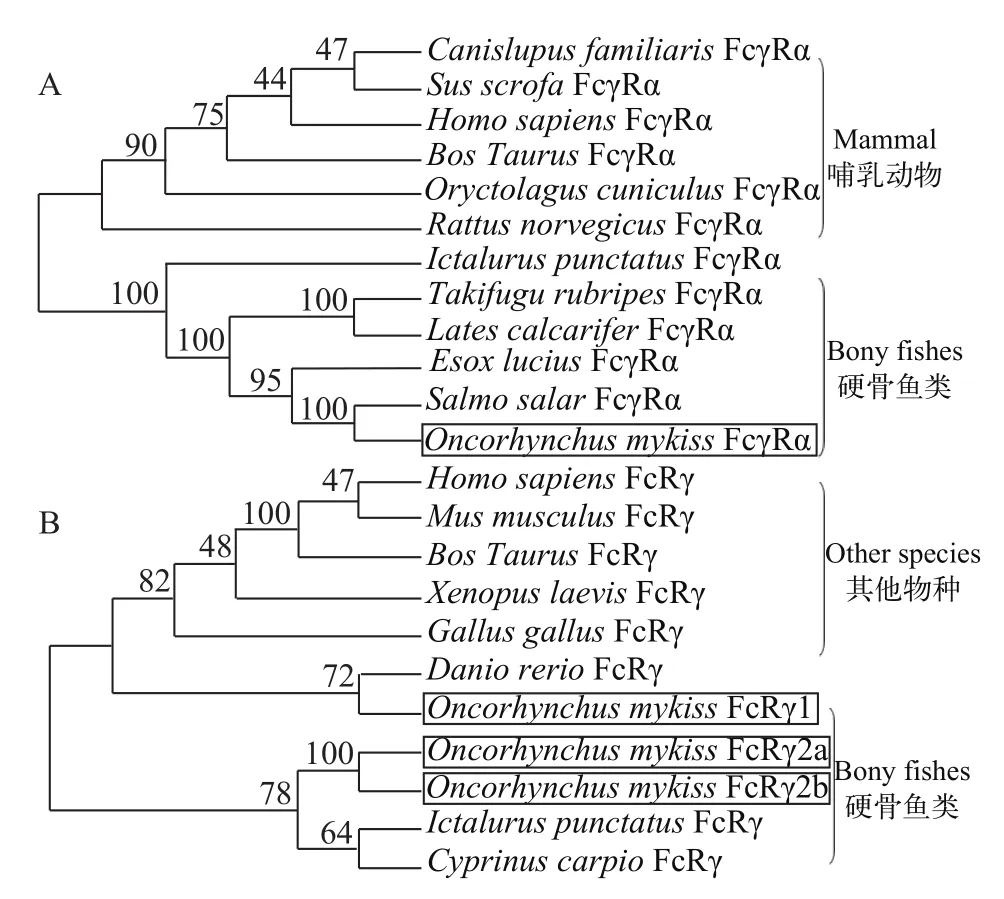
图 3 脊椎动物FcγRα(A)和FcRγ(B)氨基酸序列的系统进化树Fig. 3 Phylogenetic analysis of amino acid sequences of vertebrate FcγRα (A) and FcRγ (B)
采用流式细胞术从虹鳟PBL和HKL中分选得到IgM+B细胞群、IgT+B细胞群、DN淋巴细胞群和Mye细胞群。qRT-PCR结果显示,FcγRα、FcRγ1和FcRγ2a/2b均在Mye细胞群中表达量最高,其次是DN细胞群, 在IgM+和IgT+B细胞群仅有少量表达; 在Mye细胞群中FcRγ1表达量最高, 在DN淋巴细胞群中FcRγ2a/2b表达量最高(图 6)。
2.4 Poly (I∶C)或LPS刺激后头肾组织中FcγRα和FcRγ基因表达分析
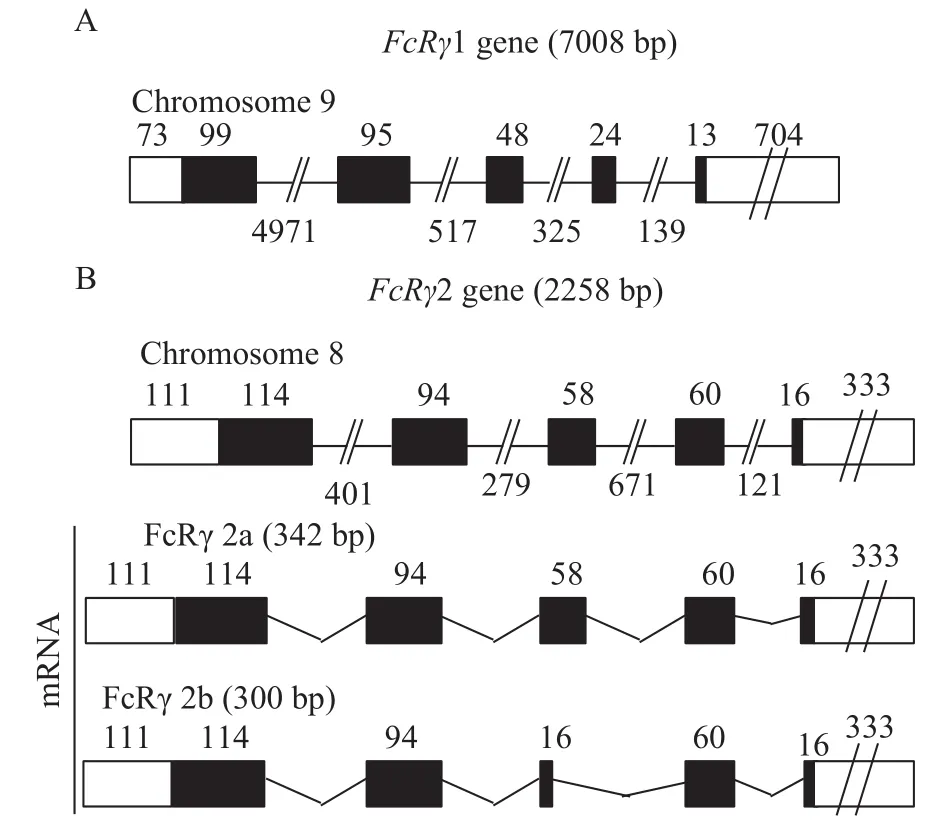
图 4 虹鳟FcRγ1(A)基因预测结构示意图和FcRγ2(B)基因及其转录产物的预测结构示意图Fig. 4 A schematic diagram shows the predicted geneorganization of FcRγ1 (A) and FcRγ2 (B) and the transcripts of FcRγ2
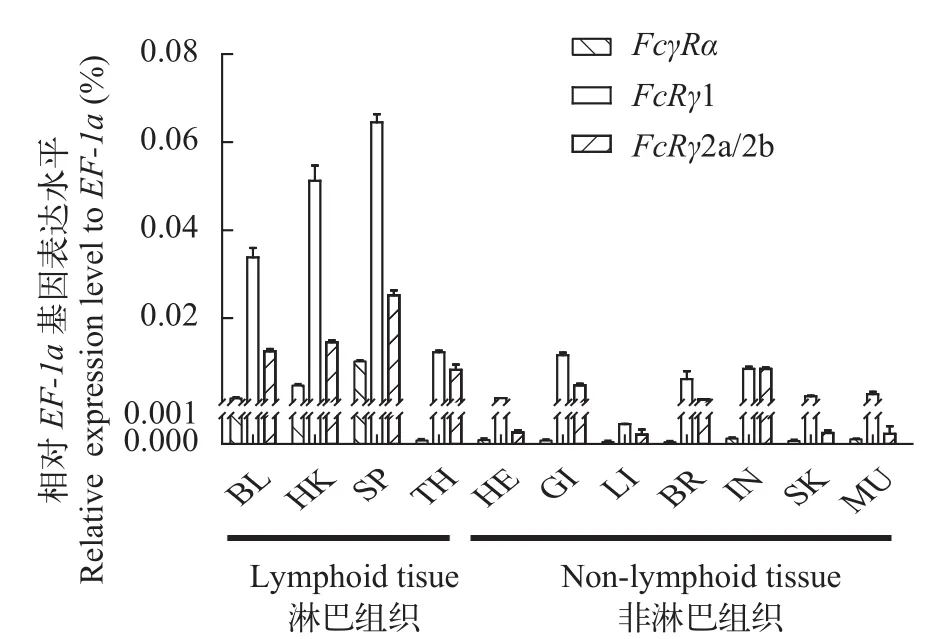
图 5 虹鳟FcγR基因的组织表达分布Fig. 5 Expression patterns of FcγR in different tissues of rainbow trout
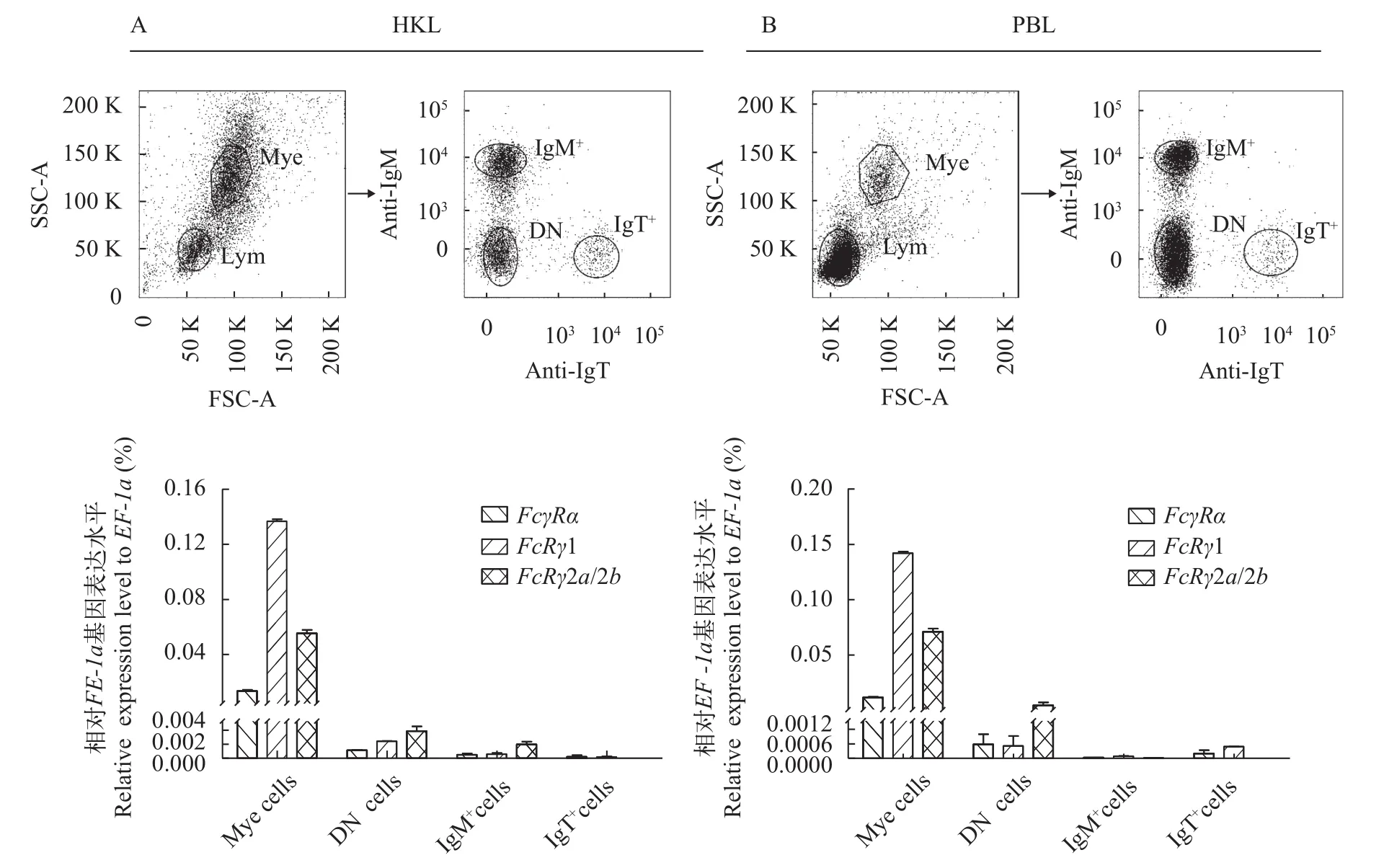
图 6 虹鳟头肾白细胞(A)和外周血白细胞(B)各亚群FcγR基因的表达分布Fig. 6 Expression patterns of FcγR in the cell subpopulations of trout head kidney leukocytes (HKL, A) and trout peripheral blood leukocytes (PBL, B)
LPS是革兰氏阴性细菌细胞壁的主要成分, 它能在动物体内引起强烈的免疫反应。为了研究FcγR基因在虹鳟抗细菌过程中的免疫作用, 我们采用qRT-PCR检测了虹鳟受LPS刺激后不同时间点FcγRα和FcRγ基因在头肾组织中的表达变化情况。结果显示, 受LPS刺激后FcγRα、FcRγ1和FcRγ2a/2b基因在头肾中均呈现先上调后下降的表达趋势。其中FcγRα在刺激12h后表达量开始升高, 并在24h达到峰值(P<0.05); 与对照组相比,FcRγ1在刺激12h后表达量有所升高, 但相比对照组其差异并不显著;FcRγ2a/2b在刺激12h后表达量显著升高(P<0.05), 在24h达到峰值; 所有基因的表达在刺激168h后开始呈现下降趋势并逐渐恢复到正常水平(图 7A)。
作为双链RNA的类似物, Poly (I∶C)可以模拟病毒感染, 诱导机体产生抗病毒的免疫反应。qRTPCR结果显示poly (I∶C)可以诱导FcγRα、FcRγ1和FcRγ2a/2b基因的表达, 其中FcγRα的表达在刺激12h后显著上调(P<0.05)并在24h达到峰值, 在刺激72h后开始下调;FcRγ1和FcRγ2a/2b的表达在刺激12h后达到峰值(P<0.05), 24h后下调到正常水平(图 7B)。
3 讨论
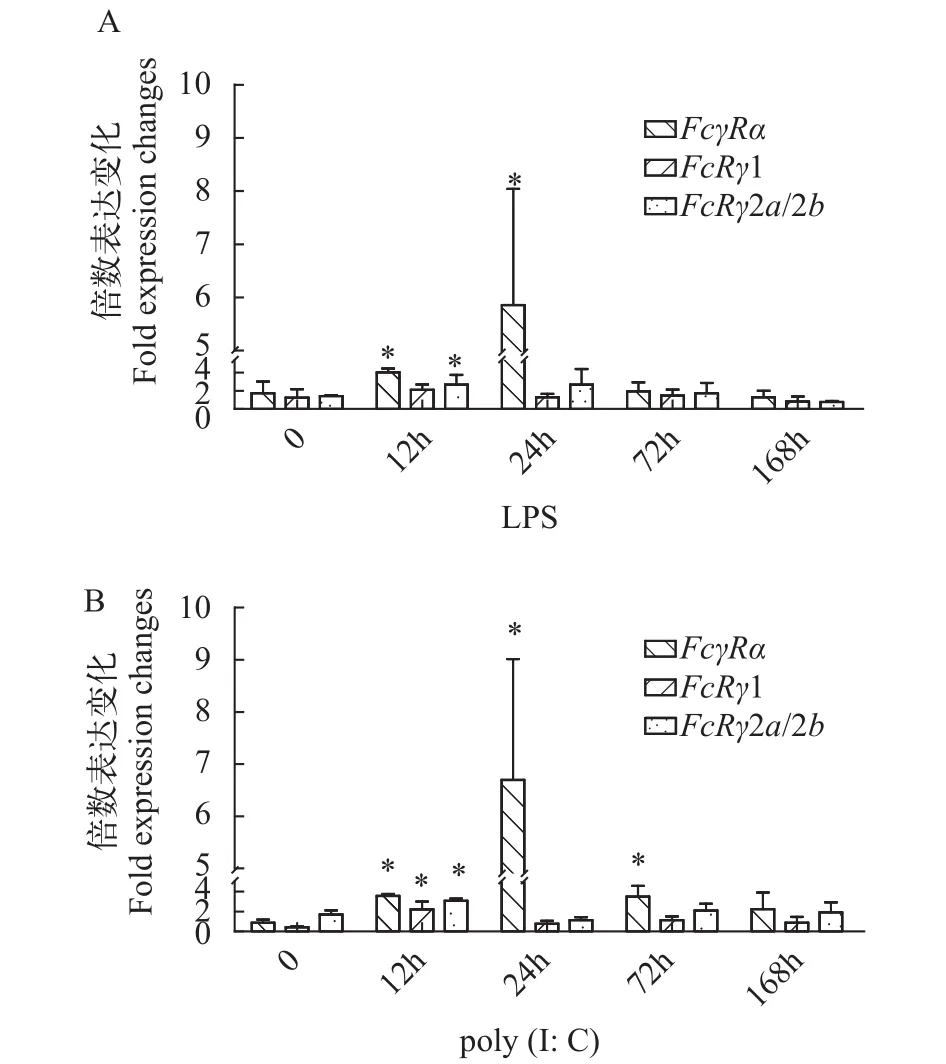
图 7 虹鳟头肾组织中FcγR基因在LPS (A)或poly (I∶C)(B)刺激下不同时间点的表达水平Fig. 7 Expression analysis of FcγR in the head kidney for trout stimulated with LPS (A) or Poly (I∶C) (B)
哺乳动物Fc受体FcγR是由FcγRα和FcRγ亚基以非共价键形式形成聚合物发挥免疫功能的[39]。在本研究中, 我们克隆了虹鳟FcγR的FcγRα和FcRγ亚基的cDNA序列。虹鳟的FcγRα亚基由2个免疫球蛋白样结构域构成, 没有跨膜区和胞内区,暗示本研究获得的虹鳟FcγRα亚基很可能是一种分泌型的可溶蛋白。可溶性的FcR (Soluble Fc receptor, sFcR)是通过mRNA的选择性剪切或者细胞膜型FcR通过蛋白酶解作用产生[40]。在哺乳动物中,sFcR不仅可以阻遏抗体复合物与膜表面表达FcR的细胞的结合, 下调B细胞的增殖和抗体分泌, 还可以通过结合补体受体来激活细胞[41—43]。在斑点叉尾鮰血清中用多克隆抗体可以检测到FcR蛋白, 证实了sFcR在硬骨鱼类中也存在[33], 由此推断虹鳟FcγRα亚基或许可以形成sFcR, 从而发挥免疫作用。氨基酸序列比对结果显示硬骨鱼类FcγRα亚基的免疫球蛋白样结构域相似度很高, 表明硬骨鱼类FcγRα亚基在进化中十分保守。与此同时, 本研究还鉴定了虹鳟FcRγ亚基的2种亚型, 它们均具有信号肽、跨膜区及胞内ITAM基序。氨基酸序列比对结果显示虹鳟FcRγ亚基与代表性脊椎动物的FcRγ亚基相似度非常高, 表明FcRγ亚基在进化中非常保守。
FcγRα基因主要在虹鳟的淋巴组织中表达, 而在非淋巴组织中的表达水平明显较低, 比如心脏、腮、肝脏和肌肉, 其组织表达模式与已报道的斑点叉尾鮰的FcR基因的表达模式[33]基本一致, 表明FcγRα可能在鱼类免疫系统中扮演重要角色。FcRγ基因在虹鳟各组织中的表达水平都要高于FcγRα基因, 这可能与FcRγ也可作为其他FcR (如FcαR、FcεR和FcμR等)的亚基以及激活信号元件有关[44]。FcRγ1基因在大部分淋巴组织中的表达水平均高于FcRγ2a/2b基因, 表明FcRγ1可能在虹鳟免疫系统中具有更广泛的作用。在人和小鼠中,FcγR基因主要在树突状细胞、单核细胞和巨噬细胞以及绝大多数的中性粒细胞中表达, 而不在淋巴细胞中表达[45], 而有关硬骨鱼类FcγR的表达细胞类型却甚少报道。本研究结果表明虹鳟的FcγR基因主要表达在头肾和外周血的髓样细胞(包含树突状细胞、单核细胞、巨噬细胞和中性粒细胞等)中,其表达细胞类型和哺乳动物中相似。
在硬骨鱼类中, 头肾被认为是类似于哺乳动物骨髓的中枢免疫器官, 在免疫系统中起重要作用[46]。在本研究中, LPS和Poly (I∶C)刺激后虹鳟FcγRα基因在头肾中的表达水平显著上调, 预示FcγRα在鱼类抗细菌和抗病毒免疫过程中发挥重要作用[47]。FcRγ1和FcRγ2a/2b基因在头肾中的表达在受刺激后12h也达到峰值, 表明鱼类FcRγ亚基可能通过ITAM参与了抗细菌和抗病毒免疫信号的传导过程。
总而言之, 本研究克隆的虹鳟Fc受体FcγR的亚基基因(FcγRα和FcRγ)广泛表达于各种组织中, 特别是包括外周血、头肾和脾脏在内的淋巴组织中。此外, 从头肾和外周血白细胞中分选得到的亚细胞群中, FcγR的亚基基因主要表达在髓样细胞群, 而且在受到LPS和Poly (I∶C)刺激后虹鳟头肾组织中FcγR的亚基基因的上调表达说明该基因参与了抗细菌和抗病毒的免疫反应。然而, 虹鳟FcγR在细胞和体液免疫中的具体功能还需要进一步探究。
