褐藻胶裂解酶AlgL17酶解工艺优化及酶解产物分析
2019-01-07梁梅芳吴利洋姜泽东肖安风朱艳冰
梁梅芳,吴利洋,倪 辉,2,3,4,姜泽东,2,3,4,肖安风,2,3,4,朱艳冰,2,3,4
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门市食品与生物工程技术研究中心,福建 厦门 361021; 4.厦门市南方海洋研究中心经济海藻资源化利用与深加工重点实验室,福建 厦门 361021)
0 引言
褐藻胶是一种线性多糖,由不同顺序的β-D-甘露糖醛酸(M)和α-L-古罗糖醛酸(G)通过共价(1-4)-键连接[1],它是褐藻酸亲水衍生物的统称,在墨角藻、海带、马尾藻和巨藻等褐藻的细胞壁中大量存在。
褐藻寡糖(alginate oligosaccharides)是褐藻胶的裂解产物,它具有抗氧化[2]、抗肿瘤[3]、抗菌[4]和促进植物生长[5]等生理活性,在农业、医药和食品等多个领域都有应用[6]。酶解法、化学法及物理法是现在主要的降解褐藻胶的方法[7]。与化学法、物理法相比,酶解法有更高的寡糖得率,有利于定向制备,并且反应条件相对温和,不会对褐寡糖的还原末端造成伤害。有研究表明[8],酶解法产生的褐藻寡糖比其他种类寡糖有更好的生物活性。
褐藻胶裂解酶(alginate lyase)通过消除糖苷键而降解海藻酸钠[9-10],是一种重要的海藻工具酶。褐藻胶裂解酶的酶学性质与其来源有关,不同来源的褐藻胶裂解酶的酶学性质存在较大差异[11],现今研究的热点是微生物来源的褐藻胶裂解酶,如来源于假交替单胞菌Pseudoaltermonaselyakovii、固氮菌Azotobactervinelandii以及棒杆菌Corynebacteriumsp.ALY-1的褐藻胶裂解酶。
在先前的研究中,本课题组筛选到一株褐藻胶裂解酶高产菌Microbulbifersp.ALW1[12]。本文将菌株ALW1的褐藻胶裂解酶基因AlgL17(GenBank收录号KY780301)在大肠杆菌中大量诱导表达,从反应温度、pH值、底物浓度、加酶量及振荡速率等方面着手,以单因素试验探讨重组褐藻胶裂解酶AlgL17降解海藻酸钠的条件,探索适合降解的相关工艺参数,以期为酶法降解褐藻胶研究积累实践资料。
1 材料与方法
1.1 实验材料
1.1.1 菌株 褐藻胶裂解酶AlgL17大肠杆菌基因工程菌,由本实验室构建与保藏。
1.1.2 主要仪器与设备 HH-4/HH-8水浴锅数显恒温水浴锅,国华电器有限公司;冷冻离心机,BECKMAN COUNTER;JO92-ⅡN超声波细胞粉碎机,宁波新艺超声设备有限公司;Epoch2T微量酶标仪,美国伯腾仪器有限公司;ACQUITY HPLC/MALDI SYNAPT Q-TOF MS,美国Waters Corp。
1.1.3 主要试剂 海藻酸钠,国药集团化学试剂有限公司,化学纯;其他试剂均为分析纯产品。
1.2 实验方法
1.2.1 褐藻胶裂解酶粗酶的制备 将实验室保存的重组褐藻胶裂解酶AlgL17大肠杆菌基因工程菌按1.2%的接种量接种到加有250 μL卡那霉素(50 g/L)的250 mL LB培养基中,37 ℃、180 r/min培养至A600为0.6~0.8,加入25 μL异丙基-β-D-硫代半乳糖苷(isopropy-β-D-thiogalactoside,IPTG)(0.5 mol/L)进行发酵培养,在18 ℃、180 r/min条件下培养20 h。将发酵的菌液在4 ℃、8 000 r/min条件下离心10 min,收集菌体沉淀,用10 mL 50 mmol/L 的NaH2PO4-Na2HPO4(pH=8.0)缓冲液重悬菌体,冰浴条件下对重悬的菌体进行超声破碎,接着在4 ℃、10 000 r/min条件下离心20 min,收集上清液,即为粗酶液。
1.2.2 还原糖的测定 利用3,5-二硝基水杨酸法(3,5-dinitrosalicylic acid,DNS)[13]测定还原糖含量,标准曲线利用葡萄糖绘制。
1.2.3 总糖含量的测定 利用苯酚-硫酸法[14]测定体系中的总糖含量。
1.2.4 平均聚合度的测定 酶解反应体系中的平均聚合度(average degree of polymerization,DP)按照以下公式计算:平均聚合度=总糖含量/还原糖含量 ,其值取整数[15]。
1.2.5 褐藻胶裂解酶的活力测定 取490 μL质量体积比为0.5%海藻酸钠底物溶液(利用pH= 8.0的50 mmol/L NaH2PO4-Na2HPO4缓冲液配制),向其中加入10 μL粗酶液,35 ℃反应30 min后,沸水浴5 min终止反应,加入500 μL DNS试剂,沸水浴10 min,迅速冷却后,在540 nm下测定吸光度值。根据还原糖的生成量计算酶活力。褐藻胶裂解酶的酶活力单位定义为:在上述条件下,每分钟降解底物产生1 μmoL还原糖( 以葡萄糖计)所需的酶量为1个酶活力单位(U)。
1.2.6 单因素试验 取4.9 mL质量分数0.5%海藻酸钠底物溶液,向其中加入0.1 mL粗酶液,混匀后分别置于25,30,35,40,45,50 ℃下水浴210 min,每隔30 min取出0.5 mL,沸水浴5 min,然后加入0.5 mL DNS试剂,沸水浴10 min,取0.1 mL反应液稀释至1 mL,在540 nm下测定吸光度值。以灭活的酶液作为对照组,与样品组在同等条件下反应。保持其他因素不变,按上述方法逐一改变底物质量浓度、底物溶液pH值、酶用量和振荡速率进行单因素试验,每个因素最优结果用于下一个单因素试验。
1.2.7 酶解动力学 分别取4.9 mL质量分数 0.1%,0.3%,0.5%,0.7%,0.9%,1.1%的海藻酸钠底物溶液,向其中加入0.1 mL粗酶液,按照节1.2.5的方法测定吸光度值。以底物质量浓度的倒数(l/[S])为横坐标,还原糖产生速率的倒数(1/V)为纵坐标,用Lineweaver-Burk双倒数作图法作图,求解褐藻胶裂解酶的Vm和Km。
1.2.8 重组褐藻胶裂解酶的酶解产物分析 取质量分数0.5%海藻酸钠溶液30 mL,加入6 U褐藻胶裂解酶,35 ℃下反应,每小时取一次样,测定还原糖含量,当还原糖含量稳定时,补加3 U褐藻胶裂解酶继续反应,直到还原糖含量再次稳定。将反应液沸水浴10 min,冷却后,在4 ℃、10 000 r/min条件下离心20 min,收集上清液即为酶解产物。将酶解产物上样于液质联用仪的进样口中,通过液相色谱质谱联用(liquid chromatography-mass spectrometry,LC-MS)进行分析。液相分析条件为:采用ACQUITY BEH C18柱(2.1 mm× 150 mm,1.7 μm),以流动相A(质量分数0.1%甲酸)和流动相B(体积分数100%乙腈)进行梯度洗脱,流速为0.3 mL/min。根据液相峰的不同,利用质谱检测各峰的成分。
2 结果与分析
2.1 褐藻胶裂解酶活力
以海藻酸钠为底物,利用DNS法测定得到的褐藻胶裂解酶的活力为11.6 U/mL。
2.2 单因素对褐藻胶裂解酶酶解海藻酸钠的影响
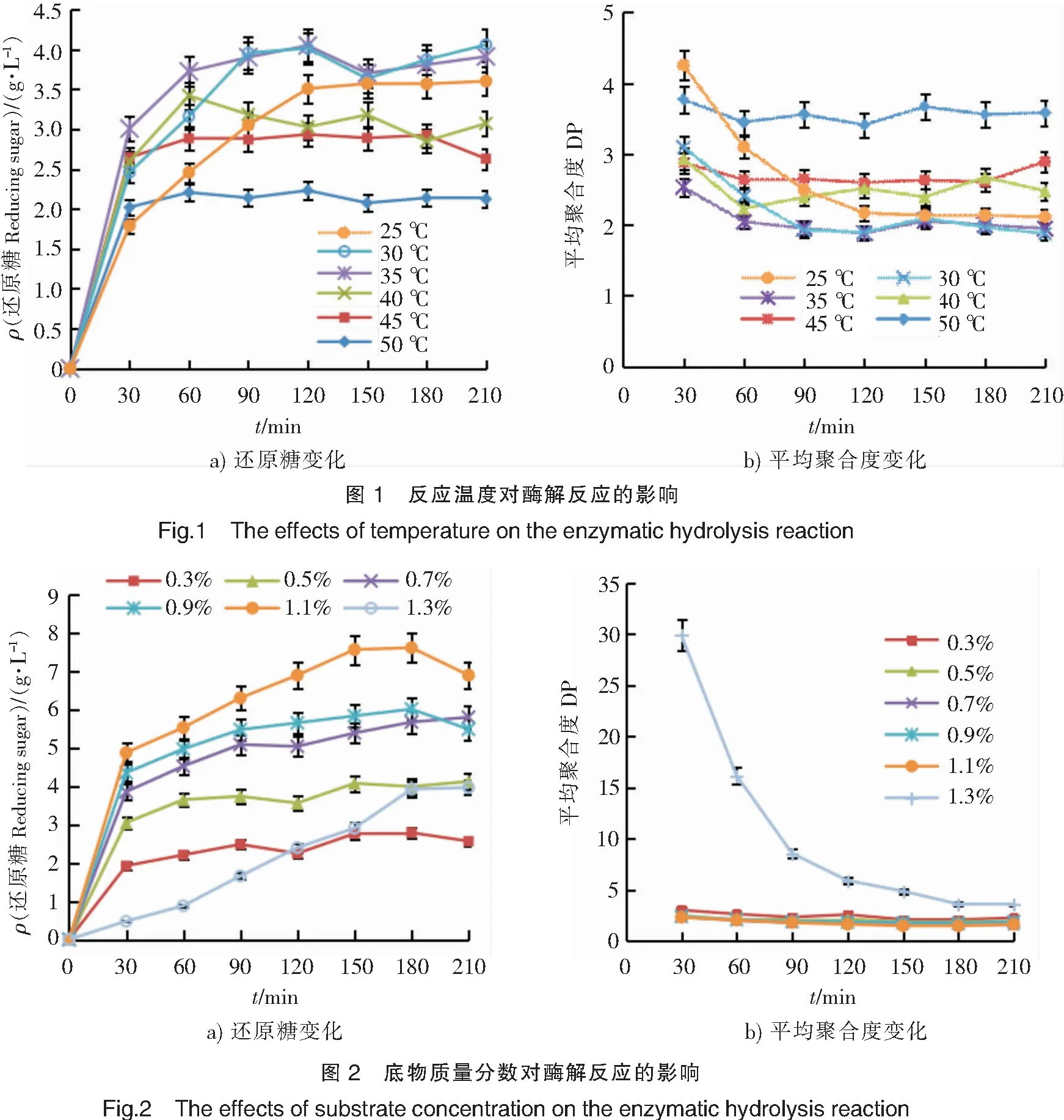
2.2.1 反应温度对酶解反应的影响 探究不同反应温度对褐藻胶裂解酶降解褐藻胶的影响,结果如图1所示。由图1a可见,当反应温度低于35 ℃时,反应温度越高,还原糖生成量也随之增高,其原因是:温度升高使得底物的热能被提高,导致反应速率加快进而增大了还原糖生成量。当反应温度高于35 ℃时,还原糖生成量随反应温度的升高而减小,可能是温度过高影响了酶的活力,使得还原糖生成量减少。当反应温度在35 ℃和30 ℃时,还原糖生成量最大,在35 ℃下比在30 ℃下更快达到反应平衡。在此条件下,平均聚合度在反应60 min后降至2,此后聚合度无明显下降(见图1b),这与还原糖生成量达到平衡的时间一致。因此,综合考虑,反应温度选35 ℃。
2.2.2 底物质量分数对酶解反应的影响 探究不同底物质量分数对褐藻胶裂解酶降解褐藻胶的影响,结果如图2所示。由图2a可见,当底物质量分数低于1.1%时,还原糖生成量随底物浓度的增大而持续升高;当海藻酸钠质量分数高于1.1%时,还原糖生成量明显减小,可能是由于海藻酸钠水溶液有一定粘性,浓度过大不利于底物扩散,从而降低反应效率;当底物质量分数为1.1%时,还原糖生成量达最大值。由图2b可见,当底物质量分数为1.3%时,平均聚合度随反应时间逐渐降低;当底物质量分数≤1.1%时,酶解体系的平均聚合度随底物浓度的变化波动并不明显,在酶解60 min时,平均聚合度均降至2,继续酶解基本不变。综合考虑,选择底物质量分数为1.1%。
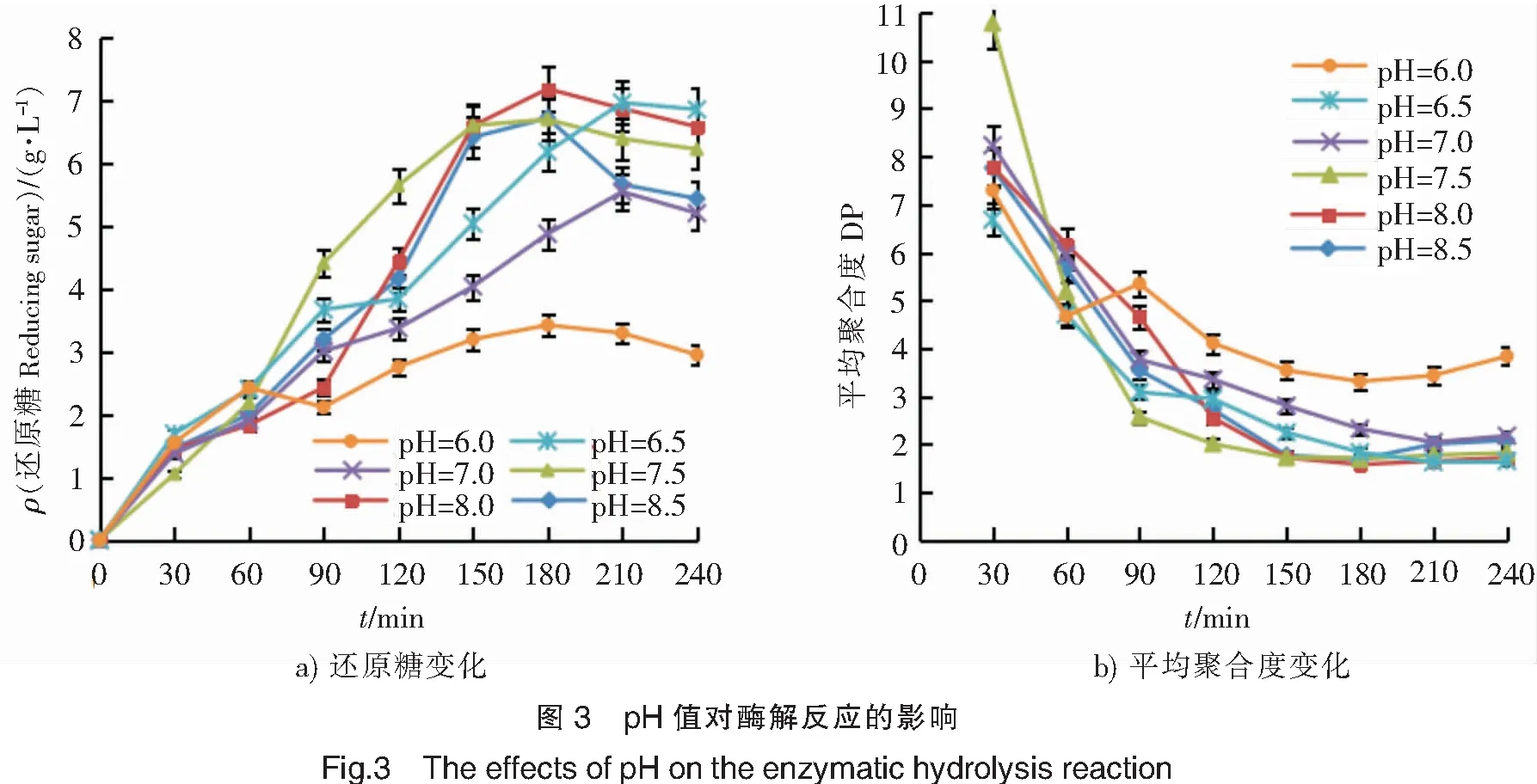
2.2.3 pH值对酶解反应的影响 酶活性中心上的催化基团中质子的受体或供体所需的离子化状态以及必需基团的解离程度是影响酶解反应的重要因素,它们都会受到pH值的影响,进而影响酶与底物的结合。探究反应体系不同pH值对褐藻胶裂解酶降解褐藻胶的影响,结果如图3所示。在pH<8.0时,pH值的变化对褐藻胶裂解酶的影响较大,除pH= 6.5外,体系内还原糖生成量随着pH值的增加而升高;pH>8.0时,还原糖生成量随反应时间增加而增加,180 min后呈下降趋势;pH=8.0时还原糖生成量最大,在此条件下,随反应时间的延长,还原糖生成量迅速增加,在180 min时还原糖生成量达最高(见图3a),平均聚合度稳定在2左右(见图3b)。因此,选择pH=8.0。
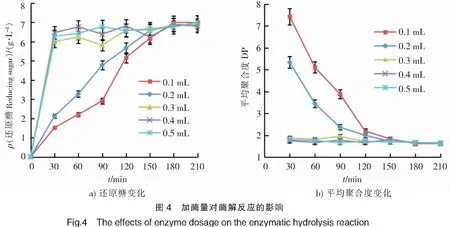
2.2.4 加酶量对酶解反应的影响 探究反应体系不同加酶量对褐藻胶裂解酶降解褐藻胶的影响,结果如图4所示。反应体系中添加不同的酶量,还原糖最终的生成量相近。加酶量为0.1 mL和0.2 mL的反应体系平衡趋势相近;加酶量≥0.3 mL时,反应体系平衡趋势相近,但平衡所用时间比加酶量为0.1 mL和0.2 mL时更短(见图4a),在底物一定的情况下,酶浓度增加,加快了反应速率,使其更快达到平衡状态。在反应150 min时所有反应体系的DP值均达到2左右(见图4b)。因此,为了节约成本,选择加酶量0.1 mL。
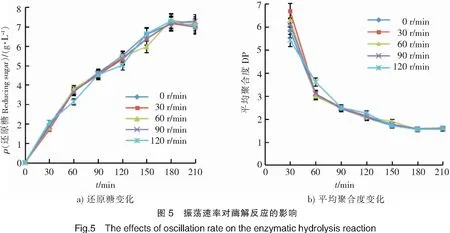
2.2.5 振荡速率对酶解反应的影响 探究反应体系不同振荡速率对褐藻胶裂解酶降解褐藻胶的影响,结果如图5所示。在各振荡速率下,体系所产生的还原糖量均相同,平衡趋势相近,到达平衡所用时间相同(见图5a)。平均聚合度的变化也相似,在150 min时不同振荡速率的反应,DP值均达2左右(见图5b)。综上所述,振荡速率对酶解反应没有明显影响。因此,从节约能源的角度考虑,选择不振荡反应。不振荡反应180 min,产生的还原糖质量浓度为7.09 g/L,平均聚合度为2。
2.3 动力学参数
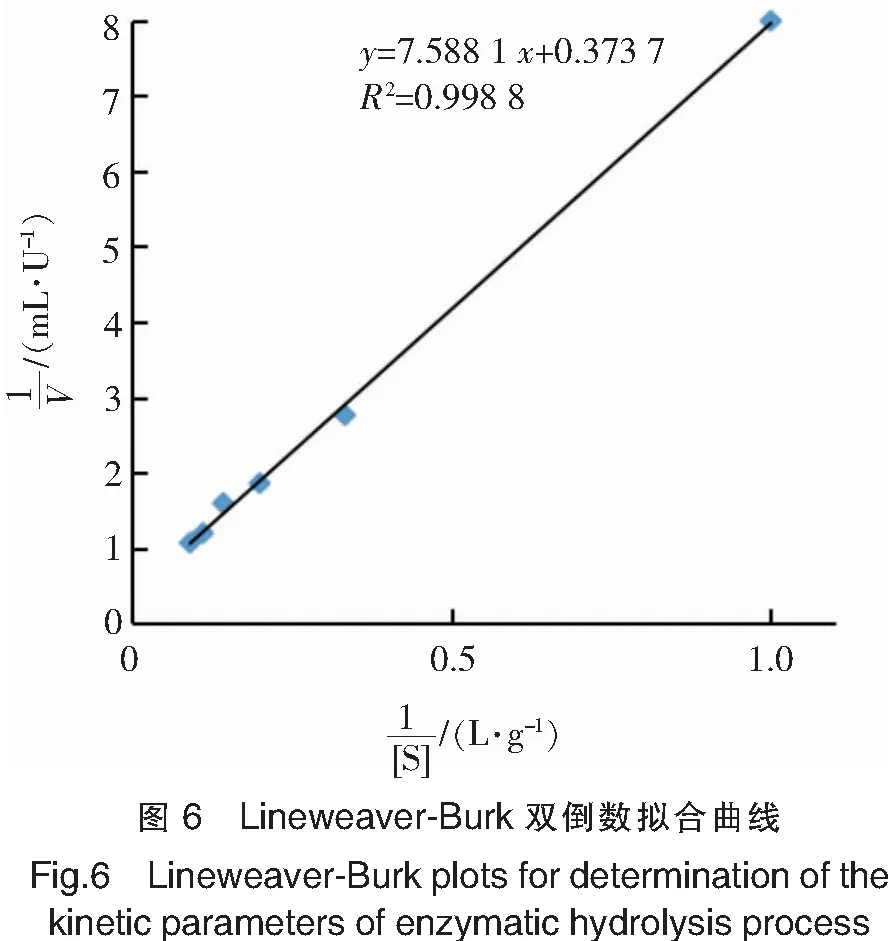
测定褐藻酸钠不同质量浓度时反应体系的反应初速率,按双倒数作图法作1/V-1/[S]曲线,结果如图6所示。根据方程求得酶的Km为20.31 g/L,Vmax为2.68 U/mL。
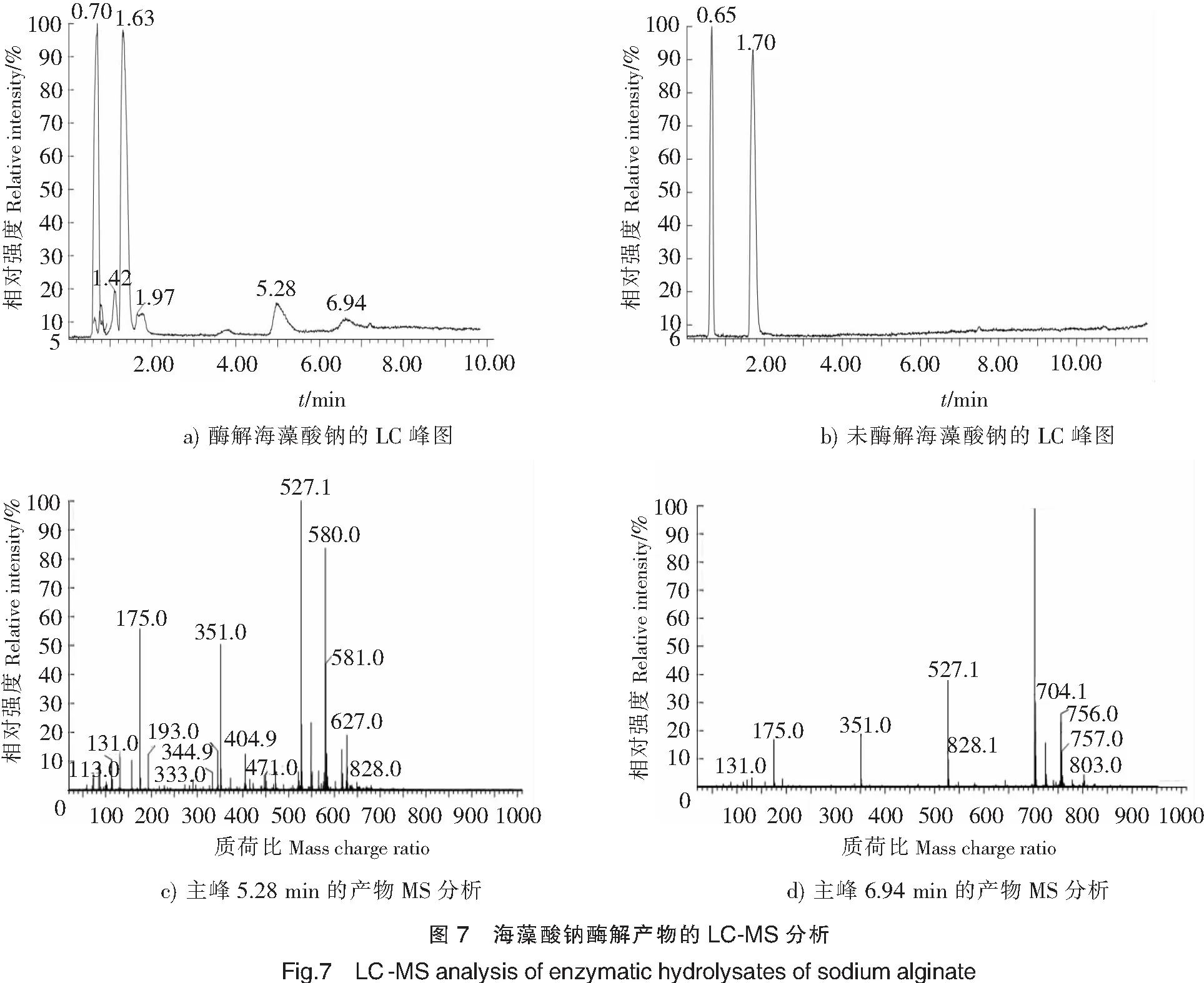
2.4 酶解产物的质谱分析
利用AlgL17降解海藻酸钠,将其酶解产物进行LC-MS分析。液相色谱峰图中,海藻酸钠降解物分别在保留时间5.28 min和6.94 min存在两个主要峰(见图7a);未酶解海藻酸钠的LC峰图显示在保留时间5.28 min和6.94 min不存在峰(见图7b)。采用MS对液相主要峰进一步分析,在负离子模式下,产物平均聚合度和质荷比根据[DPx-H]-(x=1,2,3,4,5)定为1(质荷比为175),2(质荷比为351),3(质荷比为527),4(质荷比为703),5(质荷比为879)。从图7c可知,液相色谱5.28 min的主峰中包括单糖、二糖和三糖产物;从图7d可知,6.94 min的主峰中包括单糖、二糖、三糖和四糖产物。结果表明,海藻酸钠经褐藻胶裂解酶AlgL17降解生成单糖、二糖、三糖和四糖。
3 结论
将来源于Microbulbifersp.ALW1的褐藻胶裂解酶基因Algl17在大肠杆菌中重组表达,重组的褐藻胶裂解酶AlgL17的最适酶解条件:反应温度为35 ℃,pH=8.0,初始底物质量分数为1.1%,加酶量1.16 U,不振荡反应180 min。达到平衡时,产生的还原糖质量浓度为7.09 g/L,产物的平均聚合度为2。LC-MS分析显示,海藻酸钠酶解终产物为单糖、二糖、三糖和四糖。
