大黄鱼免疫球蛋白M重链基因全长cDNA序列的克隆与表达
2019-01-07刘卫刚韩坤煌谢芳靖邹鹏飞张子平王艺磊
刘卫刚,韩坤煌,2,谢芳靖,邹鹏飞,张子平,王艺磊,2
(1.集美大学水产学院,福建 厦门 361021;2.大黄鱼育种国家重点实验室,宁德市富发水产有限公司,福建 宁德 352103;3.福建农林大学动物科学学院,福建 福州 350002)
0 引言
脊椎动物通过自身的先天免疫与获得性免疫系统来抵抗外界多种病原的侵袭,以保证机体的正常生命活动,而免疫球蛋白是在脊椎动物获得性免疫中发挥重要作用的组成成分[1]。
当前对哺乳动物免疫球蛋白的相关研究较为深入,而针对鱼类免疫球蛋白的研究则明显不如哺乳动物。很长一段时间内在硬骨鱼类中仅发现有IgM[2]或者仅同时含有IgD[3],后来又陆续在虹鳟鱼(Oncorhynchusmykiss)中发现IgT[4],斑马鱼(Damiorerio)中发现IgZ[5],但最后发现二者为同一类型,甚而发现IgM-IgZ的嵌合体[6-7]。与此同时,在软骨鱼类中也先后发现IgNAR、IgNARC[8]与 IgX[9]等免疫球蛋白,显示硬骨鱼类与软骨鱼类间的免疫球蛋白类型存在一定差异。
研究显示IgM在所有鱼类的体液免疫中都具有重要作用[7]。目前已对多种鱼类的IgM进行了不同程度的研究,然而作为我国最重要的海水养殖经济鱼类之一的大黄鱼(Larimichthyscrocea),却较少见到相关研究报道。此外,近年来由于环境污染与养殖密度过大等原因,人工养殖的大黄鱼种质不断退化,抗病力下降,大黄鱼养殖业遭受较为严重的病害侵袭[10]。因此,克隆大黄鱼免疫球蛋白重链(immunoglobulin mu heavy chain,LcIgMH)基因,将为阐明大黄鱼的相关抗病分子机制提供更多信息,并为我国大黄鱼养殖业防治病害提供一定的指导依据,具有重要的应用价值。
1 材料与方法
1.1 材料
实验用鱼来自宁德市富发水产有限公司鱼排,鱼体体重180~250 g。1)取雌雄大黄鱼各5尾,分别取如下组织:性腺、头肾、肌肉、肝脏、脾脏、脑、鳃、胃、眼、肠和心脏,并将各组织样品置于RNAlater中4 ℃处理一段时间,后放-80 ℃冰箱长期冻存。2)将100尾健康大黄鱼均分为两组,一组注射含有浓度为6.6×108cfu/mL(为半致死浓度的20%[11])副溶血弧菌(Vibrioparahaemolyticus)的海水;另一组则注射等量的已灭菌海水 ,且于注射后2、4、8、12 d对脾脏进行取样(实验组与对照组各时相都取5条鱼),样品保存方法同1)。
主要试剂有:RDP试剂[12](实验室自配),SMARTTMRACE cDNA Amplification Kit(Clontech公司),逆转录试剂盒(Promega公司),DNA胶回收试剂盒(上海捷瑞公司),pMD-19T质粒载体(大连 TaKaRa 公司) ,SYBR Green Realtime PCR Master Mix(上海TOYOBO公司)。引物由上海生工公司合成。
1.2 方法
1.2.1 总RNA提取
用RDP试剂对约50 mg大黄鱼不同组织样本提取RNA,详细方法参考文献[12]。用ND-1000紫外分光光度计测定总RNA浓度,并用1.0%(体积分数)琼脂糖进行凝胶电泳以检测RNA质量。
1.2.2LcIgMHcDNA 克隆
从本实验已有大黄鱼表达标签数据库(EST)中获取LcIgMH基因的部分片段,用Primer 5.0等软件设计相关基因引物(见表1),并用SMARTTMRACE cDNA Amplification Kit获取cDNA第一条链并最终实现目的基因扩增。相关产物采用1.5%(体积分数)的琼脂糖进行电泳,并用胶回收试剂盒对目的片段胶进行回收纯化。将PMD19-T与纯化产物于16 ℃连接过夜,后与DH5α感受态细胞进行转化,随后将感受态细胞用含有氨苄青霉素的LB固体培养基置于37 ℃过夜培养,挑取单克隆菌落利用M13引物进行PCR检测,最后将呈阳性的菌落用含氨苄青霉素的LB进行扩大培养,取培养物400 μL送至上海生工公司进行DNA测序。
1.2.3LcIgMH序列的生物信息学分析
用Blast(http://blast.ncbi.nlm.nih.gov/Blast.cgi)分析测序结果,确定LcIgMH基因并拼接全长cDNA序列;用ORF Finder(http://www.ncbi.nlm.nih.gov/projects/gorf/orfig.cgi)预测ORF;用SignalP4.1 Server(http://www.cbs.dtu.dk/services/SignalP/)预测其信号肽区域;用ExPASy(http://cn.expasy.org/tools/pi_tool.html)预测LcIgMH等电点与分子量;用NetNGlyc1.0 Server(http://www.cbs.dtu.dk/services/NetNGlyc/)对LcIgMH潜在的糖基化位点进行预测;用TMHMM Server V2.0(http://www.cbs.dtu.dk/services/TMHMM/)对LcIgMH进行跨膜区域预测;用NetPhos3.1 Server(http://www.cbs.dtu.dk/services/NetPhos/)预测磷酸化位点;用IMGT/DomainGapAlign(http://www.imgt.org/3Dstructure-DB/cgi/DomainGapAlign.cgi)预测LcIgMH的可变区与恒定区。
1.2.4 qRT-PCR
取1 μg总RNA进行逆转录,最终获取cDNA,以大黄鱼18S rRNA(Lc18S)为内参基因,将cDNA稀释100倍用于qRT-PCR。反应体系包括:SYBR Green Realtime PCR Master Mix 10 μL、cDNA 模板9 μL及正反引物各0.5 μL。反应程序:95 ℃ 15 s;60 ℃ 1 min,共进行40个循环。目标基因的相对表达量数据分析,采用2-△△Ct法,数据结果表示为平均值±标准差。用SPSS 20.0统计软件对所有数据进行ANOVA单因素方差分析,以P<0.05表示存在显著性差异,P<0.01表示存在极显著性差异。

表1 本研究所用引物
2 结果与分析
2.1 大黄鱼各组织总RNA
用RDP试剂所提取出的各组织RNA,琼脂糖凝胶电泳结果显示具18S rRNA与28S rRNA条带都很完整。图1为本研究提取的大黄鱼性腺总RNA电泳图,其他各组织电泳结果与之相似。
2.2 LcIgMH基因序列分析
利用本实验室自建的大黄鱼cDNA文库筛选IgM重链的片段,应用5′RACE和3′RACE-PCR技术得到其全长cDNA。使用BLAST 2软件进行拼接后,最终得到长为1917 bp的LcIgMHcDNA全长序列(GenBank登陆号:FJ589726.1),其中:3′非编码区(3′Untranslated Region,UTR)176 bp,5′UTR 6 bp,以及ORF 1738 bp(见图2)。同时,在polyA尾前30 bp处存在一个AATAAA加尾信号,可知3′UTR扩增较为完整。对获得的ORF进行相关预测,发现其编码584个氨基酸(见图2),所编码的蛋白分子量约为65.2 ku,等电点为5.84。 SingalP4.1 server预测结果显示,其N端含有信号肽(1-19 aa)。NetPhos 3.1 Server预测显示该序列中含有29个丝氨酸潜在磷酸化位点,8个苏氨酸潜在磷酸化位点,9个酪氨酸潜在磷酸化位点。NetNGlyc 1.0的预测显示LcIgMH含有3个糖基化位点(N242、N340与N550)(见图2)。推测LcIgMH蛋白共含13个半胱氨酸残基,与其他物种IgMH蛋白氨基酸序列进行多重比对之后发现多个半胱氨酸残基高度保守(见图3)。TMHMM 2.0预测结果显示,LcIgMH不含跨膜区域,显示本研究获得的LcIgMH为分泌型而非膜结合型。BlastP结果显示LcIgMH与红笛鲷(Lutjanussanguineus)IgMH(ADX01345.1)序列一致性最高,达到64%,与多种硬骨鱼类IgMH也具有较高的一致性;而与人类(Homosapiens)IgMH(P0DOX6.1)的一致性仅有30%,同非洲爪蟾(Xenopuslaevis)IgMH(AAA49774.1)的一致性也只有32%。用IMGT/DomainGapAlign对LcIgMH进行可变区与恒定区预测,发现其含有1个VH及4个CH区域(见图2),同时可变区含有典型的3个CDR区域与4个FR区域(见图3),显示其具有鱼类IgMH的典型结构。
2.3 LcIgMH的同源性分析和系统发育分析
利用已经报道的其他多种硬骨鱼类、人和非洲爪蟾(Xenopuslaevis)的IgMH蛋白质氨基酸序列进行多重序列比对,结果发现大黄鱼与其他硬骨鱼类的IgMH保守性远高于人和非洲爪蟾。由比对结果可知上述各物种的IgMH可变区及恒定区序列都存在一定的保守性,且恒定区的保守性较可变区更高。此外,对可变区的保守性分析显示其保守性主要集中于4个FR区域,而3个 CDR区域的变异性则非常大(见图3)。
利用上述物种的IgMH蛋白氨基酸序列,使用MEGA7软件,以N-J法构建系统进化树(见图4)。进化树分析显示,大黄鱼、红笛鲷、金头鲷(Sparusaurata)、鳜鱼(Sinipercachuatsi)、条纹婢(Latrislineata)、南极鳕(Nototheniacoriiceps)、斜带石斑鱼(Epinepheluscoioides)、大西洋鲑(Salmosalar)及虹鳟聚为一支,而斑马鱼独立成一支,人类及非洲爪蟾独立成另一支。
2.4 LcIgMH基因在各组织中的表达
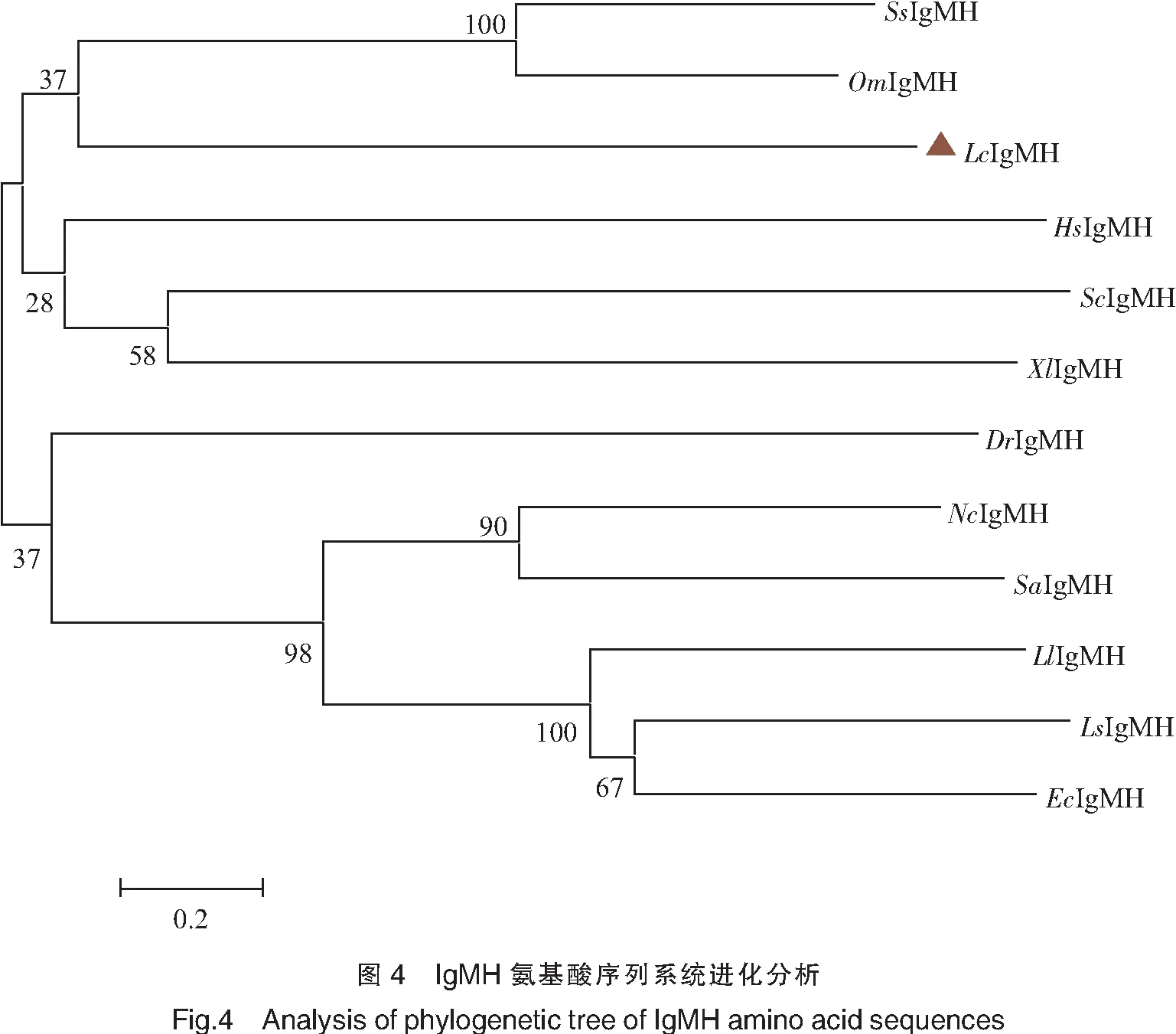
如图5所示,大黄鱼LcIgMH在脾脏和头肾中表达量显著高于其他各组织(P<0.05),虽然脾脏中LcIgMH重链基因的表达量雄鱼高于雌鱼,头肾中雌鱼高于雄鱼,但都未形成显著性差异。而在性腺、肌肉、肝脏、脑、鳃、胃、眼、肠及心脏中LcIgMH的表达量极低,表明相关组织可能较少参与机体的免疫反应。


2.5 大黄鱼脾脏LcIgMH基因在副溶血弧菌感染后的表达
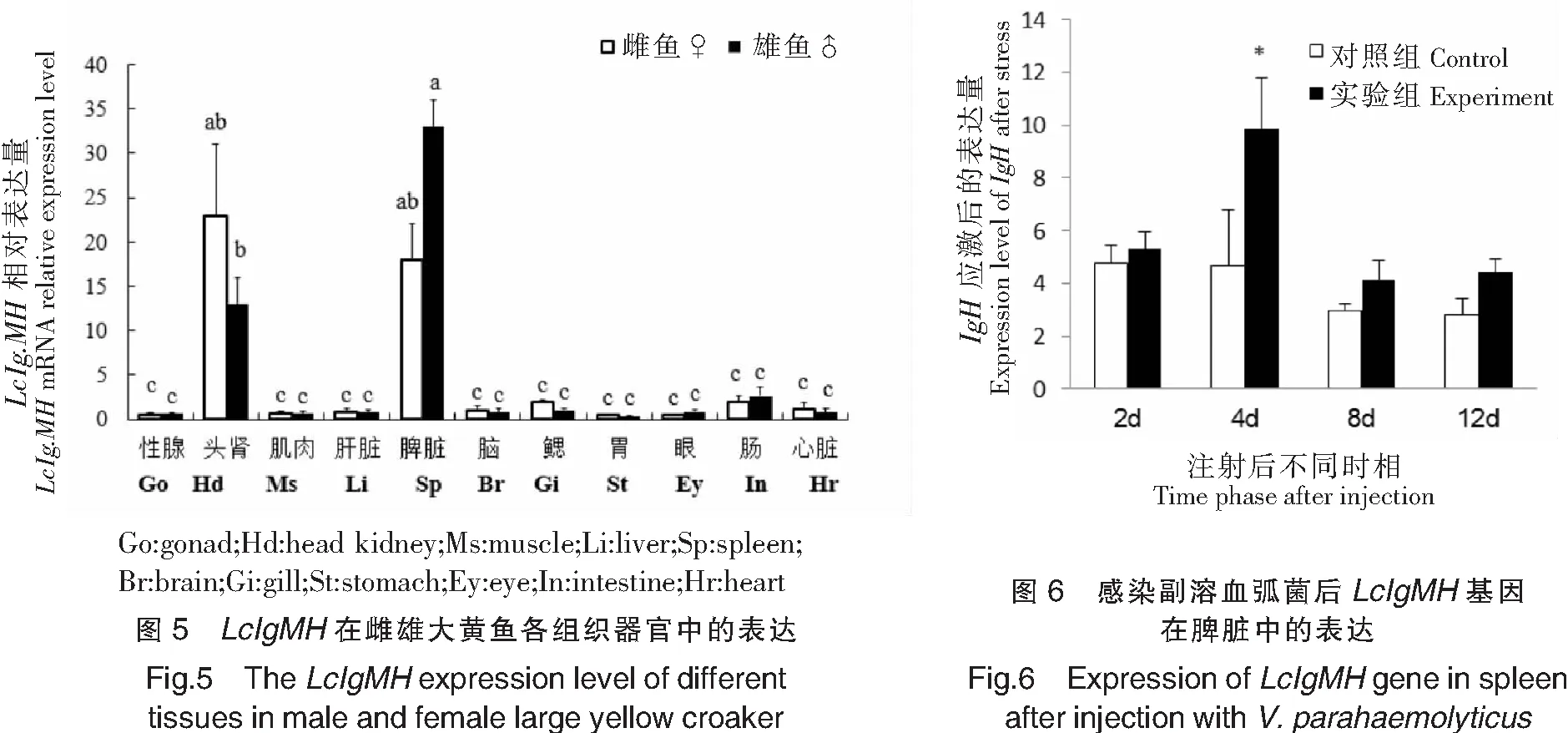
由图6可知,注射副溶血弧菌进行感染4 d后,脾脏内LcIgMH表达量最高,并且与对照组之间存在显著性差异(P<0.05),而从感染后8 d的结果显示其表达量已回落至对照组水平。在检测的各时间点中,感染后的第4天,是脾脏参与副溶血弧菌引起的免疫应答的一个重要节点。此外,本文发现对照组从始至终都存在一定量的LcIgMH表达。
3 讨论
本研究成功克隆到大黄鱼LcIgMH基因的cDNA全长。多重序列比对分析发现,不同物种间IgMH蛋白的CDR区域差异性非常明显。CDR区域主要作用是识别抗原,其序列具有高变性则更易于识别多种抗原,利于机体的免疫反应,增强对环境的适应性。同一脊椎动物,因为需要面对多种病原,倘若仅仅只产生一种IgMH是不可能满足机体免疫需求的。脊椎动物可以通过基因重排来改变CDR区域,并以此为基础使机体产生的免疫球蛋白可以识别多种抗原。同一脊椎动物,即使面对同一入侵病原也很可能产生多种IgMH,而这些蛋白之间的差异主要是CDR区域。因为同一入侵病原,也可能具有不同的抗原表位,需要不同的CDR识别。
在生物的进化过程中,鱼类处于由低等向高等进化的过渡阶段,硬骨鱼类和软骨鱼类都已具备高等脊椎动物免疫系统的雏形,但与高等脊椎动物相比仍然不成熟[13]。当前研究认为鱼类的肾脏、胸腺及脾脏是主要免疫器官,三者在鱼类免疫反应中起重要的作用[14-17]。但是随着鱼类个体的生长,胸腺逐渐退化,其在免疫中发挥的功能也逐渐减小。如王欣欣[7]发现草鱼中头肾、中肾与脾脏中IgMH的表达量远高于其他组织,而胸腺中IgMH的表达量与其他组织并无显著性差异,暗示成年草鱼的胸腺在机体免疫中的作用可能并不如脾脏与头肾重要。其他研究也显示,鱼类的肾脏与脾脏在鱼类的免疫应答中起重要作用[18-20]。本研究利用荧光定量PCR技术初步分析了LcIgMH基因的表达情况,发现其在脾脏和头肾中的表达量均显著高于其他各组织,推测头肾与脾脏在大黄鱼的免疫应答中具有重要作用,并通过弧菌感染实验对脾脏中该基因的表达水平进行分析,发现其在感染4 d时的表达量显著高于未感染组,表明LcIgMH参与大黄鱼副溶血弧菌感染下的免疫应答。这与谢芳靖[11]早前对大黄鱼感染副溶血弧菌后LcIgMH在头肾中的上调表达时间存在一定差异,提示头肾与脾脏在免疫应答中的作用可能并非完全一致。同时根据本实验结果可知,大黄鱼本身就具有一定的LcIgMH本底表达水平,显示鱼体在生长过程中已经发生过特异性免疫应答或者是为合成BCR服务,同时暗示LcIgMH在大黄鱼的整个生命活动中都具有重要意义。王亚凤等[21]在对胭脂鱼(Myxocyprinusasiaticus)早期发育各时期进行IgM RNA的检测,发现其在出膜后一个月就有明显的表达,表明自然状态下脊椎动物很早就可能开始接触抗原并产生相关免疫应答或者合成BCR。
对雌雄大黄鱼各组织中LcIgMH的表达水平进行检测分析,本研究发现不同性别的大黄鱼并不会差异性地表达LcIgMH。在对大西洋鳕鱼的研究[22]中亦发现体长相近但性别不同的个体,与免疫相关的待检测指标都不存在明显差异。上述结果暗示鱼类的性别差异并不会对其IgMH的表达产生显著性影响。
免疫球蛋白在体内发挥相关生物学作用,是一个十分复杂的过程。国内外已经有诸多文献指出各组织mRNA的表达量,并不一定能准确反映相关蛋白在生物体内的含量及其发生相应生物学作用的场所。利用Western Blot检测胭脂鱼各组织中IgM蛋白的表达情况时,发现在用qRT PCR并未检测出IgM转录本的皮肤与心脏中,却可以检测出胭脂鱼IgM蛋白,推测可能是机体血液循环将IgM蛋白运送至上述组织所致[21]。此外,ELISA也是常用的检测IgM蛋白的手段,但是人们认为前者比后者更灵敏且可信度更高。如Jirapongpairoj等[23]设计2种抗鱼IgMH血清,同时利用上述两种方法对7种鱼类血清进行检测,发现Western blot的灵敏度远高于ELISA。因此,后续深入探究大黄鱼LcIgMH在体内从表达到发挥相应的生物学作用的过程,需要结合核酸与蛋白质的相关技术研究手段进行系统分析。
