臂丛各神经根切断后靶肌肉内代偿机制的实验研究
2019-01-07姜宗圆熊章霞欧阳阳刚孙浩然梁海陈琪刘岸雄谢统明
姜宗圆 熊章霞 欧阳阳刚 孙浩然 梁海 陈琪 刘岸雄 谢统明
30多年来,健侧颈7移位术已成为治疗全臂丛根性撕脱伤的主要术式[1-5]。在对健侧颈7神经根切断后代偿机制的研究中,我们发现:颈7神经根支配的运动单位在某些靶肌肉内可能分布不均匀,来源于邻近健康神经的轴突出芽可能是颈7神经根切断术重要的代偿方式[6-8]。那么,臂丛各神经根切断后邻近健康神经的轴突出芽是否也可实现代偿,即臂丛各神经根是否同样存在神经根移位术的可能?
因此,本研究采用臂丛颈5至胸1各神经根单独切断的SD大鼠模型,运用乙酰胆碱酯酶染色和单纤维肌电图(Single-fiber electromyography,SFEMG)检测,研究臂丛神经各根切断后主要靶肌肉内运动终板形态学和功能学的变化过程,探索臂丛神经各根在靶肌肉内分布特点和切断后的代偿机制。
1 材料和方法
1.1 臂丛各神经根切断的动物模型制作
120只雄性SD大鼠,体质量150~200 g。随机分为5组,每组24只。腹腔内注射麻醉后,手术显微镜下在SD大鼠右侧锁骨下区作切口,将臂丛神经根部结构完整显露。将右侧颈5神经根用1%利多卡因局封后切断,远侧端向远端翻起并用10-0无创伤缝线固定于胸小肌膜上,造成右侧颈5神经根至少4 cm以上缺损的颈5神经根切断组模型。左侧颈5神经根显露后不作处理,为对照组。同理,分别制成颈6、颈7、颈8和胸1神经根切断组。关闭切口,术后常规饲养动物。
1.2 单纤维肌电图检测
在臂丛各神经根切断术后第1、4、8、12周,沿原右侧锁骨下区的切口进入,分离到臂丛神经根部位置,确认臂丛各神经根仍然断裂,如有再生神经纤维连接,则该动物弃用。显露各神经根主要靶肌肉(颈5对应三角肌、大圆肌,颈6对应肱二头肌、肱桡肌,颈7对应背阔肌、肱三头肌,颈7对应屈指肌、尺侧屈腕肌,胸1则对应爪内骨骼肌)起止点,分离清楚神经入肌点备用。
肌电图仪为KEYPOINT全功能肌电图仪,阴性电极为刺激电极,放在距靶肌肉起点1 cm处,阳性电极置于距阴性电极远侧0.5 cm处,开始脉冲刺激10 Hz,刺激时限为 50 μs,1~4 mA 电流。 刺激电流每0.1 mA逐步增加,直到局部肌肉出现细小的抽搐。记录的单纤维电极在距离阴性电极远侧2 cm处插入肌肉内,慢慢调整深浅、细心旋转针头,直至获得稳定的、满意的肌肉动作电位。SFAP的确认是获得双相波形,峰-峰波幅大于200 μV,负峰上升时间少于 200~300 μs,全部持续时间少于 1 ms,波形稳定而不被其他电位干扰[9]。刺激电流在阈刺激强度上增加10%作为标准刺激强度。对照组进行同样的SFMEG检测。
在每个位点计算机记录100个连续放电冲动下,从每块肌肉的20个不同记录位点值中计算得出平均Jitter值,并自动计算出MCD(Mean consecutive difference of their latencies)、MSD (Mean sorted difference)和 MIPI(Mean interpotential interval)值。
1.3 组织标本的采集及处理
完成SFMEG检测后,迅速切取各靶肌肉,置于4%多聚甲醛中4℃固定24 h,PBS洗数次,OTC包埋,在异戊烷里速冻片刻后封存,纵形连续冰冻切片(15 μm),-80 ℃冰箱保存。
1.4 乙酰胆碱酯酶染色及灰阶度测定
乙酰胆碱酯酶染色:配制Karnovsky-Roots孵育液(碘化乙酰硫代胆碱13 mg,0.1 mol/L磷酸二氢钠7 mL,0.1 mol/L磷酸氢二钠9 mL,0.1 mol/L柠檬酸钠1 mL,50 mmol/L硫酸铜 3 mL,蒸馏水 2 mL)后,加入至15 μm冰冻切片,室温下放置24 h,蒸馏水洗数次,脱水,封固。
乙酰胆碱酯酶灰阶度测定:应用Qwin图像分析系统,测定各组靶肌内终板区乙酰胆碱酯酶含量。每块肌肉的染色切片中随机取3张,200倍光镜下随机观察10个运动终板,检测乙酰胆碱酯酶染色的纵断面大小和切片酶的灰阶度值。为了合理减少工作量,于每组中随机取2只动物的对照侧样本进行检测,最后共8只实验动物的对照侧数据纳入统计。
1.5 统计学处理
用 SPSS21.0 软件进行统计学处理,以(x±s)表示,对数据进行方差齐性检验,方差齐者用配对t检验,方差不齐者用Wilcoxon秩和检验。P<0.05为差异有统计学意义。
2 结果
2.1 单纤维肌电图检测
在第 1、4、8、12 周,臂丛各神经根切断组(包括正常对照侧)的靶肌肉接受SFMEG检测,计算机记录靶肌肉中成功测出的有Jitter的SFAP图形,收集每侧靶肌肉所有测出的Jitter值,自动计算MCD、MIPI值和MCD分布图。
在臂丛神经各根切断组中,颈5和胸1神经根切断后在靶肌肉内出现无代偿特征的Jitter图形(图1);颈6、颈7和颈8神经根切断后会出现明显的代偿性Jitter改变(图2)。结果表明,在臂丛神经各根切断组中,仅颈7神经根切断后第1~4周时Jitter均值逐渐增大,且明显高于对照组(P<0.05),第8~12后恢复正常(图3)。其余各神经根切断后的Jitter均值明显低于对照组(P<0.05)。臂丛神经各根切断后靶肌肉内的MCD的分布图表明,仅在颈7神经根切断后会出现明显代偿变化(图4)。
2.2 乙酰胆碱酯酶染色
正常肌肉内运动终板呈椭圆形,大小基本一致,外围有黄褐色环带,内圈呈棕黄染色,边缘清晰锐利,着色均匀。
颈5神经根切断术后第1周,靶肌肉运动终板的大小、形态和染色深浅并无改变,第4周开始运动终板面积逐渐扩大,乙酰胆碱酯酶染色变深,范围不变或缩小,到第8~12周,运动终板染色变淡,消失(图 5-6)。
颈6神经根切断术后第4周,运动终板面积散大,变形,乙酰胆碱酯酶染色变浅,到第8~12周,大部分运动终板消失,但仍有部分面积扩大,淡染的运动终板存在(图7)。
颈7神经根切断术后第4~8周,在某些区域能发现少数异常的运动终板,表现为面积扩大,扭曲变形,乙酰胆碱酯酶染色变浅,到第12周后,运动终板的大小、形态和染色深浅全部恢复正常(图8)。
颈8神经根切断术后靶肌肉内运动终板变化与颈6神经根切断术几乎一致,但可见少数恢复正常形态的运动终板(图9)。
胸1神经根切断术后,靶肌肉运动终板在4~12周内同样存在从散大、变淡直至消失的过程(图10)。
对每块肌肉内平均运动终板大小(表1)和乙酰胆碱酯酶染色的灰阶度值进行半定量统计 (表2),发现各神经根切断组和对照组在术后1~8周内,组别间平均运动终板大小和平均乙酰胆碱酯酶灰阶度差别无统计学意义(P>0.05),仅术后第12周时,颈5、6、8、胸1切断组的运动终板面积增大,乙酰胆碱酯酶灰阶度下降,与其他时间段有明显差异(P<0.05),而颈7切断组却能基本恢复到对照组水平。

图1 颈神经根切断后无代偿特征的jitter图形Fig.1 Jitter pattern with no compensatory feature after cervical nerve root amputation
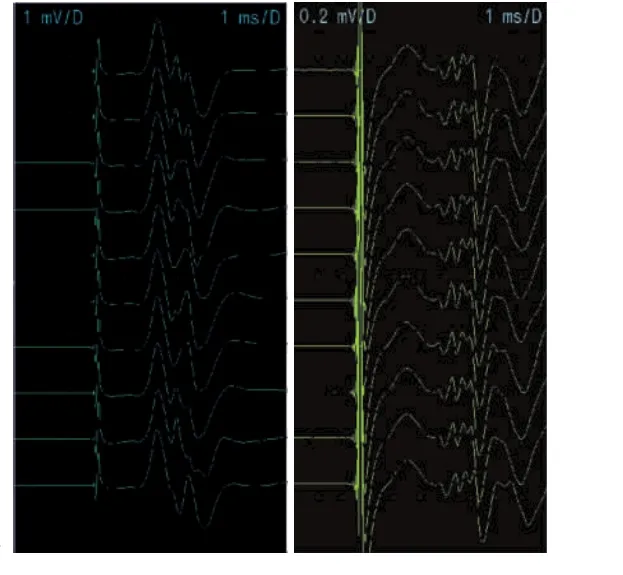
图2 颈神经根切断后有代偿特征的jitter图形Fig.2 Jitter pattern with compensatory characteristics after cervical nerve root amputation
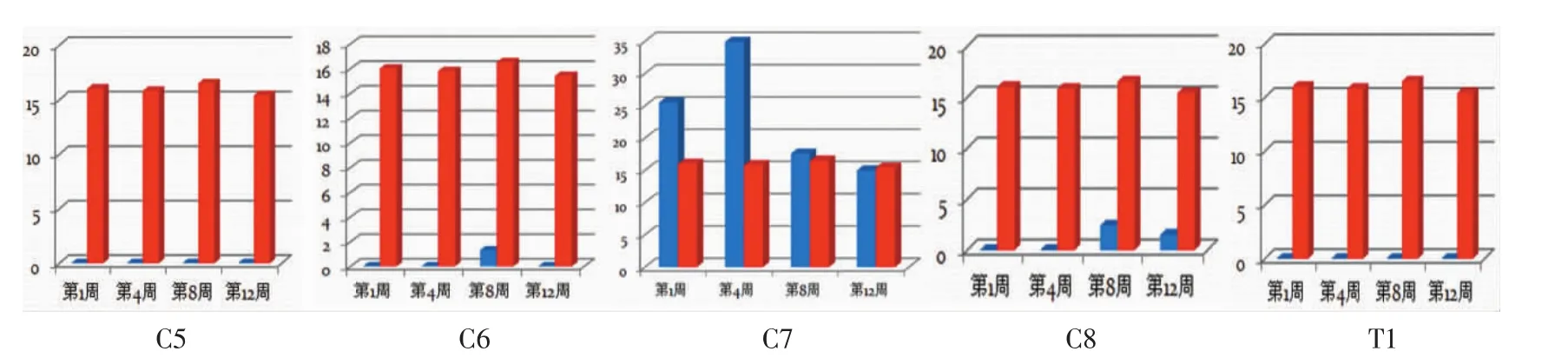
图3 不同时间段实验组与对照组间Jitter均值比较(红色为对照组,蓝色为实验组)Fig.3 Comparison of Jitter mean values between experimental and control groups in different time periods(Red:CG;Blue:EG)
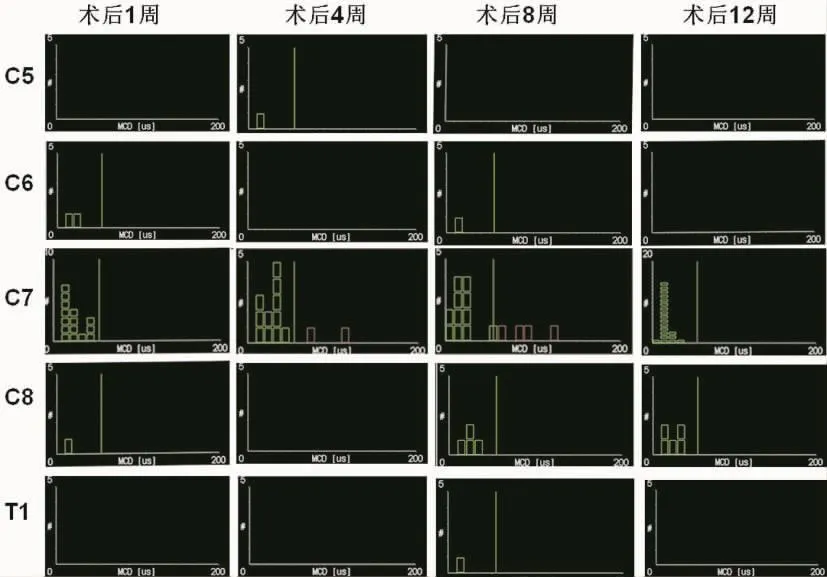
图4 第1~12周内的具代表性MCD(即Jitter均值)分布图Fig.4 Representative MCD (Jitter mean values)distribution map in 1-12 weeks

图5 C5神经根切断后第1~4周内,靶肌肉内运动终板形态变化Fig.5 The shape of motor endplate in target muscle 1-4 weeks after C5 nerve root amputation

图6 C5神经根切断后第8~12周内,靶肌肉内运动终板形态变化Fig.6 The shape of motor endplate in target muscle 8-12 weeks after C5 nerve root amputation
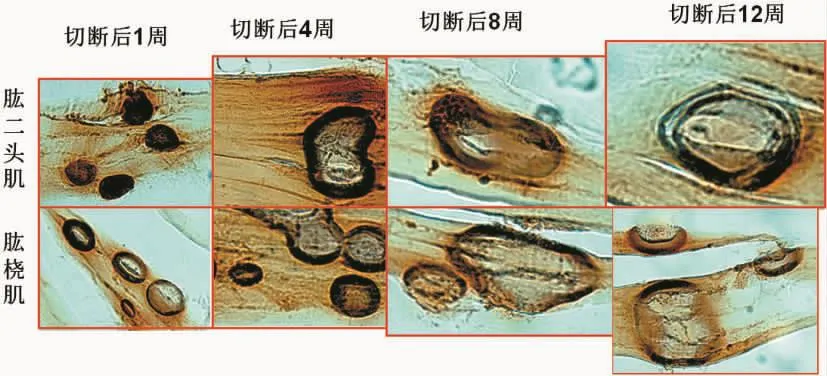
图7 C6神经根切断后靶肌肉内运动终板形态变化Fig.7 Morphologic changes of motor endplate in target muscle after C6 nerve root amputation
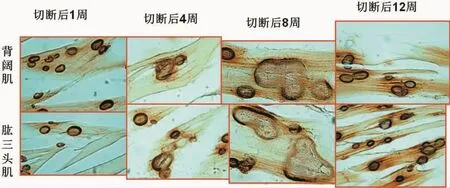
图8 C7神经根切断后靶肌肉内运动终板形态变化Fig.8 Morphologic changes of motor endplate in target muscle after C7 nerve root amputation
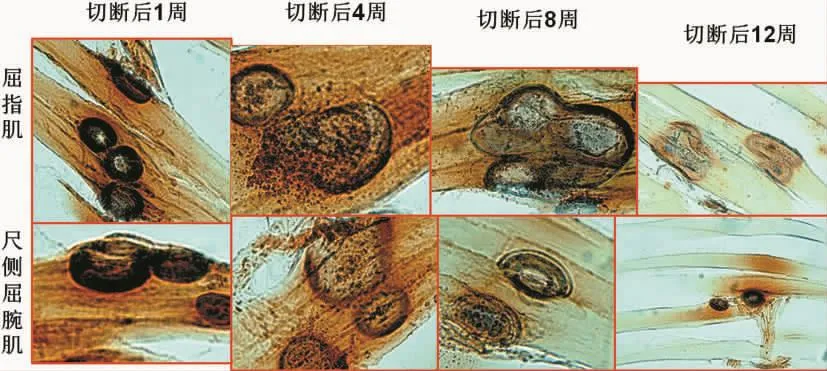
图9 C8神经根切断后靶肌肉内运动终板形态变化Fig.9 Morphologic changes of motor endplate in target muscle after C8 nerve root amputation
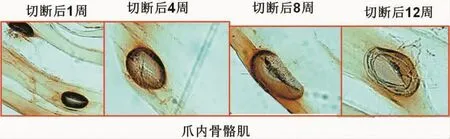
图10 T1神经根切断后靶肌肉内运动终板形态变化Fig.10 Morphologic changes of motor endplate in target muscle after T1 nerve root amputation
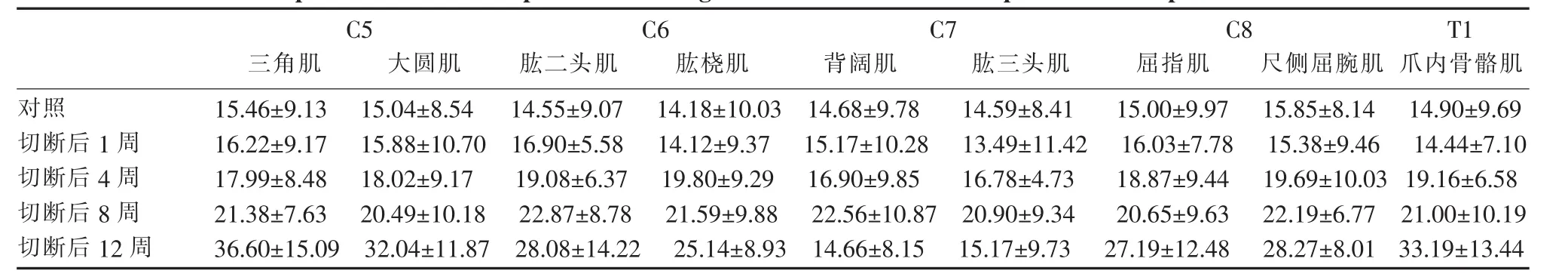
表1 各神经根切断后不同时间点靶肌肉内运动终板面积比较Table 1 Comparison of motor endplate area in target muscle at different time points after amputation of nerve root
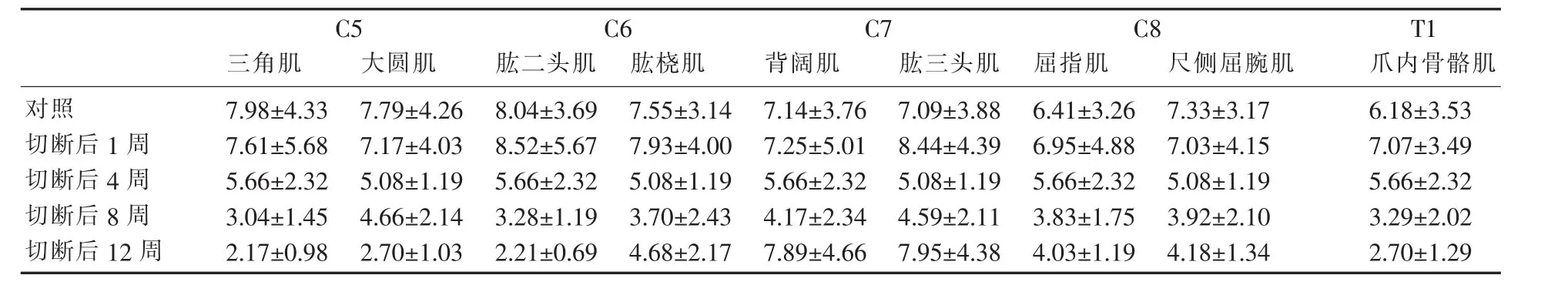
表2 各神经根切断后不同时间点靶肌肉内乙酰胆碱酯酶灰阶度比较Table 2 Comparison of the gray-scale of acetylcholinesterase in target muscle at different time points after nerve root amputation
3 讨论
3.1 臂丛各神经根切断术后的运动终板功能变化
SFMEG具有微创性,操作简便,能提供更多有关运动单位信息,结果稳定可靠的Jitter值是评价神经-肌肉接头功能的敏感指标[10-11]。因此,我们应用SFMEG检测来研究臂丛各神经根切断后其支配肌内的运动终板功能的代偿过程[9,12]。
颈5神经根切断后1周,三角肌和大圆肌内运动终板功能明显下降,直至第12周时靶肌肉内都很难检测到代偿性Jitter改变。这说明颈5神经根切断后,其支配肌内临近的健康神经纤维代偿能力缺乏,无法改变肌肉内的失神经性退变过程。
颈6神经根切断后的靶肌肉内,尽管在第4~8周检测出少许运动终板有代偿性Jitter出现,但代偿性的轴突出芽[6]很少发生,整个实验周期内靶肌肉内的运动终板功能下降,未检测到恢复迹象。说明健侧颈6神经根切断后的代偿能力低下。
颈7神经根切断后的肱三头肌和背阔肌内,术后1周靶肌肉内出现大量的代偿性Jitter改变,颈7神经根切断后第4周,Jitter值逐渐增大,第1~4周内的Jitter值明显高于对照组,说明颈7神经根切断后早期出现非常活跃的代偿改变,第8~12周后,Jitter值恢复至正常水平,运动终板功能得到代偿。
颈8神经根切断后第1~4周内,屈指肌和尺侧屈腕肌内仅个别部位能测到代偿性Jitter改变,第8~12周时出现Jitter值增大,但没有统计学差异,即运动终板功能未获得有效代偿。
胸1神经根切断后,靶肌肉内Jitter改变与颈5神经根基本相同。
而对于MCD(即Jitter均值)的差异性来说,由于代偿时出芽致同一轴突再支配肌纤维数量增加,兴奋由轴突末梢共同分支点至各纤维传导时间不同,致使MCD增加[13]的特征仅在颈7神经根切断后明显出现,颈8神经根切断也部分出现,其余神经根切断后几乎没有。
3.2 臂丛各神经根切断术后靶肌肉内运动终板的形态学变化
运动终板以直径25~30 μm的梅花形分布于肌纤维表面[14-15],周围神经损伤后运动终板消失[16-17],神经再生时,运动终板结构恢复正常[18]。早期研究中,我们发现颈7神经根切断后第4~8周,靶肌肉内大部分运动终板的大小、终板区乙酰胆碱酯酶灰阶度有消褪趋势,但第8周时开始逐步恢复,术后第12周,由于临近健康神经的轴突出芽,基本恢复了运动终板结构的正常形态[7],从而证明健侧颈7神经根具有进行移位术的理论基础。
在颈5神经根切断术后1周,三角肌和大圆肌内运动终板面积大小和乙酰胆碱酯酶灰阶度无明显变化;4~12周时,绝大部分运动终板逐渐散大,乙酰胆碱酯酶灰阶度变淡,逐渐消失。颈5神经根切断后,其主要支配的肌肱二头肌和肱桡肌内的运动终板形态变化,表现出不可代偿性。这与临床上颈5神经根断裂后出现肩关节外展功能障碍符合[5]。
颈6神经根切断后4~12周,肱二头肌和肱桡肌内的运动终板逐渐散大,乙酰胆碱酯酶灰阶度变淡,其趋势同颈5神经根切断后。12周后,也仅能看到少许不均匀分布的正常形态的运动终板。说明健侧颈6神经根切断后基本不具备代偿能力。
颈7神经根切断后靶肌肉内运动终板的形态变化与我们以前的研究结果相同,且在相同实验条件下,其代偿能力与其他神经根形成很好的对比。
颈8神经根切断后4~8周,屈指肌和尺侧屈腕肌内的运动终板逐渐散大,乙酰胆碱酯酶灰阶度变淡。12周后,运动终板大部分继续散大、变淡直至消失,但仍有部分区域能看到运动终板的维持。证明在大鼠实验中健侧颈8神经根也具备部分代偿能力,存在健侧神经根移位术的可能性。
胸1神经根切断后,爪内骨骼肌的运动终板形态变化的趋势同颈5神经根切断后。
3.3 本研究的意义
尽管颈7神经包含有17 000至40 000根神经纤维,但仅以此来修复全臂丛神经仍显不足[19-20];而且,健侧颈7移位术存在健肢同步收缩问题,即患侧修复神经的功能需要健侧肌肉收缩而激发,使患侧功能的独立行使受到影响。
如能从健侧找出更多的动力神经来同时修复上干和下干,或将获得更为理想的效果。以往研究认为,颈7神经根单独成中干,其在臂丛神经中特殊的结构是颈7神经根移位术的理论基础。前期研究中我们发现,颈7神经根支配的运动单位在某些靶肌肉内可能分布不均匀,来源于邻近健康神经的轴突出芽是颈7神经根切断术重要的代偿方式[6-8]。那么,颈6或颈8神经根切断后邻近健康神经的轴突出芽也可能实现代偿,也就是说颈6和颈8神经根也可能具备神经根移位术的潜力。
为了研究颈6和颈8神经根的代偿潜力,我们对所有臂丛神经根的分布和切断后的代偿能力进行了以SD大鼠为动物模型的实验研究。结合靶肌肉内运动终板形态和功能的变化过程,我们认为颈5、胸1神经根不具有代偿潜力,不能切断作为供区神经;尽管颈6神经根和颈8神经根切断后均有代偿潜力,且两者在统计学上差异不大,但颈6神经根切断后的肌肉冰冻切片中观察到大部分靶肌肉会出现不可逆性退变。另外,我们在临床观察中发现,颈6神经根损伤患者出现明确的屈肘瘫痪现象,建议切断颈6神经根作为供区神经的选择要慎重;颈8神经根在SD大鼠实验中表现出有限的代偿潜力,需要进一步研究。当然,颈7神经根具有完美的代偿潜力,已在实验和临床上都得到了很好的验证。
将来,健侧多根神经根移位术的设计可能要考虑颈7和颈8神经根,或选择颈6部分神经根和颈8部分或全部神经根的组合。今后,我们将针对这样的实验方案进行更为深入的研究。
