白及组织培养初步研究
2019-01-04李玉容
杨 琳,李玉容,张 武,朱 丹
(大理大学农学与生物科学学院,云南大理 671003)
白及Bletilla striata(Thunb.)Rchb.f.为兰科白及属多年生草本植物,白及干燥块茎别名良姜、紫兰。白及在我国主要分布于江西、江苏、甘肃、陕西、四川、云南等地〔1-2〕,其中在云南的分布比较广泛,主要集中分布在文山、曲靖、昆明、玉溪、红河等地区。白及块茎为我国传统中药,可用于治疗咳血、溃疡疼痛、烫伤灼伤、手足皲裂、肺结核、百日咳、食管炎、鼻窦炎、血管瘤等疾病〔3〕。白及还被誉为“美容仙子”,具有美白祛斑、除皱等美容功效,可作为粘稠剂、保湿剂和助乳化剂等用在化妆品中〔4〕。
白及种子在自然野生环境中很难萌发〔5〕,目前主要依靠鳞茎进行繁殖,不仅繁殖率低,供不应求,而且消耗了很多的鳞茎。传统的人工栽培通常采用分株繁殖,其繁殖率较低、周期长,不适宜用于商业化的规模种植,无法满足市场需求,白及现已被列为中国30种稀缺濒危天然药物之一〔6〕。现已有很多学者在白及的组织培养技术,主要针对不同成熟度的白及种子的无菌萌发〔7-9〕、原球茎的生长发育〔10〕、无菌苗生长激素的筛选〔11〕以及最适合生根的相关激素配比等方面展开了研究。目前对白及种子的组织培养研究尚少,本实验采用人工栽培和人工授粉的种子为实验材料,运用植物组织培养技术,采用正交试验,从培养条件、激素配比、有机物添加剂对白及的组织培养进行探索,希望能初步建立起白及组织培养繁殖体系,可以在短时间内获得大量无菌种苗满足市场需求,为白及的组培快繁及产业化栽培提供参考。
1 材料和方法
1.1 材料实验用材料选自云南人工栽培的成熟饱满的白及蒴果。
1.2 方法
1.2.1 种子的春化处理 将成熟的白及蒴果置于4℃的冰箱中保存4 d,打破种子的休眠期,便于种子萌发。
1.2.2 蒴果灭菌与种子接种 成熟未裂开的白及蒴果表面先用洗衣粉水刷洗,再用流水冲洗蒴果约30 min。待表面水分被无菌滤纸吸干后先用75%酒精消毒1 min,再用0.1%的升汞溶液浸泡15 min〔12〕,期间不停摇动。消毒彻底后用无菌水冲洗4~6遍,无菌滤纸吸干表面水分后在无菌条件下用手术刀切开蒴果顶部,用镊子将粉末状种子直接抖落在培养基上,稍加摇动,使种子散布均匀,尽量铺满培养基表面。
1.2.3 白及种子的无菌萌发 以MS和1∕2MS为基本培养基,MS和1∕2MS培养基母液的配制及保存参考文献〔13〕的方法。添加蔗糖30 g∕L,琼脂9 g∕L以及不同浓度的生长调节剂6-苄氨基腺嘌呤(6-BA),6-BA添加量见表1,pH 5.8,每种处理接种10瓶,分别置于光照培养室及暗培养室培养。

表1 白及种子萌发的不同培养基
1.2.4 白及无菌苗的增殖 以MS培养基为基础培养基,采用L9(34)正交试验研究3种对植物生长发育有重要作用的植物生长调节剂:6-BA、萘乙酸(NAA)、激动素(KT)对白及无菌苗增殖的影响,正交试验各因素及水平见表2。每种处理接种10瓶,每瓶接种3株2 cm左右的种子萌发无菌幼苗(切除根),分别于光照培养室及暗培养室培养。

表2 白及无菌苗增殖试验因素水平
1.2.5 白及无菌苗的生根培养 由于白及生根主要受NAA、赤霉酸(GA3)、番茄汁等因素的影响,为了研究白及无菌苗最佳生根培养条件,实验以1∕2MS培养基为基本培养基,采用L9(34)正交试验方法探讨NAA、GA3、番茄汁等2种植物生长调节剂及1种天然复合物对白及无菌苗生根的影响,正交试验各因素及水平见表3。每种处理接种10瓶,每瓶接种2株5 cm左右的无根幼苗。接种后的培养瓶放置到光照培养室培养,培养30 d时记录实验结果。
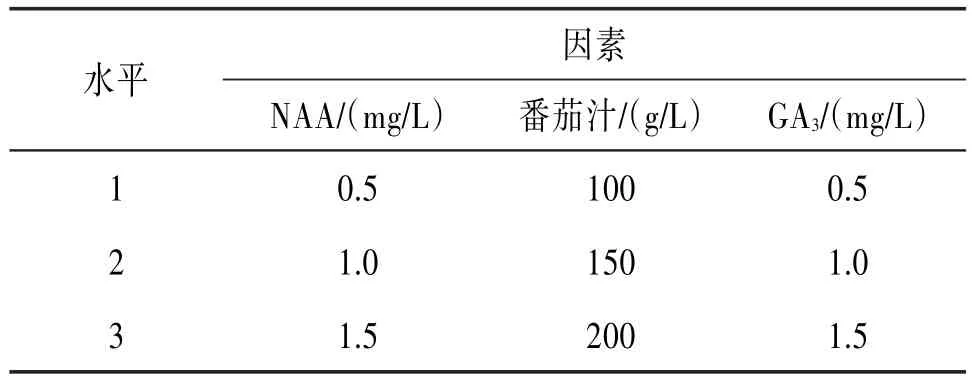
表3 白及无菌苗生根试验因素水平
1.2.6 培养条件 实验涉及的种子无菌萌发、无菌苗增殖及生根培养的光照培养条件为培养温度(25±1)℃,光照强度2 000~2 500 lx,光周期12 h∕d;暗培养条件为全天无光照,温度(25±1)℃。
1.2.7 数据分析方法 用SPSS 16.0统计分析软件对数据进行处理,结合方差对实验数据进行分析。
2 结果
2.1 不同实验处理对白及种子萌发的影响种子萌发过程中,按表1光照处理1、4种子形态变化明显,种子首先吸水膨胀,约5 d后种胚细胞开始分裂,椭圆形种子体积明显增大;约13 d后突破种皮萌发出许多绿色的芽点,且处理4的长势比处理1的长势好,而此时暗处理种子均没有明显变化;20 d后暗处理1、4种子形态开始有所改变,而暗处理2、3、5、6种子表面颜色仍未见明显变化,将其全部转入光照培养室培养25 d后,处理1、4中的小苗长出3片叶子,其他处理也可见萌发迹象,出现绿色芽点。2个月后,1∕2MS培养基与MS培养基中的无菌苗高度相差不大,但MS培养基中有部分无菌苗出现枯萎及生长不良的现象,表明1∕2MS培养基种子萌发效果优于MS培养基。这主要是因为MS培养基中盐溶液较1∕2MS培养基高,高浓度的盐溶液对白及种子萌发会产生一定的毒害作用,1∕2MS培养基盐分浓度相对较低,比较温和,有利于萌发〔14〕,故选用1∕2MS培养基作为种子萌发的基本培养基。
结合6-BA添加量及光照条件等因素分析实验结果发现,6-BA会抑制白及种子的萌发,因此不加任何激素的1∕2MS培养基结合适当光照条件更有利于白及种子的萌发,该实验结果与宋晓丹等〔15〕的研究结果基本相似。但是袁宁等〔16〕通过对比1∕2MS培养基与1∕2MS+6-BA 1.0 mg∕L培养基认为6-BA有利于白及种子萌发,因此对于6-BA对白及种子萌发的影响还需要进一步实验验证。
2.2 不同激素配比对无菌苗增殖的影响按照正交试验的方法,将2 cm左右无根的无菌苗接种到增殖培养基中,光照培养条件下,在培养13 d左右其基部开始膨大,分化出原球茎,无菌苗也缓慢长高,并变得粗壮,颜色浓绿。随着培养时间的延长,原球茎上开始出现小芽点,并慢慢长成丛生芽,在培养40 d后对新生芽进行统计。见表4。实验结果说明,NAA浓度(0.05 mg∕L)较低时有利于无菌苗丛生芽的诱导,6-BA和KT对丛生芽的诱导有促进作用,且对白及无菌苗增殖影响的主次顺序为:NAA>KT>6-BA。诱导白及无菌苗增殖的较适组合为MS+6-BA 1.00 mg∕L+NAA 0.05 mg∕L+KT 1.00 mg∕L,此时白及无菌苗增殖系数达到1.83。但结合方差分析结果发现,6-BA、NAA和KT的F值均<F0.05(2,8),即P>0.05,表明各激素浓度变化差异无统计学意义,因此激素对于无菌苗增殖的具体影响还需要更深入的研究。见表5。

表4 不同激素对无菌苗增殖的影响
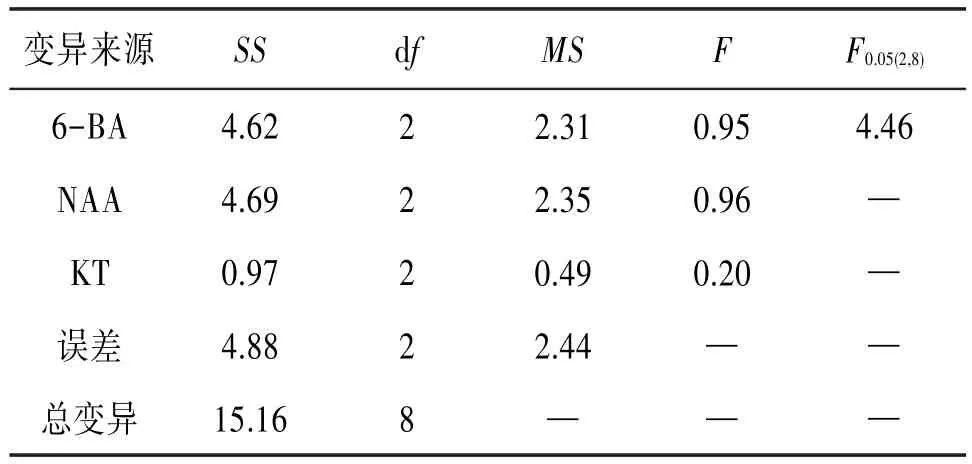
表5 不同激素对无菌苗增殖影响结果方差分析
2.3 不同浓度的添加剂对无菌苗生根的影响NAA属于植物生长调节物中的生长素类,可促进植物根系的分化,常用于植物组织培养以促进无菌苗的生根培养。番茄汁中含有大量的糖类,可为植物细胞分裂分化提供碳源,为植物生根提供所需营养物质。番茄汁中还含有丰富的维生素C和维生素B,可促进外植体的生长和芽的生长。此外,番茄汁加入培养基中可使培养基颜色变深,为无菌苗的生根提供了暗环境,有利于根的生长。GA3可促进幼芽的生长,利于根茎的伸长,当GA3与番茄汁共同作用可促使植株生长健壮,根系发达,有利于移栽和炼苗。将4 cm左右的白及无根苗按正交试验方法接入生根培养基中,10 d左右可看到小苗的基部开始长根,培养35 d后,拔出小苗进行观察统计,正交试验结果见表6。
实验发现NAA 1.0 mg∕L生根效果好,生根率高,每株试管苗生根数多。当NAA浓度达到1.5 mg∕L时,对生根有一定的抑制作用,生根率降低,根系出现卷曲细小现象,根外部出现畸形。结合正交试验结果分析发现,NAA对白及无菌苗生根影响最大,番茄汁次之,GA3影响最小。诱导生根的最佳组合为1∕2MS+NAA1.0mg∕L+GA31.5mg∕L+番茄汁200g∕L,此时生根率达100%,但根部粗壮卷曲,苗枯萎严重。这是因为番茄汁偏酸,使培养基pH降低,在调节pH过程中加入过多的碱,改变了培养基的相关成分,使培养基的渗透势发生改变,最终导致试管苗枯萎。因此,综合生根率和生长状况,本实验番茄汁较适浓度为100 g∕L。结合方差分析,NAA的F值>F0.05(2,8),即P<0.05,说明NAA浓度变化对实验结果影响较大;而番茄汁和GA3的F值均<F0.05(2,8),即P>0.05,表明番茄汁和GA3的浓度变化对实验结果影响不显著。见表7。

表6 不同因素对无菌苗生根的影响

表7 不同因素对无菌苗生根影响结果方差分析
综上,本实验以白及成熟蒴果为外植体对白及组织培养进行了研究。实验结果发现,1∕2MS培养基和适当的光照可使种子萌发速度快,长势好。在增殖过程中,NAA对白及的增殖影响最大,其次是KT,最优组合为MS+6-BA 1.00 mg∕L+NAA 0.05 mg∕L+KT 1.00 mg∕L,增殖系数达到1.83。生根过程中,NAA的浓度对生根率和每株试管苗生根数影响最大,本实验中白及生根的最优组合为1∕2MS+NAA 1.0 mg∕L+GA30.5 mg∕L+番茄汁100 g∕L。
