c-Myc基因在栉孔扇贝年周期发育性腺中的表达特征❋
2019-01-04杨丹丹杨乾坤秦贞奎张志峰
杨丹丹, 邓 春, 杨乾坤, 秦贞奎, 张志峰
(中国海洋大学海洋生物遗传学与育种教育部重点实验室,山东 青岛 266003)
c-Myc(cell-Myc)是一种原癌基因,属于骨髓细胞瘤癌基因(myelocytomatosisviraloncogene,Myc)家族成员。该家族蛋白的羧基端均具有高度保守的螺旋-转角-螺旋(helix-turn-helix,HLH)和亮氨酸拉链(leucine zipper,LZ)组成的结构域[1-2]。在人(Homosapiens)和小鼠(Musmusculus)中,c-MYC作为重要的转录因子在促进细胞增殖、抑制细胞分化和调控肿瘤发生中发挥作用[1,3]。c-MYC通过调节细胞周期中G1/S的过渡促进细胞增殖,并且高水平的c-MYC可间接拮抗细胞周期抑制因子的活性来激活细胞周期[4-5]。正常细胞中,c-Myc通常呈低水平表达;当生物体内的细胞发生染色体转位、基因重排或扩增时会引起DNA损伤,此时c-Myc基因将被激活,其编码的蛋白高水平合成,并导致肿瘤的形成[6-7]。此外,c-MYC更是一种诱导性多能干细胞的重编程因子[8],具有促进染色体解聚,加快细胞增殖,抑制细胞衰老的作用[9-10]。
性腺发育及配子发生是生命繁衍的基础,其受多种因素的精密调控,涉及众多基因的有序参与。c-Myc基因在性腺发育中的研究,目前仅见在文昌鸡(Gallusgallus)中的报道,发现其参与调控文昌鸡的卵巢早期发育及成熟过程[11]。在贝类中,已有报道揭示c-Myc具有广泛的组织分布特点[12-16],并以性腺中的表达水平最高[14-15]。然而,其在贝类性腺中的细胞学定位和相关功能,迄今尚不清楚。本研究以重要经济贝类——栉孔扇贝(Chlamysfarreri)为研究对象,采用RACE技术克隆其全长cDNA序列,采用定量PCR技术,分析其在栉孔扇贝不同发育时期性腺中的表达动力学特征,原位杂交和免疫组织化学手段,揭示了c-MycmRNA及其蛋白在其配子发生过程中的细胞学定位。研究旨在为开展栉孔扇贝c-Myc基因的功能及探究贝类性腺发育及配子发生相关过程的分子机制提供基础数据。
1 材料与方法
1.1 实验动物
栉孔扇贝购自青岛台东南山市场,产地为青岛沙子口。将不同季节购买的二龄性成熟的栉孔扇贝在实验室中暂养3 d后,选取活力良好的个体(壳高(63.9±4.1) mm),解剖取其性腺,剔除其中的消化管并剪成小块。一部分在液氮中速冻后置于-80 ℃ 冰箱中保存,用于总RNA提取;另一部分使用4%多聚甲醛(溶于0.01 mol/L的 PBS 中,pH=7.4)4 ℃ 固定 22 h,于梯度甲醇(25%、50%、75%和无水甲醇,0.01 mol/L PBS 配制,pH=7.4)中脱水后, 置于-30 ℃ 冰箱中保存,用于原位杂交及免疫组织化学实验。
按照廖承义等[17]、Liu等[18]所描述的栉孔扇贝性腺组织学特征,将栉孔扇贝性腺划分为4个发育时期,休止期、增殖期、生长期和成熟期。
1.2 实验方法
1.2.1 总RNA提取和RACE cDNA第一链合成 采用异硫氰酸胍法提取栉孔扇贝成熟期精巢的总RNA,使用RNase-free DNase I消除基因组DNA,紫外光分光光度计和1.2%的琼脂糖凝胶电泳检测总RNA质量。使用SMARTTM-RACE cDNA Amplification Kit(Clontech,美国)并按照操作指南合成RACE cDNA第一链。
1.2.2 目的片段全长cDNA克隆及序列分析 根据栉孔扇贝转录组(NCBI Sequence Read Archive数据库序列号: SRX218546,https://www.ncbi.nlm.nih.gov/sra/SRX218546/)c-MyccDNA序列片段设计RACE特异引物,5’RACE:GTTGAGTC CGTTTGCCCCCCTCACA和3’RACE:GTACGCG GGGAGACTT GCGAAGTGG。以成熟期精巢cDNA为模板,用SMARTTM-RACE cDNA Amplification Kit(Clontech,美国)分别进行5’-和3’-RACE扩增。PCR产物经电泳检测、连接到pMD18-T载体后,转化到大肠杆菌DH5ɑ中,挑取单菌落,送往华大基因进行测序。
使用SeqMan软件将5’-RACE和3’-RACE片段进行拼接,最终获得栉孔扇贝c-Myc全长cDNA序列。使用NCBI中BLAST功能程序分析目的蛋白序列与其他物种c-MYC蛋白序列的一致性。使用Clustal X 2.0和DNAMAN软件对栉孔扇贝c-Myc基因所编码的氨基酸序列与其他12个物种已知的c-MYC氨基酸序列进行多序列比对。使用MEGA 6.0.6软件对栉孔扇贝c-MYC氨基酸序列与其它12个已知物种的c-MYC氨基酸序列以邻位相接法(Neighbor Joining,NJ)构建进化树,设置bootstrap为1 000。
1.2.3 qRT-PCR 按1.2.1的方法提取栉孔扇贝各时期精巢及卵巢总RNA并制备cDNA模板。按照qRT-PCR实验的MIQE指南[19]进行实验,依据栉孔扇贝c-Myc cDNA 全长序列设计一对特异性引物,qRT-S 5’-GGACCACCGACACCACCAG -3’ 和 qRT-A 5’-ATTTCCAGACCACATACAA-3’,扩增片段长度为206 bp(+221~+427,转录起始位点为+1)。以Zhou等[20]报道的栉孔扇贝elongation factor 1 alpha (ef-1α)作为内参基因,引物为 qRT-S 5’-GAAAGCGACAGACAAGCCAC-3’ 和qRT-A 5’-GGTAAGTTCATCAGAGCGAGCA-3’。使用SYBR Premix Ex Taq kit试剂盒(大连,中国)和Roche LightCycler 480荧光定量PCR仪(Roche,瑞士)按照操作指南进行实验。荧光定量PCR 反应条件为:94 ℃预变性5 min,94 ℃ 15 s,60 ℃ 1 min,40 个循环。每组设置3个生物样本重复,每个样本设置3个实验重复,所得数据采用2-ΔΔct法进行分析。所有数据表示为平均值±标准误,使用SPSS Statistic 软件(version 18.0)中的单因素方差分析(One-Way ANOVA)和 Tukey’s HSD检验法进行统计分析,显著性差异水平设为P<0.05。
1.2.4 原位杂交 根据栉孔扇贝c-Myc全长cDNA序列设计一对引物,PCR扩增获得了515 bp的探针序列(+2 063~+2 577)。反向引物Probe-AS:ATTTAGGTGACACTATAGAAGCG GGCAGCTTGTGGTCATTTT(下划线为SP6启动子序列),正向引物Probe-S:TAATACGACTCACTATAGGGAGACA GTTGGTCTGTTAGGCATTT(下划线为T7启动子序列),以成熟期精巢cDNA为模板,PCR扩增条件为94 ℃ 5 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 5 min。回收扩增产物,并按照1.2.2的方法进行测序验证。使用DIG RNA Labeling kit(Roche,瑞士)并按照操作指南进行体外转录,获得c-MycDIG标记的RNA正义和反义探针。
取保存在甲醇中的性腺组织,常规石蜡切片法制备性腺切片,成熟期精巢切片厚度为4 μm,其余时期精巢及各时期卵巢切片为5 μm。使用c-Myc地高辛标记的正义和反义探针,按照刘晓玲[21]的方法并稍加改动进行组织原位杂交,其中蛋白酶K(2 μg/mL,37 ℃)消化10 min,1%中性红复染。Nikon E80i 显微镜下观察并拍照。
1.2.5免疫组织化学 根据栉孔扇贝c-Myc全长cDNA序列设计一对引物,用以扩增其开放阅读框(open reading frame,ORF)序列。正向引物ORF-S:GGATCCATGGTTGTACGGACGTCA(下划线为BamHI酶切位点),反向引物ORF-AS:CTCGAGAAAATCCCTAACTTGAAG(下划线为XhoI酶切位点),以栉孔扇贝成熟期精巢cDNA为模板进行PCR扩增(94 ℃ 5 min;94 ℃ 30 s,57 ℃ 30 s,72 ℃ 1 min,共30个循环;72 ℃ 5 min)。将扩增产物回收后,按照1.2.2的方法进行测序验证。将含有目的基因ORF序列的pMD-18T载体与pET-28a表达载体分别用BamHI和XhoI进行双酶切,回收酶切产物后连接、转化到BL21表达菌中,37 ℃倒置培养过夜。次日按照1∶100接种扩大培养,当OD值在600 nm波长下达到0.5时,加入1 mmol/L异丙基-β-D-硫代半乳糖苷(Isopropyl-β-D-thiogalactoside,IPTG)诱导表达8 h,收集总蛋白。用8 mol/L的尿素溶解包涵体蛋白并用镍柱纯化重组蛋白,将纯化后的蛋白送往上海生工制备兔抗c-MYC多克隆抗体。
通过Western blot检测c-MYC多克隆抗体的有效性和特异性。使用动物组织蛋白提取试剂盒(CoWin,中国)提取成熟期栉孔扇贝精巢的总蛋白,SDS-PAGE电泳后,按照正极-3层滤纸-PVDF膜-SDS-PAGE胶-3层滤纸-负极的顺序依次将其放入转膜仪(BIO-RAD,美国)中22 V电压下转膜20 min。按照1∶1 000的比例将c-MYC多克隆抗体稀释于5%脱脂奶粉中,4 ℃孵育过夜,再用HRP标记的羊抗兔IgG抗体室温孵育2 h,使用DAB显色试剂盒(Roche,瑞士)显色3~5 min,于凝胶成像系统中观察并拍照。
按1.2.4的方法制备组织切片。使用制备的c-MYC蛋白的多克隆抗体,按照Ma等[22]的方法进行免疫组织化学实验,苏木精复染。Nikon E80i 显微镜下观察并拍照。
2 结果
2.1 栉孔扇贝c-Myc全长cDNA及其序列特征
本文获得的栉孔扇贝c-MyccDNA全长为2 943 bp(GenBank序列号:KY765899.1),其中开放阅读框为1 194 bp,共编码397个氨基酸;5’非翻译区为103 bp,3’ 非翻译区为1 646 bp,含有24 bp的poly(A)尾巴。BLAST分析结果显示,栉孔扇贝c-MYC氨基酸序列与已知的其他物种c-MYC序列均有同源性,其中与虾夷扇贝(Patinopectenyessoensis)一致性最高,为97%,与太平洋牡蛎(Crassostreagigas)的一致性为50%,与合浦珠母贝(Pinctadafucata)的一致性为48%,但与脊椎动物的一致性较低,例如与非洲爪蟾(Xenopuslaevis)和人(H.sapiens)的一致性均为29%。多序列比对结果显示,该预测蛋白序列既具有MYC家族所特有的保守结构域,包括羧基末端的螺旋转角螺旋结构域(HLH)和亮氨酸拉链(LZ),同时还具有c-MYC蛋白所特有的Myc-N转录激活区(见图2A)。根据系统进化树可知,栉孔扇贝的c-MYC蛋白首先与虾夷扇贝、合浦珠母贝和太平洋牡蛎聚为一枝,进而与囊舌虫(Saccoglossuskowalevskii)等作为无脊椎动物聚为一类,最后与脊椎动物聚类。栉孔扇贝c-MYC的系统进化与经典的物种进化地位基本一致(见图2B)。
2.2 c-Myc在栉孔扇贝年周期发育性腺中的相对表达量分析
qRT-PCR结果表明,栉孔扇贝c-Myc在性腺的整个年周期发育过程中均有一定水平的表达(见图1)。在卵巢中,c-MycmRNA在休止期的水平较低,随着性腺的发育和成熟,其表达量逐渐升高;成熟期卵巢中的c-MycmRNA水平约为休止期的2.5倍(P<0.05)。在精巢中,休止期的c-MycmRNA水平最低;发育至增殖期,其水平显著提升至休止期的1.5倍(P<0.05),之后,在生长期的精巢中维持该表达水平;至成熟期精巢其表达水平显著低于增殖期和生长期(P<0.05),但略高于休止期精巢的表达水平(见图1)。此外,c-MycmRNA水平在生长期和成熟期的精巢和卵巢中具有显著性差异(P<0.05),尤其是成熟期,卵巢中的表达水平约为精巢的2倍;但在休止期和增殖期的两性性腺中,其表达水平无显著差异。

(所有数据均为平均值±标准误(n=3);休止期精巢中的c-Myc mRNA水平设为标准1,其它数值均为与其的倍数表示。不同字母表示各组数据间存在显著性差异(P<0.05)。Data are indicated as the mean±SEM from three independent samples which are detected in duplicate. The expression level in the testes at resting stage is set as 1.00 to calibrate the relative levels in gonads at other stages. Different letters indicate significant differences from each other (P<0.05).)
2.3 栉孔扇贝c-Myc mRNA和c-MYC蛋白在性腺中的细胞定位
原位杂交结果显示,栉孔扇贝c-MycmRNA在不同发育时期的精巢和卵巢中均检测到阳性信号(见图3 A~H和图4 A~H)。在精巢中,c-MycmRNA主要在精原细胞和精母细胞中表达,在精细胞及成熟精子中未见阳性信号(见图3 A~H)。在卵巢中,该阳性信号主要定位在卵原细胞和各期卵母细胞中(见图4 A~H)。

(Myc-N结构域、HLH结构域和LZ结构域分别用方框标记。Myc-N-box, HLH box and LZ box are boxed.)
Western blot结果显示,栉孔扇贝重组c-MYC蛋白制备的多克隆抗体在成熟期精巢中检测出一条特异性条带,其分子量与栉孔扇贝c-MYC蛋白的理论值(45 kDa)大小基本一致(见图3 I)。使用重组c-MYC蛋白制备的多克隆抗体(见图3 I)进行免疫组织化学检测,结果显示栉孔扇贝c-MYC蛋白在不同发育时期性腺中的细胞学定位(见图3 J~P和图4 I~P)与原位杂交结果基本一致(见图3 A~H和图4 A~H)。

(A~G.反义探针的原位杂交,其中蓝色为阳性信号; A.休止期;B.增殖期;D.生长期;F.成熟期;C、E和G分别为B、D和F的局部放大图;H.正义探针的原位杂交(阴性对照)。I.Western blot检测在栉孔扇贝成熟期精巢提取物中出现一条特异条带(箭头所示);Mar.蛋白marker;1.一抗为c-MYC蛋白多克隆抗体;2.阴性对照,一抗为免疫前血清。J~P、c-MYC多克隆抗体的免疫组织化学,其中棕色为阳性信号;J.休止期;K.增殖期;M.生长期;O.成熟期; L和N分别为K和M的局部放大图;P.免疫前血清的免疫组织化学(阴性对照)。Sg.精原细胞;Sc.精母细胞;St.精细胞;Sz.成熟精子。标尺:μm。A~G. in situ hybridization with the antisense probe, positive signals are indicated in blue; A. resting stage; B. proliferative stage; D. growing stage; F. mature stage; C, E and G. the magnified images of B, D and F, respectively; H. in situ hybridization with sense probe (negative control). I. The specific band as shown with the arrow was detected in testis extracts by Western blot. Mar. Protein molecular weight marker; 1. the first antibody is anti-c-MYC polyclonal antibody; 2. negative control, the first antibody is preimmune serum. The arrow indicates the target band. J~P. immunohistochemistry with anti-c-MYC polyclonal antibody, positive signals are indicated in brown; J. resting stage; K. proliferative stage; M. growing stage; O. mature stage; L and N. the magnified images of K and M, respectively; P. immunohistochemistry with preimmunue serum (negative control). Sg. spermatogonium; Sc. spermatocyte; St. spermatid; Sz. spermatozoon. Scalar bar, μm.)
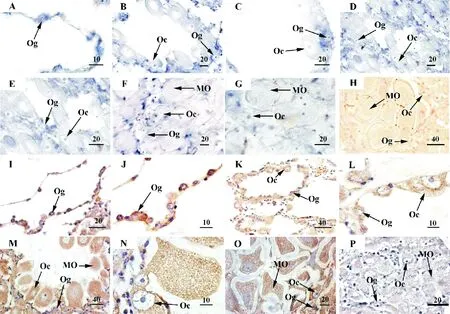
(A~G,反义探针的原位杂交,其中蓝色为阳性信号; A:休止期;B:增殖期;D:生长期;F:成熟期;C、E和G分别为B、D和F的局部放大图;H,正义探针的原位杂交(阴性对照)。I-P,c-MYC多克隆抗体的免疫组织化学,其中棕色为阳性信号;I,休止期;K,增殖期;M,生长期;O,成熟期;J、L和N分别为I、K和M的局部放大图;P,免疫前血清的免疫组织化学(阴性对照)。Og:卵原细胞;Oc:卵母细胞;MO:成熟卵。标尺:μm。A~G, in situ hybridization with the antisense probe, positive signals are indicated in blue; A, resting stage; B, proliferative stage; D, growing stage; F, mature stage; C, E and G, the magnified images of B, D and F, respectively; H, in situ hybridization with sense probe (negative control). I-P, immunohistochemistry with anti-c-MYC polyclonal antibody, positive signals are indicated in brown; I, resting stage; K, proliferative stage; M, growing stage; O, mature stage; J, L and N, the magnified images of I, K and M, respectively; P, immunohistochemistry with preimmunue serum (negative control). Og, oogonium; Oc, oocyte; MO, mature oocyte. Scalar bar, μm.)
3 讨论
本文通过RACE技术获得栉孔扇贝c-MyccDNA全长,共2 943 bp,其中ORF 1 194 bp。在该序列所推导的氨基酸序列中含有Myc家族保守的位于羧基末端的螺旋转角螺旋结构域(HLH)和亮氨酸拉链(LZ)[1-2],同时还具有c-MYC蛋白所特有的Myc-N转录激活区[1]。同源对比结果显示,栉孔扇贝c-MYC蛋白与无脊椎动物c-MYC蛋白具有较高的一致性。初步确定本研究所获得的序列为栉孔扇贝c-MyccDNA全长。
贝类种类繁多,生殖方式多样,既有雌雄异体(栉孔扇贝)也有雌雄同体(海湾扇贝),一些物种(牡蛎等)甚至具有性逆转特征[23],因此研究其性腺发育、性别分化和配子发生相关基因,对于揭示其多样的生殖方式形成机制是十分重要的。本研究采用定量PCR、原位杂交和免疫组织化学技术,确定c-Myc在栉孔扇贝不同发育时期精巢和卵巢中均有明显的表达(见图2~4)。栉孔扇贝c-MycmRNA的水平在成熟期前的精巢和卵巢中均随着性腺发育的进程逐渐升高,但其在成熟期精巢和卵巢中的表达则呈显著性差异,即卵巢中的表达水平显著高于精巢(见图2)。韩威等[11]采用qRT-PCR检测了文昌鸡母鸡个体早期发育和性成熟过程中卵巢c-Myc的表达,结果显示其在个体发育早期的卵巢(11~12周龄)中表达水平显著高于个体性成熟启动时期的卵巢(13周龄)(P<0.05),后者仅为12周龄的20%。随着卵巢发育成熟至开产期(15周龄)时,卵巢中的c-Myc表达量显著提高(P<0.05),并且随着发育的进行,其表达量显著高于个体发育早期卵巢中的表达水平(P<0.05),这一表达特征与栉孔扇贝不同。由于当前有关c-Myc在动物性腺发育过程中的表达特征仅见文昌鸡中的报道,因此这种表达特征的规律性尚有待更多的研究数据才能定论。
在栉孔扇贝精巢中,c-MycmRNA和c-MYC蛋白明显的阳性信号均定位在精原细胞和精母细胞中,而在精细胞及成熟精子中未见阳性信号(见图3)。这种差异的细胞学定位,可能暗示c-Myc基因在精子发生过程中发挥作用。在小鼠的成纤维细胞和胚胎干细胞以及人的B细胞和骨髓细胞中,研究者发现c-MYC可以通过调节细胞周期中G1/S的过渡以加速细胞增殖,并且高水平的c-MYC可间接拮抗细胞周期抑制因子p21和p27的活性,从而激活细胞周期[4-5, 24]。Wang等[25]通过在体内和体外分别敲降乳腺癌细胞中的c-MycmRNA水平,发现该细胞的增殖减缓,细胞的生长率降低50%~60%。在动物的精子发生过程中,细胞增殖主要发生在精原细胞和精母细胞中,即精原细胞通过增殖产生更多的精原细胞;初级精母细胞通过第一次减数分裂产生次级精母细胞,后者再进行一次分裂产生2个精细胞,精细胞不再分裂而直接分化为精子。根据本研究中c-Myc基因在精巢中的细胞定位特点,我们推测其可能参与栉孔扇贝精子发生过程中的细胞增殖调控。然而,对于c-Myc基因在栉孔扇贝卵巢中广泛表达的意义,我们尚无法解释,有待进一步的研究和阐释。
