茶渣硒蛋白的分离纯化及其性质研究
2019-01-03杨旭谢盈
杨 旭 谢 盈
(1. 安康学院现代农业与生物科技学院,陕西 安康 725000;2. 陕西省富硒食品工程实验室,陕西 安康 725000)
茶渣是茶叶经过加工利用后或成品茶经冲泡饮用后的剩余残渣。中国有众多茶饮料、茶多酚、速溶茶生产厂家,每年这些厂家产生的茶叶湿废渣达几十万吨之多[1]。依托于中国第二大富硒区安康独特的地理地质环境,茶叶作为当地名优资源具备天然富硒特色[2-3]。富硒茶中硒的主要赋存形式为硒蛋白,占总硒含量的60.12%,但茶叶中的硒蛋白多为碱溶性,经水浸泡无法溶出而留于茶渣中,占茶渣总量的23.81%之高[4]18。已报道的文献[4]42-48 [5-6][7]11-17多是对普通茶渣中蛋白的提取及功能性质分析,以及富硒茶叶、茶粉中硒蛋白的提取工艺优化,而关于富硒茶茶渣中硒蛋白的分离纯化、性质研究却未见报道,相关基础研究的缺乏制约了富硒茶渣资源的开发利用。
本试验拟以碱提法对紫阳富硒茶冲泡后剩余茶渣中的硒蛋白进行提取,利用脱色、沉淀等方法初步分离纯化硒蛋白,并对制备得到的纯化硒蛋白中硒有机化程度、氨基酸组成、功能特性及抗氧化活性进行了分析。以期明确硒蛋白的分离纯化工艺和相关性质,为茶渣作为茶蛋白的优质资源和硒的富集资源应用于食品加工领域提供研究依据,从而寻求富硒茶及其产品研发的新方向。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
富硒绿茶:安康紫阳向阳茶厂;
硝酸、盐酸:优级纯,成都科龙化工试剂厂;
牛血清白蛋白(BSA):上海江莱生物科技有限公司;
1, 1-二苯基-2-苦肼基(DPPH)、2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)(ABTS):日本TCI公司;
XDA-7大孔吸附树脂:郑州和成新材料科技有限公司;
硒标准储备液:1 000 μg/mL,国家标准物质研究中心;
其他试剂均为分析纯。
1.1.2 主要仪器设备
紫外可见分光光度计:TU-1901型,北京普析通用仪器有限责任公司;
低速离心机:LD4-2A型,北京医用离心机厂;
恒温振动水浴锅:SHA-C型,常州国华电器有限公司;
电热恒温鼓风干燥箱:GZX-GF101-2-BS型,上海跃进医疗器械有限公司;
旋转蒸发仪:RE-52AA型,上海亚荣生化仪器厂;
原子荧光光度计:AFS-930型,北京吉天仪器有限公司;
小型控温加热板:ECH-Ⅱ型,上海新仪微波化学科技有限公司;
温压双控微波消解仪:MDS-6型,上海新仪微波化学科技有限公司;
真空冷冻干燥机:SCIENTZ-50N型,宁波新芝生物科技股份有限公司;
全自动氨基酸分析仪:L-8900型,日立高新技术公司。
1.2 试验方法
1.2.1 原料预处理 富硒绿茶原料按浸泡温度85 ℃、浸泡时间30 min、冲泡2次、料液比110∶1 (mL/g)的方式[8]进行冲泡后,剩余茶渣置于恒温干燥箱中,50 ℃下干燥至恒重,粉碎过60目筛备用。
1.2.2 茶渣硒蛋白的提取 称取上述茶渣样品1 g,根据预试验所得的优化提取工艺,用0.075 mol/L NaOH溶液,按1∶60 (g/mL)的料液比于54.2 ℃下水浴振荡提取4 h,抽滤后浸提液在45 ℃下旋转蒸发,冷冻干燥。
1.2.3 蛋白质含量的测定 采用考马斯亮蓝G-250法[9],以BSA标准品溶液的浓度为横坐标,吸光度为纵坐标,绘制标准曲线。在同样的反应条件下,取1 mL浸提液进行测定。
1.2.4 茶渣硒蛋白的脱色工艺
(1) 脱色效果的指标测定:根据吴芳[10]的脱色效果评价方法略作修改,采用紫外分光光度计在190~1 100 nm波长内进行光谱扫描,确定最大吸收峰对应波长为216 nm,并在此波长下测定脱色前后浸提液的吸光度,按式(1)、(2)计算脱色率和蛋白质损失率。
DR=[(A1-A2)/A1]×100%,
(1)
式中:
DR——脱色率,%;
A1——脱色前浸提液吸光度;
A2——脱色后浸提液吸光度。
LR=[(P1-P2)/P1]×100%,
(2)
式中:
LR——蛋白质损失率,%;
P1——脱色前浸提液中的蛋白质含量,μg/mL;
P2——脱色后浸提液中的蛋白质含量,μg/mL。
(2) 活性炭脱色法:分别按5∶100,10∶100,15∶100,20∶100,25∶100,30∶100 (g/mL)的比例向浸提液中添加处理活化的活性炭,于90 ℃恒温水浴下脱色1 h,抽滤后收集脱色液,测定脱色率和蛋白质损失率。
(3) 双氧水脱色法:分别按0.5,1.0,2.0,3.0,4.0,5.0 mL/100 mL 的比例向浸提液中添加体积分数为30%的双氧水溶液,室温下放置于磁力搅拌器上搅拌反应30 min,转速为200 r/min,而后静置30 min,测定脱色率和蛋白质损失率,选取最适的双氧水用量。
(4) XDA-7大孔树脂脱色法:根据王丹[11]12的大孔树脂脱色法修改如下,预处理后的XDA-7大孔树脂采用湿法装柱(Φ2.5 cm×40 cm),取蛋白质浓度6.69 mg/mL的茶渣硒蛋白浸提液100 mL进样,速度控制为1 BV/h。然后用质量浓度为2%的NaOH溶液洗脱至280 nm下无蛋白质特征吸收,收集洗脱液并浓缩至100 mL,测定脱色率和蛋白质损失率。
按确定的双氧水用量向浸提液中添加后,分别于20,30,40,50,60 ℃下搅拌反应30 min后,静置30 min,测定脱色率和蛋白质损失率,选取最适的反应温度。
1.2.5 茶渣硒蛋白的沉淀工艺 根据陆晨[7]15的等电点沉淀法修改如下:向 5 支 30 mL 离心管中各加入20 mL 浸提液,分别调节pH至2.0,2.5,3.0,3.5,4.0,4.5,5.0,室温下静置30 min,并于4 000 r/min离心30 min,弃去上清液后干燥称重,从而确定最适沉淀点。
1.2.6 茶渣硒蛋白性质
(1) 硒有机化程度:硒元素含量测定参照文献[12]。准确称取茶渣硒蛋白样品2 g,测定其总硒含量后,添加浓盐酸与水按体积比1∶1混合得到的盐酸溶液20 mL,超声波功率250 W下辅助浸提30 min,再于沸水浴中浸提30 min,冷却后经脱脂棉过滤,测定滤液中无机硒含量,并利用减差法[13]按式(3)计算硒有机化程度。
ROSe=[(TSe-ISe)/TSe]×100%,
(3)
式中:
ROSe——硒有机化程度,%;
TSe——总硒含量,μg/g;
ISe——无机硒含量,μg/g。
(2) 氨基酸组成测定:按GB 5009.124—2016执行。
(3) 溶解性:参照文献[14]。
(4) 乳化性和乳化稳定性:参照文献[7]17,配制1 mg/mL 的茶渣硒蛋白液,并调节pH至7.0进行测定。
(5) 起泡性和泡沫稳定性:参照文献[7]17-18,配制1 mg/mL 的茶渣硒蛋白液,并调节pH至7.0进行测定。
(6) DPPH自由基清除活性:参照文献[15]。
(7) ABTS自由基清除活性:参照文献[16]。
(8) 羟基自由基清除活性的测定:采用Fenton-水杨酸反应体系[15],以紫外分光光度法对其活性进行评价。
1.2.7 数据分析 所有数据以(均值±标准差)表示,每次样品的测定均重复3次。采用SPSS 19.0进行方差分析和差异显著性分析(P<0.05即为差异显著)。
2 结果与分析
2.1 茶渣硒蛋白的脱色工艺确定
2.1.1 活性炭脱色 图1为茶渣硒蛋白浸提液脱色率和蛋白质损失率随活性炭添加量的变化曲线。在受试添加量范围内,脱色率明显低于蛋白质损失率,且两者均随添加量的增加而提高。当添加量达到25 g/100 mL时,脱色率和蛋白质损失率分别为(47.74±0.40)%和(52.16±0.78)%,而后趋于稳定。这可能是浸提液中的呈色物质与蛋白质结合,被活性炭共同吸附导致。

不同字母表示相互之间差异显著(P<0.05)
Figure 1 Effect of activated carbon dosage on decolorization rate and protein loss rate of selenium-protein extracts from tea residue
2.1.2 双氧水脱色 双氧水添加量对茶渣硒蛋白浸提液脱色率和蛋白质损失率的影响如图2所示。脱色率随添加量的增加呈先升高后降低的趋势,当添加量为4.0 mL/100 mL 时,脱色率达到最高(74.07±0.79)%。蛋白质损失率则随添加量的增加而升高,在4.0~5.0 mL/100 mL 时趋于稳定。因此,双氧水脱色的最适添加量为4.0 mL/100 mL。

不同字母表示相互之间差异显著(P<0.05)
Figure 2 Effect of hydrogen peroxide dosage on decolorization rate and protein loss rate of selenium-protein extracts from tea residue
图3表明双氧水脱色温度对脱色效果指标的影响。从图3可以看出,脱色率和蛋白质损失率均先随反应温度的升高而增大,当反应温度为50 ℃时,脱色率达到最高为(93.78±0.84)%,此时蛋白质损失率为(44.60±0.66)%。随后,反应温度继续升高,导致双氧水部分分解,脱色率降低,蛋白质损失率则持续增加。因此,确定最适的反应温度为50 ℃。

不同字母表示相互之间差异显著(P<0.05)
Figure 3 Effect of hydrogen peroxide decolorization temperature on decolorization rate and protein loss rate of selenium-protein extracts from tea residue
2.1.3 3种方法的脱色效果比较 在确定的活性炭、双氧水脱色工艺基础上,对茶渣硒蛋白浸提液脱色,大孔树脂脱色则按1.2.4(3)所述方法进行。3种方法的脱色效果如表1所示。
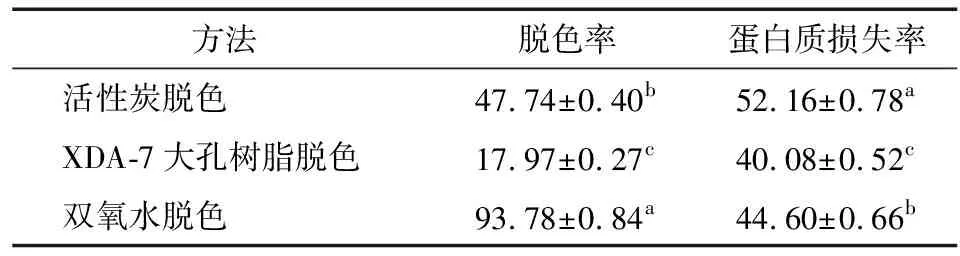
表1 3种方法对茶渣硒蛋白浸提液的脱色效果†
† 同列不同字母表示差异显著(P<0.05)。
3种脱色方法中,双氧水脱色法的脱色率明显高于活性炭和XDA-7大孔树脂脱色法,而蛋白质损失率则位于两者之间。活性炭和XDA-7大孔树脂脱色法对茶渣硒蛋白提取液的脱色效果不理想,表明其中的呈色物质并非以游离状态存在,而是与蛋白质等物质结合,造成脱色困难,且蛋白质损失率较高[11]29-30。双氧水的强氧化作用使呈色物质氧化分解,形成低分子物质,而使脱色效果明显。因此,选择双氧水脱色法对茶渣硒蛋白进行脱色。
2.2 茶渣硒蛋白的沉淀工艺确定
表2为不同pH下茶渣硒蛋白沉淀量和沉淀率的测定结果。随着pH值的增加,沉淀量和沉淀率的变化趋势一致。当pH 3.5时,茶渣硒蛋白沉淀量最大,为(26.7±0.37) mg,此时沉淀率为(61.33±0.86)%,说明pH 3.5是茶渣硒蛋白的最适沉淀点。
表2茶渣硒蛋白的最适沉淀点结果†
Table 2 Results of optimal precipitation point of selenium-protein from tea residue

pH沉淀量/mg沉淀率/%2.015.9±0.18g36.60±0.41g2.519.3±0.31e44.42±0.71e3.022.5±0.43c51.77±0.99c3.526.7±0.37a61.33±0.86a4.023.5±0.36b54.15±0.82b4.520.4±0.45d46.90±1.04d5.017.2±0.39f39.51±0.90f
† 同列不同字母表示差异显著(P<0.05)。
2.3 茶渣硒蛋白的性质
2.3.1 硒有机化程度 根据DB61/T 556—2012 富硒食品及相关产品硒含量标准中富硒茶叶、代用茶及含茶制品硒含量为0.15~5.00 mg/kg,确定本研究选用的茶叶原料达到富硒标准。从表3中可知,茶渣硒蛋白中硒的含量占总硒的22.41%,表明了茶渣作为补硒资源的再利用价值。富硒茶原料和茶渣硒蛋白的硒有机化程度分别达到79.47%和79.37%,说明确定的脱色、沉淀工艺未对硒的赋存形态产生影响,且两者作为膳食补硒源,具有毒性小,硒的吸收率和生物利用率高等特点[17]。
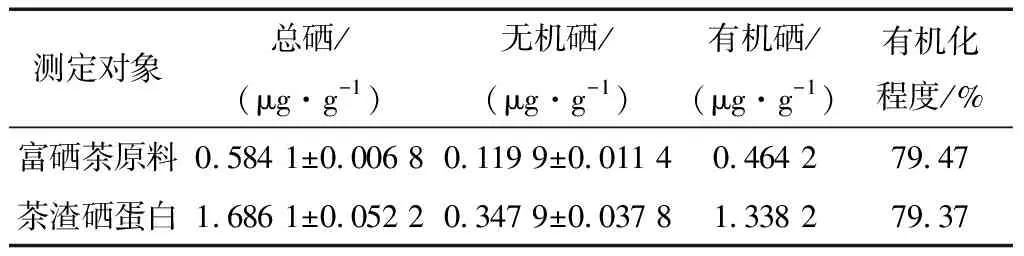
表3 茶渣硒蛋白中硒有机化程度
2.3.2 氨基酸组成 茶渣硒蛋白的氨基酸组成及含量测定结果如表4所示。测定所含有的16种氨基酸中,包括7种必需氨基酸;必需氨基酸与非必需氨基酸的比值(EAA/NEAA)、必需氨基酸与总氨基酸的比值(EAA/TAA)分别为73.88%和42.49%;谷氨酸的含量最高,占总氨基酸的13.01%,其次是天门冬氨酸和亮氨酸,分别为10.47%和10.00%,而蛋氨酸含量最低,为0.82%。从氨基酸的化学性质分类来看,疏水性氨基酸含量达46.04%,表明茶渣硒蛋白具有高疏水性;其他分类的含量变化为:酸性>碱性>不带电极性。依据FAO/WHO氨基酸参考模式[18]分析,除蛋氨酸+胱氨酸低于推荐值,苏氨酸、赖氨酸、异亮氨酸、缬氨酸、苯丙氨酸+酪氨酸、亮氨酸均高于参考标准,具有较高的营养价值。
2.3.3 功能特性 图4为茶渣硒蛋白在不同pH值下的溶解性测定结果。在pH 4时,氮溶解性指数最低,此后随pH的升高而增加,与茶渣硒蛋白的碱溶性一致。受试pH范围内,氮溶解性指数为(28.35±0.85)%~(52.99±1.59)%,与茶渣硒蛋白较高的疏水性氨基酸含量有关。因此,茶渣硒蛋白在食品加工中的应用,可通过改性的方式提高溶解度来实现。
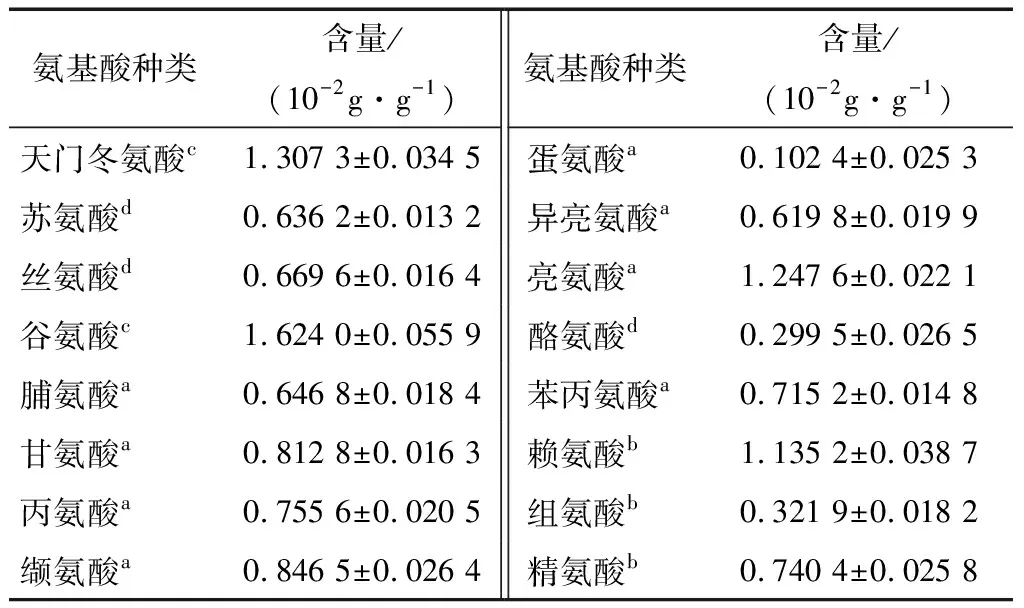
表4 茶渣硒蛋白的氨基酸组成†
† a. 疏水性氨基酸;b. 碱性氨基酸;c. 酸性氨基酸;d. 不带电极性氨基酸。

图4 pH对茶渣硒蛋白氮溶解指数的影响
Figure 4 Effect of pH on nitrogen solubility index of selenium-protein from tea residue
茶渣硒蛋白的乳化和起泡性质见表5。从测定结果来看,茶渣硒蛋白具有较好的乳化性,但低于同条件下的大豆分离蛋白(76.4%),对乳状液的稳定能力则优于大豆分离蛋白(63.1%);起泡性能较差,这与茶渣硒蛋白的溶解性较差有关,维持泡沫的稳定能力较好,但明显低于大豆分离蛋白(87.4%)[19]35-36。
2.3.4 抗氧化活性 由图5可知,茶渣硒蛋白对DPPH、ABTS和羟基自由基均具有不同程度的清除活性。在受试浓度范围内,随着样品浓度的增加,清除率均呈持续增强的趋势,DPPH、ABTS和羟基自由基清除率的IC50值分别为(0.339 7±0.002 5),(0.508 0±0.012 1),(0.305 0±0.002 0) mg/mL。因此,对3种自由基的清除能力表现为:羟基自由基>DPPH自由基>ABTS自由基,且对前两者的清除率均高于李永富[20]31-33报道的茶渣蛋白的,可能是硒与蛋白之间的协同抗氧化作用[21]。

表5 茶渣硒蛋白的乳化和起泡性质

图5 茶渣硒蛋白的DPPH、ABTS和羟基自由基清除活性
Figure 5 DPPH, ABTS and hydroxyl radical scavenging activity of selenium-protein from tea residue
3 结论
茶渣硒蛋白在碱提过程中,多酚类物质在碱性、湿热条件下发生氧化反应,使浸提液形成褐色。采用双氧水脱色,在添加量为4.0 mL/100 mL、50 ℃下,可达到(93.78±0.84)%的理想脱色率。pH 3.5下经等电点沉淀所得的茶渣硒蛋白的性质研究结果表明,其是富硒茶中硒元素的主要富集部位,且有机化程度可达79.37%,满足了安全补硒的要求;氨基酸组成全面,EAA/NEAA、EAA/TAA的比例符合WHO/FAO的理想模式,谷氨酸、甘氨酸、天门冬氨酸、精氨酸等功能氨基酸均有较高含量;与报道的其他植物蛋白[19]5,35-36[22]的同种功能特性比较,乳化性、乳化稳定性和泡沫稳定性较高,溶解性和起泡性则较低,说明其作为乳化剂应用于食品加工中的潜在可能性;还具有显著的抗氧化活性,DPPH、ABTS和羟基自由基的清除率均表现出浓度依赖性。与以往的研究[7]44[19]39[20]41-42相比,本研究对富硒茶茶渣中与硒结合蛋白的性质进行了考察,关注了脱色、沉淀工艺对硒形态的影响;硒元素的研究中,添加有机化程度指标以表征硒源的安全性。后续可对茶渣硒蛋白通过改性提高功能特性,并在具体食品模型的应用中进行研究,以利于其资源的合理利用和富硒茶的全面开发。
