鞘内阻断趋化因子配体12/趋化因子受体4趋化因子轴对选择性神经损伤模型大鼠前扣带皮层中胶质细胞原纤维酸性蛋白质表达的影响
2019-01-03黄雪花戴丽华杨悦橙
黄雪花 戴丽华 杨悦橙 马 柯
神经病理性疼痛(NP)是由躯体感觉系统的损伤或疾病引起的疼痛。NP疼痛程度剧烈,临床治疗效果欠佳,发病机制复杂不清,中枢敏化是其重要的发病机制之一。研究结果表明,星形胶质细胞在中枢敏化中具有重要作用[1],胶质细胞原纤维酸性蛋白(GFAP)是中枢神经系统中星形胶质细胞的特征性标志物,而趋化因子在NP中具有重要作用[2]。趋化因子受体(CXCR)4在体内大部分组织和器官上都有表达,趋化因子配体(CXCL)12/CXCR4趋化因子轴参与体内多种生理或病理生理功能,包括NP、人类免疫缺陷病毒侵染、造血功能、胚胎发育和肿瘤迁移等,因此趋化因子及其受体可能成为疾病治疗新的分子靶点。本研究建立选择性神经损伤(SNI)模型,观察造模后大鼠前扣带皮层(ACC)中GFAP的表达情况,并观察鞘内注射CXCR4抑制剂AMD3100阻断CXCL12/CXCR4趋化因子轴对大鼠ACC中GFAP表达和大鼠痛觉超敏的影响,旨在为治疗NP提供新的理论依据。
1 材料与方法
1.1 实验动物 96只健康、清洁级雄性Sprague-Dawley(SD)大鼠由上海交通大学医学院附属新华医院动物实验中心提供,体重220~260 g,动物生产许可证号为SCXK(沪)2013-0016,动物使用许可证号为SYXK(沪)2013-0106。
1.2 主要仪器和试剂 化学发光成像系统(型号为Chemidoc XRS,美国Bio-Rad公司),Western凝胶电泳套件(EPS-300,上海精密仪器仪表公司),全波长酶标仪(BIO-TEK,上海旦鼎国际贸易有限公司),荧光显微镜(DMI-3008,德国Leica公司)。AMD3100(批号为 A5602,美国Sigma公司),抗 GFAP抗体(英国 Abcam 公司),抗GAPDH抗体(上海碧云天生物技术有限公司)。
1.3 分组 将96只大鼠饲养于空气过滤系统适应环境2 d,随机分为假手术未治疗组、假手术治疗组、SNI未治疗组、SNI治疗组,每组24只。
1.4 鞘内置管和利多卡因测试 于大鼠腹腔内注射10%水合氯醛(290~340 mg/kg)麻醉后,将其妥善固定,在L4与L5间隙处消毒,作长1.0~1.5 cm的皮肤纵向切口,依次切开皮肤和浅筋膜,显露肌层,在棘突旁用尖刀背部钝性分离附着于L4至L5棘突一侧的肌肉,暴露白色椎板,在L4与L5两关节突结合处内侧,用无齿镊子夹着聚乙烯硬膜外导管前端,轻柔地将导管向上置入。如置管顺利,则大鼠会出现甩尾反射,此时导管内可见清亮的脑脊液流出。鞘内置管后第2天行利多卡因测试。取出并剪除聚乙烯导管盲端,应用25μL微量注射器注射2%利多卡因7μL,以大鼠双下肢出现暂时性瘫痪现象作为鞘内置管成功的标志。
1.5 SNI动物模型的制备和AMD3100鞘内注射 根据Decosterd和Woolf[3]描述的方法,于大鼠腹腔内注射10%水合氯醛(290~340 mg/kg)后,将其置于俯卧位,常规消毒铺巾,纵向切开左侧大腿的皮肤、浅筋膜,断开股二头肌,充分暴露坐骨神经及其末端腓肠神经、腓总神经和胫神经分支。SNI未治疗组和SNI治疗组用5/0丝线分别结扎腓总神经和胫神经并予切断,保留腓肠神经完整;假手术未治疗组和假手术治疗组仅暴露但不结扎神经。术后均肌内注射青霉素4万~5万U预防感染。假手术治疗组和SNI治疗组术后鞘内连续注射AMD3100 10μL(含AMD3100 1μg,每天1次,连续2周),假手术未治疗组和SNI未治疗组在同时间点鞘内注射等量0.9%氯化钠溶液。
1.6 机械性刺激缩足阈值(PWT)测定 根据Tal等[4]的方法,于SNI术前和首次注药后7、14、21、28、35 d上午测定大鼠PWT。将大鼠放置在有机玻璃箱(86 cm×20 cm×14 cm)内,箱的底面为有孔的金属筛网,让大鼠在有机玻璃箱内适应30 min后,用von-Frey细丝(美国North Coast Medical公司)垂直刺激大鼠左后足底部外侧皮肤,刺激值由小逐渐增大,大鼠出现抬足或舔足行为视为阳性反应,记录出现阳性反应时的刺激数值,循环测试3次取平均值。
1.7 ACC取材和海马中GFAP蛋白质水平检测①Western印迹法检测ACC中GFAP蛋白质表达水平:每组分别于首次注药后14、21、28、35 d各取4只大鼠,腹腔内注射麻醉后用铡刀快速断头,用咬骨钳钳掉大脑两侧的颅骨,剥除脑膜,取出完整的大脑,分离ACC,随即放入液氮中保存备用。称取等量组织标本后,按比例加入蛋白酶抑制剂和细胞裂解液,组织匀浆后,4℃12 879×g离心15 min,取上清液,采用二辛可宁酸法(BCA法)测定蛋白质浓度。加入十二烷基硫酸钠上样缓冲液,变性30 min(55℃),蛋白质电泳转至聚偏二氟乙烯膜,转膜75 min(恒流300 m A),5%脱脂牛奶室温封闭2 h,一抗4℃摇床孵育过夜(GFAP 1∶5 000,GAPDH 1∶8 000)。以Tris-HCl缓冲盐溶液(TBS)+吐温(TBST)缓冲液冲洗3次,每次10 min;HRP酶标二抗室温孵育1 h;再次以TBST缓冲液冲洗3次,每次10 min;ECL显色曝光。以内参照与目标蛋白质的灰度比值表示目的蛋白质的相对表达量。② 免疫荧光法观察ACC中GFAP蛋白质表达情况:每组分别于首次注药后14、28 d各取4只大鼠,在腹腔内注射麻醉后,将大鼠冲洗至通体变白,以4℃4%多聚甲醛溶液约300 m L灌注固定,灌注时间为20~25 min。灌注完毕后取出完整的大脑,固定和脱水后包埋制作冰冻切片。将30μm切片经5%驴血清加0.3%Triton X-100封闭破膜0.5 h后,将GFAP 1∶1 000加入1% 牛血清白蛋白(BSA)4℃孵育过夜,荧光标记二抗37℃孵育45 min,置于荧光显微镜下观察并拍照。细胞扁平、胞体突起较多较粗,有多个分枝,荧光染色深者为阳性细胞。
1.8 统计学处理 应用SPSS 16.0统计学软件。呈正态分布的计量资料以±s表示。4组PWT总趋势比较采用重复测量方差分析,成组设计的多个样本均数的比较采用单因素方差分析。以P<0.05为差异有统计学意义。
2 结 果
2.1 PWT的变化 术前4组间PWT基础值的差异均无统计学意义(P值均>0.05),SNI未治疗组首次注药后7、14、21、28、35 d的PWT值均显著低于假手术未治疗组和假手术治疗组同时间点(P值均<0.01),SNI治疗组首次注药后14、21、28、35 d的PWT值均显著高于SNI未治疗组同时间点(P值均<0.01)。见表1。
表1 4组大鼠术前和注药后各时间点的PWT值比较 (N=24,±s,g)

表1 4组大鼠术前和注药后各时间点的PWT值比较 (N=24,±s,g)
与假手术未治疗组比较:①P<0.01;与假手术治疗组比较:②P<0.01;与SNI未治疗组比较:③P<0.01
组别 术前 首次注药后7 d 首次注药后14 d 首次注药后21 d 首次注药后28 d 首次注药后2 23.42±3.08 24.41±0.29假手术治疗 24.01±4.52 22.52±3.18 23.31±2.91 24.19±2.85 23.51±3.86 23.82±4.21 SNI未治疗 23.46±4.82 4.72±4.43①② 3.67±1.67①② 4.44±1.67①② 4.80±1.79①② 5.33±1.15①②SNI治疗 23.80±4.61 8.28±5.43 6.71±2.55③ 7.64±1.75③ 8.25±1.28③ 8.00±1.63 35 d假手术未治疗 23.12±3.12 21.67±5.02 21.60±4.02 23.84±4.9③
2.2 Western印迹法检测ACC中GFAP蛋白质水平 首次注药后14和21 d,4组间大鼠ACC中GFAP蛋白质相对表达量的差异均无统计学意义(P值均>0.05)。首次注药后28和35 d,SNI未治疗组大鼠ACC中GFAP蛋白质相对表达量均显著高于假手术未治疗组和假手术治疗组同时间点(P值均<0.05),SNI治疗组大鼠ACC中GFAP蛋白质相对表达量均显著低于SNI未治疗组同时间点(P值均<0.05),假手术未治疗组与假手术治疗组间大鼠ACC中GFAP蛋白质相对表达量的差异均无统计学意义(P值均>0.05)。见表2。
表2 4组大鼠注药后各时间点ACC中GFAP蛋白质相对表达量比较 (N=4,±s)

表2 4组大鼠注药后各时间点ACC中GFAP蛋白质相对表达量比较 (N=4,±s)
与假手术未治疗组比较:①P<0.05;与假手术治疗组比较:②P<0.05;与SNI未治疗组比较:③P<0.05
组别 首次注药后14 d 首次注药后21 d 首次注药后28 d 首次注药后1.00±0.00 1.00±0.00 1.00±0.00 1.00±0.00假手术治疗 1.02±2.21 1.08±2.89 1.16±2.05 1.03±3.14 SNI未治疗 1.01±0.12 1.19±0.87 2.69±2.98①② 2.62±4.87①②SNI治疗 1.12±0.32 1.28±0.11 1.28±2.13③ 1.34±0.02 35 d假手术未治疗③
2.3 免疫荧光法观察ACC中GFAP的蛋白质表达 在首次注药后14 d时,4组大鼠ACC中GFAP蛋白质表达无明显异常;而在首次注药后28 d时,SNI未治疗组大鼠ACC中GFAP蛋白质表达明显增多,主要表现为阳性细胞数增多,着色较深。见图1。
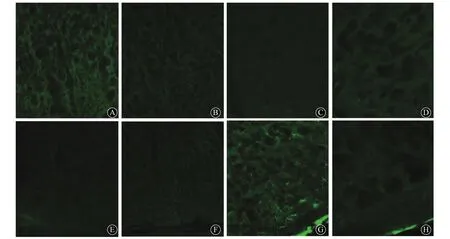
图1 4组大鼠首次注药后14和28 d时ACC中GFAP蛋白表达(免疫荧光染色,×400)
3 讨 论
本研究结果提示,鞘内阻断CXCL12/CXCR4趋化因子轴可以引起中枢神经系统ACC中GFAP表达水平降低,缓解NP的症状。
NP的一个重要发病机制是中枢敏化。研究[5]结果表明,除神经元之外,神经元周围的胶质细胞(星形胶质细胞和小胶质细胞)在慢性疼痛中枢敏化的产生和维持中发挥着不可忽视的作用。在正常情况下,神经系统中的星形胶质细胞和小胶质细胞处于未激活状态,但在神经损伤或神经系统疾病时会被激活,处于反应性状态,并参与神经疾病的发生和发展过程。CXCL12/CXCR4趋化因子轴是由CXCL12与其特异性受体CXCR4相互作用而构成的与细胞间信息传递、细胞迁移有密切关系的耦联分子对[6-7]。大量研究结果表明,在骨癌痛、炎性痛、肿瘤转移等模型中CXCR4表达均上调[8-9],抑制CXCR4可缓解痛觉过敏。CXCL12及其受体CXCR4如何参与NP的发生和维持,以及其是否与胶质细胞有关目前尚未知晓。
本研究在SNI模型大鼠鞘内注射CXCR4特异性抑制剂AMD3100阻断CXCL12/CXCR4趋化因子轴,采用免疫荧光法观察大鼠ACC中GFAP蛋白质表达,结果显示,SNI未治疗组和SNI治疗组大鼠ACC中GFAP蛋白质表达在首次注药后14、21 d前与假手术未治疗组和假手术治疗组的差异均无统计学意义;但在首次注药后28、35 d时SNI未治疗组ACC中GFAP蛋白质表达明显上调,而SNI治疗组ACC中GFAP蛋白质表达量明显低于SNI未治疗组。由此可以推测,CXCL12/CXCR4趋化因子轴参与NP的发生和维持与星形胶质细胞有关。Tanga等[10]应用实时反转录PCR技术研究脊神经横断损伤模型发现,外周神经损伤后,小胶质细胞激活早于星形胶质细胞。可以推测,外周神经损伤后首先导致小胶质细胞活化,活化的小胶质细胞产生趋化因子、细胞因子,产生的趋化因子与神经元表面的CXCR结合后产生更多的趋化因子、细胞因子,这些趋化因子激活星形胶质细胞,使星形胶质细胞持续高表达。星形胶质细胞活化与趋化因子CXCL12和神经元表面CXCR4结合有关,也与NP持续存在有关。星形胶质细胞参与较晚期的NP,维持较持久的疼痛状态。鞘内注射AMD3100后可能阻断了小胶质细胞释放的CXCL12与神经元表面CXCR4结合,阻止星形胶质细胞的进一步激活和两者之间的级联放大效应,从而阻止中枢敏化,缓解患者的疼痛。
ACC参与痛觉特别是痛情绪信息的编码[11]。对于罹患残肢痛、患肢痛、脑卒中后疼痛等NP患者来说,慢性疼痛无疑是一种痛苦的记忆。本研究结果显示,4组术前PWT基础值的差异无统计学意义,SNI未治疗组在首次注药后7、14、21、28、35 d的PWT均显著低于假手术未治疗组和假手术治疗组同时间点,提示NP制模成功;同时SNI治疗组在首次注药后14、21、28、35 d时的PWT显著高于SNI未治疗组同时间点,表明通过鞘内阻断CXCL12/CXCR4趋化因子轴可以缓解NP,且NP早期缓解不明显,与迟发性GFAP表达减少基本相符。提示在NP时ACC中GFAP的生成与CXCL12/CXCR4趋化因子轴有关,而GFAP水平影响NP的疼痛程度。
综上所述,CXCL12/CXCR4趋化因子轴在SNI模型中参与痛觉过敏的形成,其机制可能与中枢神经系统内ACC中星形胶质细胞的激活有关。星形胶质细胞参与较晚期的NP,维持较持久的疼痛状态。不过目前尚不清楚CXCL12/CXCR4趋化因子轴与胶质细胞的相互作用与何种信号通路有关,尚需进一步深入研究。
