慢性肾脏病4期患者发生终点事件的危险因素分析
2019-01-03陈小平寿张飞刘剑飞
季 景 陈小平 寿张飞 刘剑飞
慢性肾脏病(CKD)患者进展至终末期肾病(ESRD)时必须依赖肾脏替代治疗维持生命。因此,CKD进展至4期时应开始为肾脏替代治疗做准备,但不同的CKD4期患者进展至肾脏替代治疗的时间差异较大,目前尚未明确造成这种差异的危险因素,本研究旨在探讨CKD4期患者发生终点事件的危险因素。
1 对象与方法
1.1 研究对象 本研究经医院伦理委员会批准。选择2014年5月1日—2016年4月30日间在安吉县中医院和安吉县人民医院住院或门诊诊断为CKD4期的患者共210例,其中慢性肾炎93例,糖尿病肾病61例,高血压肾病22例,梗阻性肾病10例,小管间质肾病7例,多囊肾5例,病因不明确12例;所有患者估算肾小球滤过率(eGFR)为15~<30 m L/(min·1.73m2)。排除标准:① 无法提供知情同意,或不能确保按要求完成程序;②所需各项研究资料有缺如项;③ 有其他严重疾病预计对生存时间有影响;④ 在CKD基础上可能存在急性肾损伤。
1.2 诊断标准 CKD分期诊断:以改善全球肾脏病预后组织(KDIGO)2012版指南为诊断依据,并应用其推荐的CKD流行病学合作组(CKDEPI)2009肌酐方程[1]计算eGFR。糖尿病肾病诊断:有病理诊断依据,或已确诊糖尿病且尿白蛋白/肌酐比值(ACR)>30 mg/g,持续时间>3个月,同时排除由其他原因所致的蛋白尿。高脂血症诊断:依据2007年《中国成人血脂异常防治指南》,血脂超过合适范围标准上界。高尿酸血症诊断:参考2013年《高尿酸血症和痛风治疗中国专家共识》,男性血尿酸水平>420μmol/L,女性>360μmol/L。高血磷诊断:参考KDIGO 2012版指南,血磷水平>1.45 mmol/L。低白蛋白诊断:血浆白蛋白水平<30 g/L。中重度贫血诊断:血红蛋白水平<90 g/L。血压控制不良诊断:参考2013年欧洲高血压学会(ESH)/欧洲心脏病学会(ESC)高血压治疗指南,随访时平均收缩压≥140 mm Hg(1 mm Hg=0.133 k Pa)。
1.3 方法 将入选时间记为生存时间起点,终点事件为肾脏替代治疗或全因死亡,随访终止时间为2017年4月30日。每3个月至少随访1次,记录患者的性别、年龄,以及糖尿病肾病、高脂血症、高尿酸血症、高血磷、低白蛋白血症、中重度贫血和血压控制不良的患者构成比;记录发生终点事件患者入选至终点事件发生的时间,以及未发生终点事件患者在随访截止时的存活时间。记录并比较随访过程中,有无发生终点事件的患者血脂、血尿酸、血磷、血白蛋白、血红蛋白水平和收缩压。
1.4 统计学处理 应用SPSS 19.0统计学软件。呈正态分布的计量资料以±s表示,计数资料以百分率(%)和构成比(n/N)表示。采用Cox比例风险回归模型分析(向前:LR法)终点事件发生的危险因素,筛选出的危险因素行比例风险假定检验,采用Kaplan-Meier(K-M)法绘制生存曲线。以P<0.05为差异有统计学意义。
2 结 果
2.1 一般资料 210例患者中,男102例(48.6%)、女108例(51.4%);年龄18~80岁,平均年龄为(59.17±8.58)岁;其中年龄>60岁111例(52.9%),≤60岁99例(47.1%)。所有患者均获随访,平均随访时间为(21.17±6.01)个月,发生终点事件患者从入选至终点事件发生的平均时间为(18.24±7.92)个月,未发生终点事件患者在随访截止时平均存活时间为(22.15±5.39)个月。发生终点事件83例(39.5%),其中肾脏替代治疗79例,死亡4例,死亡原因均为心血管疾病;截至发生终点事件时该83例中有74例进展为CKD5期。未发生终点事件127例(60.5%),截至随访终止时44例进展为CKD5期。糖尿病肾病、高血脂、高尿酸、高血磷、低白蛋白血症、中重度贫血、血压控制不良患者构成比分别为29.0%(61/210)、27.1%(57/210)、59.5%(125/210)、32.9%(69/210)、24.3%(51/210)、23.8%(50/210)、31.4%(66/210)。
2.2 随访过程有无终点事件发生的患者血指标和血压比较 发生终点事件的患者血尿酸、血磷水平和收缩压均显著高于未发生终点事件患者(P值分别<0.01、0.05),血红蛋白水平显著低于未发生终点事件患者(P<0.01)。见表1。
表1 发生终点事件与未发生终点事件患者的血指标和血压比较(±s)

表1 发生终点事件与未发生终点事件患者的血指标和血压比较(±s)
与发生终点事件患者比较:①P<0.01,②P<0.05
患者 N 总胆固醇(mmol/L)三酰甘油(mmol/L)高密度脂蛋白胆固醇(mmol/L)低密度脂蛋白胆固醇(mmol/L)血尿酸(mmol/L)血磷(mmol/L)血白蛋白(g/L)血红蛋白(g/L)收缩压(mmHg)发生终点事件 83 1.76±0.51 4.82±0.97 1.16±0.26 2.75±0.81 395.62±98.38 1.45±0.54 39.72±8.21 109.01±14.63 130.68±9.94未发生终点事件127 1.61±0.67 4.66±1.02 1.28±0.47 2.90±0.62 366.37±103.73①1.27±0.66② 39.14±9.59 117.42±15.80①124.90±12.33②
2.3 发生终点事件的危险因素分析 将性别、年龄(老年≥60岁),以及是否存在糖尿病肾病、高脂血症、高尿酸血症、高血磷、低白蛋白血症、中重度贫血或血压控制不良等因素引入Cox比例风险回归模型,以α=0.05为检验水准,结果显示,糖尿病肾病(OR=4.902,95%CI为3.048~7.884)、高尿酸血症(OR=3.306,95%CI为1.944~5.622)、高血磷(OR=2.801,95%CI为1.799~4.359)、中重度贫血(OR=1.755,95%CI为1.129~2.727)为CKD4期发生终点事件的危险因素(P值均<0.05)。

图1 有无糖尿病肾病的CKD4期患者K-M生存曲线

图2 有无高尿酸血症的CKD4期患者K-M生存曲线
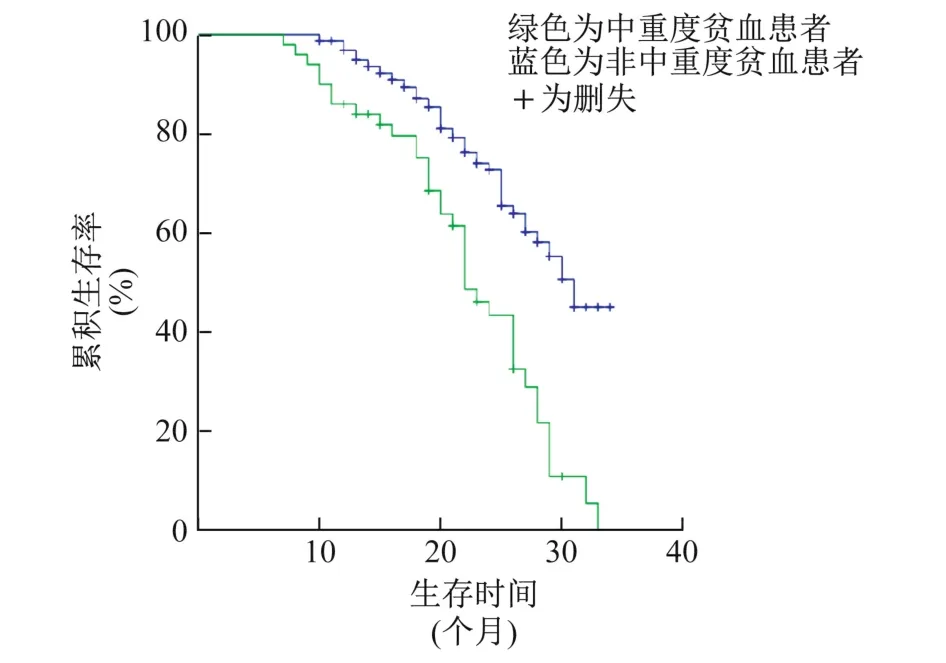
图3 有无中重度贫血的CKD4期患者K-M生存曲线
采用K-M法绘制生存曲线,对Cox比例风险回归分析筛选出的危险因素进行比例风险假定检验,结果显示,以有无糖尿病肾病、有无高尿酸血症和有无中重度贫血为分组依据的生存曲线无交叉(图1~3),满足Cox回归分析的前提条件,表明糖尿病肾病、高尿酸血症、中重度贫血是CKD4期发生终点事件的危险因素,CKD4期的糖尿病肾病患者发生终点事件的风险是非糖尿病肾病的4.902倍(95%CI为3.048~7.884),高尿酸血症患者是非高尿酸血症患者的3.306倍(95%CI为1.944~5.622),中重度贫血患者是非中重度贫血患者的1.755倍(95%CI为1.129~2.727);以有无高血磷为分组依据的生存曲线有交叉(图4),不满足Cox回归分析的前提条件,表明高血磷不是CKD4期发生终点事件的危险因素。
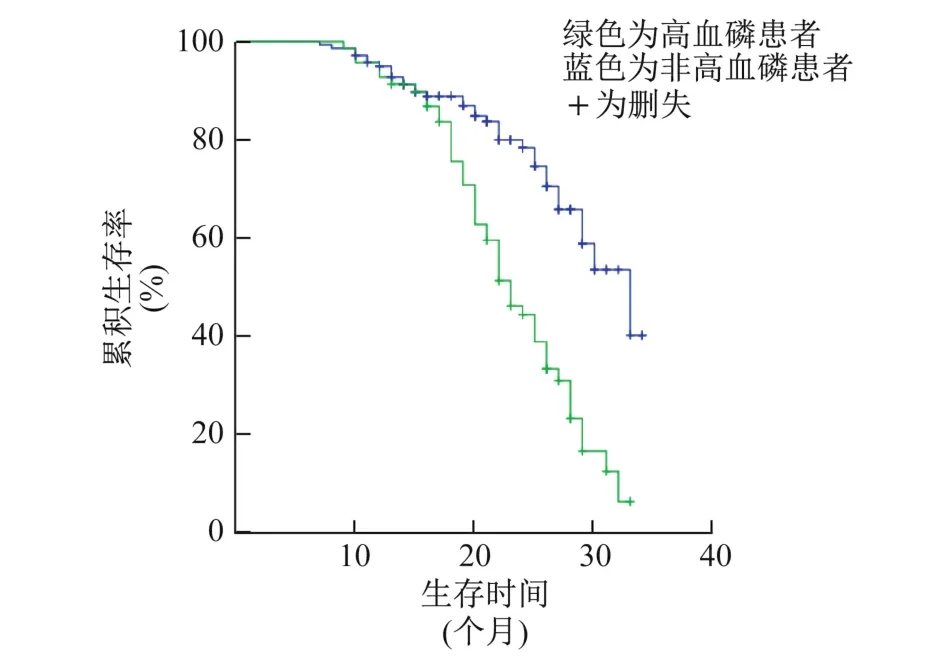
图4 有无高血磷的CKD4期患者K-M生存曲线
3 讨 论
加速CKD患者肾功能进展的因素多而复杂,2007年欧洲的一项队列研究[2]结果显示,男性CKD患者进入终点事件的风险是女性患者的1.6倍;2014年伊朗学者对CKD3或4期患者的队列研究[3]结果表明,≥60岁CKD4期患者发生肾功能进展的风险是<60岁者的4.5倍。CKD发展至不同时期,其疾病特点存在差异,各种危险因素在CKD各期的危险度有所不同。因此,某些因素并未被本研究列入,如尿蛋白水平,因“大量蛋白尿加速肾损伤”这一结论已得到证实,同时考虑到CKD4期大部分肾小球已丧失功能,在该期尿蛋白量的意义相对于CKD早中期要小得多。根据CKD4期的疾病特点,本研究采用K-M法绘制生存曲线,对筛选出的危险因素进行比例风险假定检验的结果显示,糖尿病肾病、高尿酸血症和中重度贫血是CKD4期发生终点事件的危险因素。
糖尿病导致肾损伤的机制与多种因素,如糖代谢紊乱(多元醇通络的活化、蛋白激酶C的激活、糖基化终末产物的积聚)、血流动力学异常、氧化应激、细胞因子参与和遗传因素等密切相关。高浓度的血糖本身即可导致肾小球的系膜细胞合成大量的细胞外基质,内皮细胞快速丧失功能,引起毛细血管收缩,肾小球基底膜增厚[4]。美国一项研究[5]结果表明,糖尿病和糖尿病肾病是CKD进展的独立危险因素。本研究结果显示,CKD4期的糖尿病肾病患者发生终点事件的风险是非糖尿病肾病者的4.902倍,可能与糖尿病肾病的特点有关,临床中CKD4期的糖尿病肾病患者较非糖尿病肾病者更易发生严重的水潴留,致使患者需提前行肾脏替代治疗。
既往研究[6]认为,血尿酸水平升高仅仅是肾功能减退的指标;近年来较多研究[7-8]发现,尿酸在CKD的进展中发挥重要作用。尿酸致肾损害的病理生理学机制可能与血管内皮功能障碍、激活肾素-血管紧张素系统、炎性细胞因子释放和氧化应激增加等有关[9]。血尿酸水平低可延缓2型糖尿病患者肾衰竭的进展[10]。血清尿酸作为CKD进展的独立危险因素在亚洲的流行病学研究中有报道[11]。Chonchol等[12]在心血管健康研究中发现,血尿酸水平每升高1 mg/d L(1 mg/mL=59.5μmol/L),肾功能下降14%。本研究结果显示,CKD4期的高尿酸血症患者发生终点事件的风险是非高尿酸血症者的3.306倍,亦支持上述研究结论。
当CKD进展至4期,患者普遍存在不同程度的贫血,根据该期特点本研究选择中重度贫血作为发生终点事件的影响因素,结果显示,CDK4期的中重度贫血患者发生终点事件的风险是非中重度贫血者的1.755倍。日本一项对71 802名健康居民发生ESRD的回顾性研究[13]发现,贫血是ESRD发生的独立影响因素。Rossert等[14]认为,贫血可能加重肾功能恶化,两者形成恶性循环。导致肾性贫血的原因主要为肾脏产生促红细胞生成素减少,其他原因还包括铁、叶酸和蛋白质等的缺乏,红细胞生存时间缩短,失血,毒素对骨髓的抑制等。因为CKD的病因、病理机制不同,产生促红细胞生成素的纤维母细胞损伤程度存在差异,即eGFR水平相同的患者纤维母细胞损伤程度可能并不相同,所以贫血程度可从另一方面间接地反映肾损伤程度,这可能是中重度贫血能增加终点事件发生风险的理论依据。
有研究[15-17]结果表明,高血磷与CKD的进展、ESRD的发生和移植肾功能减退相关;但另有研究[18]发现,血清磷水平与CKD进展、ESRD的发生无关。本研究结果显示,Cox比例风险回归分析筛选出高血磷为CKD4期发生终点事件的危险因素;但经比例风险假定检验,以无高血磷为分组依据的生存曲线有交叉,不满足Cox回归分析的前提条件,表明高血磷不是终点事件发生的危险因素。此外,高血压加剧肾功能减退已被证实,且有多项指南推荐了血压控制目标,但本研究结果显示,血压控制不良不是CKD4期发生终点事件的危险因素。其原因可能与病例数较少、随访时间较短、入选病例CKD分期较局限(仅4期)等有关。此外,CKD的发展是慢性迁延的过程,也是本研究的不足之处。
综上所述,CKD4期发生终点事件的危险因素为糖尿病肾病、高尿酸和中重度贫血。对不同临床特征的肾脏病进行早期干预可减少终点事件的发生[19]。在患者被诊断为CKD4期至发生终点事件或随访终止的过程中,存在各种繁杂的影响因素,如治疗情况、饮食起居情况、受其他疾病影响等。本研究抓住CKD4期的疾病特点,分析预测CKD4期患者预后的危险因素,为制定延缓CKD进展的决策提供了依据。
