菌种对固态发酵仔猪配合饲料的影响
2019-01-03管军军张天勇王志祥
■ 管军军 张天勇 王志祥
(1.河南农业大学畜牧学博士后科研流动站,河南郑州450002;2.河南广安生物科技股份有限公司博士后科研工作分站,河南郑州450001)
仔猪配合饲料是为了仔猪的健康生长,但是仔猪配合饲料设计与生产中往往存在一些问题:纤维素或木质素含量过高,含有抗原性蛋白,添加剂未合理使用,甚至使用违禁药品。对于上述问题[1],近年来,一些研究工作者提出利用生物发酵的方法来解决上述问题[2-4]。筛选一种或几种益生菌降解饲料中纤维素、抗原蛋白为低聚糖、小肽等营养物质,同时微生物代谢产生各种酶、活性物质有利于动物的消化吸收,益生菌的大量生长不仅提供了优质的菌体蛋白(单细胞蛋白),而且活的益生菌有益于动物肠道的健康,从而有效地降低仔猪腹泻,提高其抵抗力,也降低了一些动物药品的使用。因此,生物发酵方法在一定程度上系统地解决了上述问题,而且通过计算饲料成本的提高也在市场接受范围之内。
目前,发酵饲料研究与生产主要以原料发酵为主,如发酵豆粕[5]。在选择菌种方面,国内外通常采用的菌种有:乳酸菌、酵母菌、霉菌和芽孢杆菌等[4,6-7]。乳酸菌能够代谢生成大量乳酸,降低pH值,改善风味,能够防止杂菌污染,提高发酵饲料的品质。酵母在发酵过程中能够产生多种生物活性物质,有抗病、强化营养和促进生长的效果。工业中通常利用枯草芽孢杆菌和地衣芽孢杆菌发酵饲料。枯草芽孢杆菌的大分子降解率较高,且耐酸碱及高温,可以以活菌的形式进入动物肠道,促进断奶仔猪的肠道发育和养分吸收。
本课题组结合固态发酵饲料的产业化实际情况,在科学设计试验方案的基础上系统地研究固态发酵仔猪配合饲料生产技术,在前期系统研究前处理工序及单菌种发酵的基础上,本研究主要集中不同菌种(枯草芽孢杆菌、酵母和乳酸菌)及其不同组合对发酵产品主要营养指标(蛋白)的影响,为固态发酵仔猪配合饲料的实际生产提供理论依据。
1 材料与方法
1.1 主要材料与试剂
枯草芽孢杆菌BS-GA15购自润盈生物工程(上海)有限公司;酵母和乳酸菌为河南工业微生物菌种保藏中心提供;上述各菌种经过筛选驯化后,并加以辅料经冷冻干燥制成发酵剂(>108CFU/g),冰箱5℃保存备用。仔猪配合饲料551H及552H由河南广安生物科技股份有限公司生产,其组成如表1所示;另外,葡萄糖等试剂均为分析纯,购自郑州新丰化验器材有限公司。
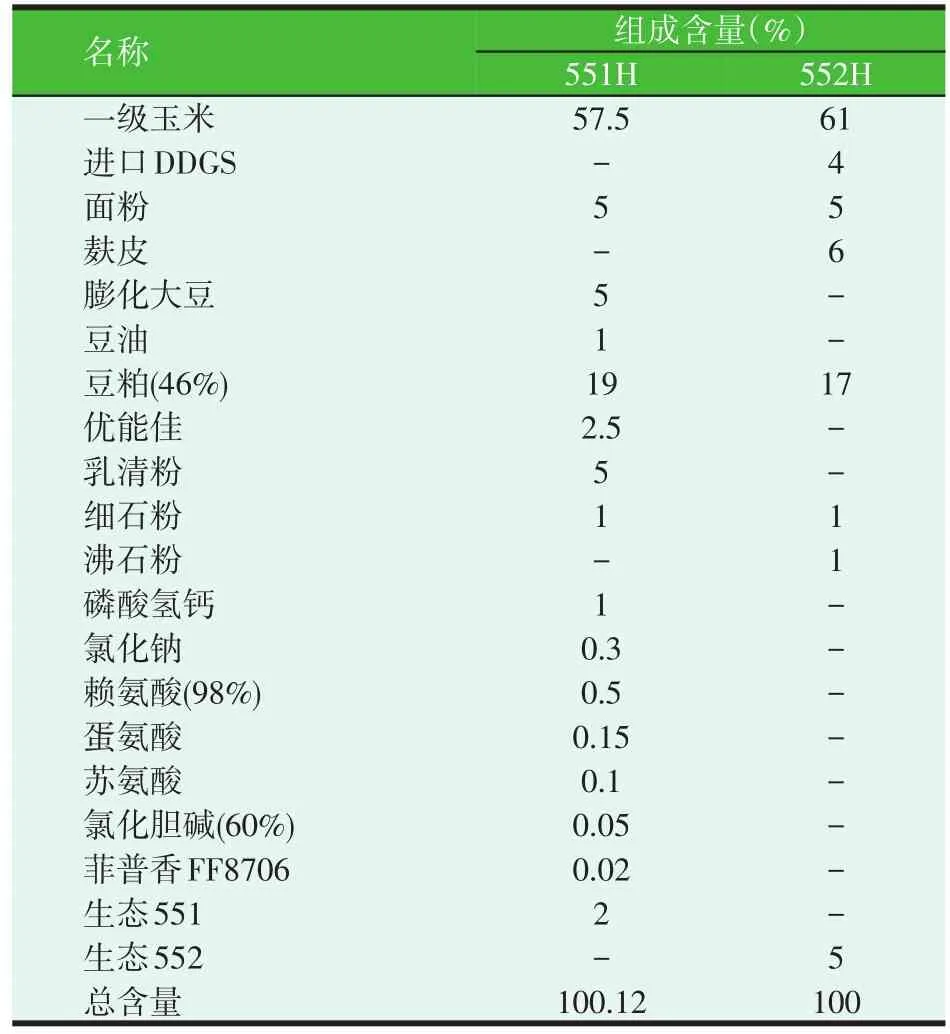
表1 仔猪配合饲料551H及552H配方
1.2 主要仪器设备
SPX-250B智能型生化培养箱,上海琅玕实验设备有限公司;JJ-CJ-1FD超净工作台,吴江市净化设备总厂;LDZX-50FB立式压力蒸汽灭菌器,上海申安医疗器械厂;FA2004B电子天平,上海精密科学仪器有限公司。
1.3 粗蛋白的测定
利用凯氏定氮法GB/T6432—1994对仔猪配合饲料或发酵产品进行粗蛋白的测定,以干基表示(P)。

1.4 发酵试验
将菌种发酵剂接种到培养液[2%(w/v)仔猪配合饲料551H或552H+2%(w/v)葡萄糖+蒸馏水]中,振荡均匀,置于30℃条件下振荡培养,转速为150 r/min,培养4 h。取发酵剂活化液一种(单菌种发酵)或几种(混菌发酵)接种到固态发酵培养基[仔猪配合饲料551H或552H与蒸馏水(6∶4)组成,装料100 g/瓶]上,总接种量为5%,搅拌均匀后,置于培养箱中30℃固态发酵48 h,取样,50℃条件下干燥成品备用。
1.5 试验设计
试验主要研究菌种的不同组合方式对固态发酵仔猪饲料的影响,因此,对双菌种及三菌种混菌发酵进行研究,菌种配比如表2所示,单菌种发酵作为对比,所有试验处理均重复3次。

表2 菌种配比
1.6 统计方法
利用SAS 9.0软件对试验结果进行多因素方差分析(ANOVA)及最小二乘法(LSD)进行各水平之间的多重比较。
2 结果与讨论
本研究中选用三种常见的固态发酵饲料的菌种作为研究对象,枯草芽孢杆菌属好氧型,酵母属兼氧型,而乳酸菌属厌氧型。从微生物的生长特性上分析,这三种微生物若一起培养的话,理论上会产生一定的拮抗作用。由于固态发酵物质与能量传递的不连续性[8],发酵前期培养基中氧分充足,利于好氧型微生物的生长,因此发酵前期以枯草芽孢杆菌发酵为主;伴随着局部微环境氧分的减少,逐步利于兼氧型微生物的生长,于是发酵中期以酵母发酵为主;随着发酵时间的延长,局部微环境的氧分进一步减少,有利于厌氧型微生物生长,那么在发酵后期以乳酸菌发酵为主;所以,在固态发酵环境中,利用其不连续性,可有效地抑制上述三种类型菌种间的拮抗作用。而且,有关枯草芽孢杆菌、酵母及乳酸菌组合进行混菌固态发酵饲料原料的研究已有报道[9]。
2.1 枯草芽孢杆菌与酵母组合固态发酵仔猪配合饲料
不同的枯草芽孢杆菌与酵母组合配比对固态发酵仔猪配合饲料的影响如图1所示。从统计学的分析结果可以看出,该类菌种组合对于固态发酵仔猪配合饲料均有显著的影响(P<0.05),不过,对于固态培养基551H的影响(P<0.01)比552H(P值接近0.05)更加显著。对于固态培养基551H(见图1A),组合B+S(2∶1)发酵后产品的蛋白含量及其增加率明显高于其它组合及单菌种发酵产品(P<0.05),而且其它组合及单菌发酵产品之间并无明显差异(P>0.05)。对于固态培养基552H(见图1B),试验结果与551H不同,组合B+S(1∶2)发酵后产品的蛋白含量及其增加率明显高于其它两种组合及单菌种酵母发酵的产品(P<0.05),与单菌种枯草芽孢杆菌发酵的产品相当(P>0.05),但是枯草芽孢杆菌、酵母及组合B+S(1∶1),B+S(2∶1)的发酵产品在蛋白及其增加率方面无明显差异(P>0.05)。总的来说,试验的结果说明枯草芽孢杆菌与酵母组合可提高单菌种固态发酵仔猪配合料的蛋白含量及其增加率,只是对于不同的配合饲料,最佳的菌种配比不一样,这应与配合饲料的组成有关。

图1 枯草芽孢杆菌与酵母组合固态发酵仔猪配合饲料对蛋白含量及其增加率的影响
2.2 枯草芽孢杆菌与乳酸菌组合固态发酵仔猪配合饲料
枯草芽孢杆菌与乳酸菌组合固态发酵仔猪配合饲料的影响如图2所示。经过统计分析发现,这两种菌种的组合对不同的固态发酵培养基所投制得的发酵产品有很大的区别。对于固态发酵551H(见图2A),该菌种组合极显著地影响着发酵产品蛋白及其增长率(P<0.000 1);而对于固态发酵552H(见图2B),该菌种组合对其发酵产品影响不大(P>0.05)。对于固态培养基551H(见图2A),菌种组合B+L(1∶1)、B+L(2∶1)之间差别不大(P>0.05),但是明显高于其它组合及单菌种发酵(P<0.05),而且单菌种发酵与组合B+L(1∶2)所得发酵产品之间的差异不明显(P>0.05)。至于固态培养基552H(见图2B),各种菌种组合及单菌种之间所得的发酵产品之间并无明显差别(P>0.05)。由此可知,枯草芽孢杆菌与乳酸菌组合仅仅对于固态发酵仔猪配合饲料551H产品中蛋白及其增加率有着明显影响,较单菌种发酵产品有着明显的提高,而对于固态发酵552H的影响不明显。
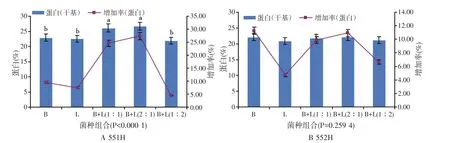
图2 枯草芽孢杆菌与乳酸菌组合固态发酵仔猪配合饲料对蛋白含量及其增加率的影响
2.3 酵母与乳酸菌组合固态发酵仔猪配合饲料
酵母与乳酸菌组合固态发酵仔猪配合饲料的影响如图3所示。由统计分析可知,该菌种组合对于两种固态发酵培养基的影响均极显著(P<0.001),而且不同菌种组合之间的差异也基本一致:具体来说,组合S+L(1∶1)与S+L(2∶1)固态发酵所得产品的蛋白及其增加率无显著差异(P>0.05),且明显高于其它组合及单菌种发酵产品(P<0.05),而且组合S+L(1∶2)与单菌种发酵产品之间也无明显差异(P>0.05)。因此,酵母与乳酸菌组合非常适合两种仔猪配合饲料的固态发酵,且可明显提高单菌种发酵产品的蛋白含量及其增加率。

图3 酵母与乳酸菌组合固态发酵仔猪配合饲料对蛋白含量及其增加率的影响
2.4 三菌种组合固态发酵仔猪配合饲料
枯草芽孢杆菌、酵母及乳酸菌三菌种组合对于固态发酵仔猪配合饲料的影响如图4所示。经过统计分析可知,三菌种组合对于两种固态培养基所制得的产品蛋白含量及其增加率的影响非常显著(P<0.001)。对于固态发酵551H(见图4A),菌种组合B+S+L(1∶1∶1)、B+S+L(2∶1∶1)、B+S+L(1∶2∶1)、B+S+L(2∶2∶1)、B+S+L(2∶1∶2)之间对于发酵产品的影响无明显差别(P>0.05),但是产品的蛋白含量及其增加率明显高于其它菌种组合及单菌种所得产品(P<0.05)。组合B+S+L(1∶1∶2)及B+S+L(1∶2∶2)与单菌种之间的差别不明显(P>0.05),但是前者所得产品的蛋白含量及其增加率明显高于后者(P<0.05)。对于固态发酵552H(见图4B),菌种组合B+S+L(1∶1∶1),B+S+L(2∶1∶1),B+S+L(1∶2∶1),B+S+L(2∶2∶1),B+S+L(1∶2∶2)的差异并不显著(P>0.05),但是该类组合所得发酵产品蛋白含量及其增加率明显高于其它菌种组合(P<0.05),而其它组合及单菌种之间差异也不明显(P>0.05)。由试验可知,三菌种组合固态发酵仔猪饲料551H与552H,适当的配比能有效提高单菌种发酵产品的蛋白含量及其增加率。

图4 三菌种组合固态发酵仔猪配合饲料对蛋白含量及其增加率的影响
2.5 讨论
2.5.1 双菌种组合
在双菌种组合混菌固态发酵仔猪配合饲料的试验结果中,对影响较为显著的蛋白含量及其增加率较高的组合进行统计分析,各菌种在组合中的占比如表3所示。对于固态培养基551H,最佳组合中,枯草芽孢杆菌于组合中其占比在1/2之上,乳酸菌占比在1/2之下,而酵母处于1/3~2/3之间,由此可知,对于双菌种固态发酵551H,枯草芽孢杆菌在组合中的比例较大,乳酸菌比例较小,可获得较好的发酵效果。那么,对于固态培养基552H,最佳组合中,枯草芽孢杆菌于组合中其占比在1/3较为合理,酵母占比在1/2之上,而乳酸菌处于1/2之下,因此,酵母在菌种组合中处于较大的比例,而乳酸菌与枯草芽孢杆菌比例较小。

表3 双菌种混菌发酵产品中蛋白含量及其增加率较高(P<0.05)的组合中各菌种占比
从各菌种的占比大小可知,双菌种组合混菌固态发酵仔猪配合饲料过程中,对于不同的固态培养基,各菌种的占比是不一样的。一方面是由于两种配合饲料的营养组成不同所致,如表1所示,551H中含有氨基酸等易于微生物生长的营养物质,而552H配方中则没有体现出来;另一方面,上述任意两种微生物组合理论上不可避免地会出现拮抗作用,虽然固态发酵体系物质与能量传递的不连续性[8],有避免拮抗作用的优势,但是若组合中各菌种占比不当的话,发酵微环境中可利用营养物质的有限性将导致菌种生长的可持续性;具体来说,551H中易于微生物利用的营养物质较552H丰富,适于发酵前期好氧型的枯草芽孢杆菌的生长,因此,提高该菌种在组合中占比有利于快速消耗氧分,再加上营养组分充足,利于兼氧型酵母或厌氧型乳酸菌的生长;而固态发酵552H中,由于可有效利用的营养物质有限,提高好氧型的枯草芽孢杆菌的占比,在微环境中氧分的快速耗尽的同时,可利用的营养组分也基本耗尽,反而不利于兼氧型酵母或厌氧型乳酸菌的生长,所以,组合中枯草芽孢杆菌的比重较小。另外,由于发酵前期好氧环境不利于乳酸菌生长,若该菌种比重过大,将会影响其它微生物的快速生长,导致发酵效率下降,因此,乳酸菌在菌种组合中的占比较小。
2.5.2 三菌种组合
在三菌种组合混菌固态发酵仔猪配合饲料的试验结果中,对影响最显著的组合进行统计分析各菌种在组合中的占比如表4所示。与双菌种组合不同的是,各菌种最大占比不超过1/2,最低占比情况因不同的固态培养而有所不同:对于551H,枯草芽孢杆菌最小占比不低于1/4,而酵母与乳酸菌最小占比不低于1/4;对于552H,枯草芽孢杆菌与乳酸菌最小占比不低于1/5,而酵母最小占比不低于1/4。由此可知,在三菌种混菌固态发酵中,任何一菌种在组合中所占最大比例不得超过1/2,否则不利于其它微生物的生长,这应与三种不同类型的菌种共同存在下,过大的占比会提高菌种之间的拮抗性。那么在菌种最低占比情况下,应与固态培养基有关;与双菌种类似,营养组成不一样,菌种在组合中的最小占比不一样;在551H培养基中,枯草芽孢杆菌最小占比可在1/4之上,比其它两种菌种高;而在552H培养基中,酵母最小占比较其它两种菌种高;这是因为551H中微生物可利用的营养成分显然要比552H多(表1),具体原因如同双菌种一样(见2.5.1)。

表4 三菌种混菌发酵产品中蛋白含量及其增加率较高(P<0.05)的组合中各菌种占比
3 结论
本研究选用枯草芽孢杆菌、酵母及乳酸菌为主要菌种,对仔猪配合饲料551H及552H进行固态发酵,通过不同的菌种组合及配比,探讨菌种对于固态发酵仔猪配合饲料的影响,结论如下:
①通过调节菌种组合中各微生物的占比,混菌(双菌种或三菌种)固态发酵仔猪配合饲料所得产品在蛋白含量及其增加率方面可显著高于单菌种发酵产品(P<0.05)。
②对于固态培养基551H,双菌种最佳组合中,枯草芽孢杆菌于组合中其占比在1/2之上,乳酸菌占比在1/2之下,而酵母处于1/3~2/3之间;三菌种最佳组合中,枯草芽孢杆菌最小占比不低于1/3,而酵母与乳酸菌最小占比不低于1/4。
③对于固态培养基552H,双菌种最佳组合中,枯草芽孢杆菌于组合中其占比在1/3较为合理,酵母占比在1/2之上,而乳酸菌处于1/2之下;三菌种最佳组合中,枯草芽孢杆菌与乳酸菌最小占比不低于1/5,而酵母最小占比不低于1/4。
本研究所取得的成果将为混菌固态发酵仔猪配合饲料提供一定的理论指导,当然,有关混菌特别是不同类型的菌种组合进行固态发酵仔猪配合饲料仍需要进一步研究,如一步法发酵过程的控制等。
