3D打印微血管减压手术训练模型的制作与评价
2019-01-03郑佳平陈国强李储忠
郑佳平 陈国强 李储忠
面肌痉挛(hemifacial spasm,HFS)是指面神经支配的肌肉不自主的抽动,而微血管减压术(microvascular decompression,MVD)是治疗HFS的首选方法[1]。MVD的手术成功关键是充分暴露面神经根部,但对于未经过系统训练的神经外科医生而言,难以安全和顺畅的暴露面神经区域,操作不当可致周围结构损伤,出现一系列的并发症,如脑压板牵拉导致小脑水肿或出血;过度牵拉或器械直接触碰损伤颅神经并导致听力丧失,声音嘶哑,吞咽困难等[2-3]。模拟手术训练是帮助年轻医生掌握手术操作技巧的有效方式,训练方式包括尸头标本、动物模型、虚拟现实仿真和手术仿真模型。
近年来,仿真训练迅速发展,尤其是三维(threedimensional,3D)打印技术可以将计算机3D模型构建成为3D物体,能够制作有解剖细节的个体化手术训练模型[4]。本研究对HFS患者影像资料建模,采用多色彩多材质3D打印技术打印出个体化的MVD手术模型部件,并附加仿真脑脊液循环系统、脑压板压力测量装置和颅神经触碰报警装置,利用仿真模型对神经外科医师进行操作训练,通过对神经外科专家及参加训练的住院医师进行调查,评估模型的仿真效果及训练效果。
1 材料和方法
1.1 影像资料采集
采集中国医科大学航空总医院神经外科1例52岁男性患者的HFS影像资料,使用3.0 T磁共振扫描,结构相采用T2加权像进行3D-CISS扫描,层厚0.80 mm。磁共振脑血管成像(magnetic resonance angiography,MRA)扫描执行3D飞行时间(time of flight,TOF)序列,层厚0.80 mm。CT扫描层厚0.3 mm。
1.2 仪器设备
采用3.0 T超导磁共振扫描仪(美国GE公司);X射线计算机断层扫描(X-ray computed tomography,CT),扫描采用128-row multidetector CT scanner(美国GE公司);3D打印机采用Objet750 Connex(美国Stratasys公司)。
1.3 数据处理
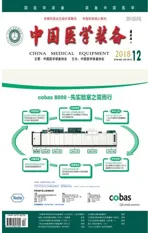
所有医学数字成像及通信(digital imaging and communication of medicine,DICOM)文件利用图像分析软件进行处理。不同组织的图像通过不同的影像序列进行提取,小脑、脑干及颅神经通过3D CISS序列的图像提取,颅骨通过CT图像提取,血管通过MRA图像提取;将提取的图像进行3D重建,重建后的3D模型以立体光刻(stereo lithography,STL)格式文件输出(如图1所示)。
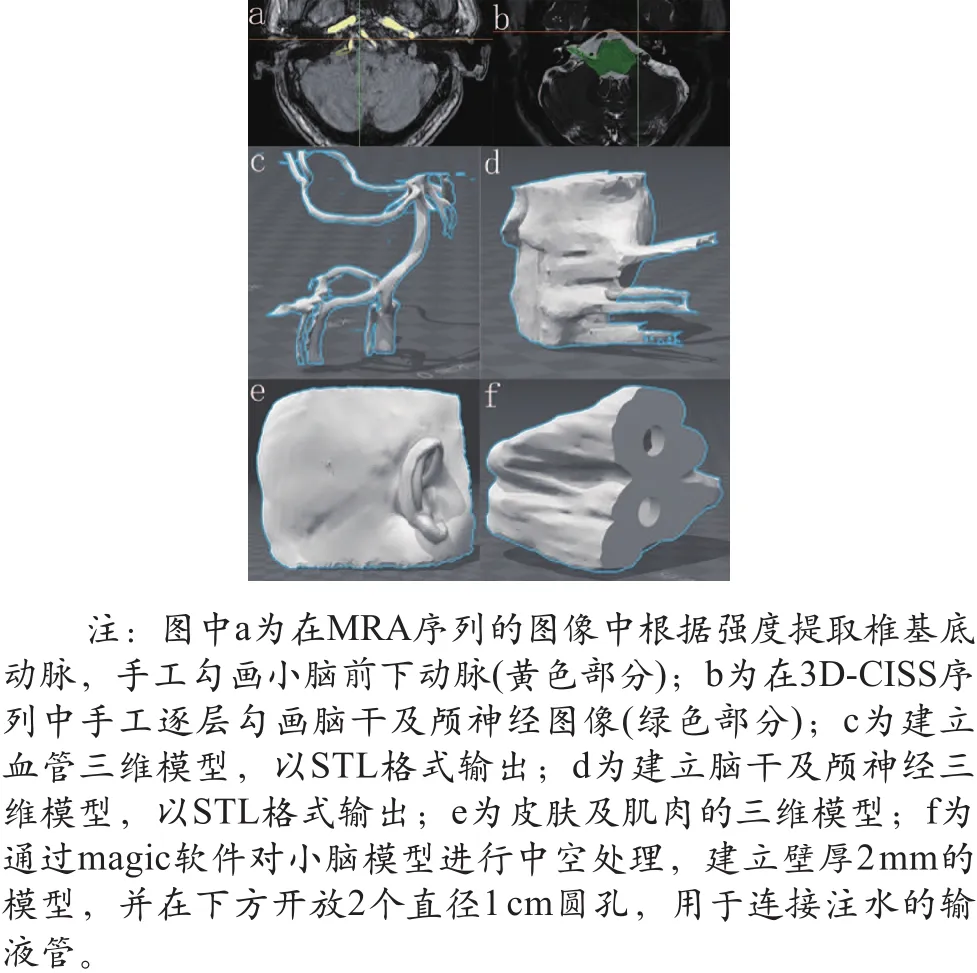
图1 利用mimics软件对二维影像资料的组织器官进行三维重建影像图
1.4 打印模型
将加工之后的STL格式文件输入3D打印机。使用拉伸强度2.4 MPa、邵氏硬度D24的光敏材料打印软组织。脑干、小脑为白色,肌肉、血管为红色,皮肤为黄色;使用白色和紫色的邵氏硬度D85的光敏材料整体打印骨骼和乙状窦;模型的可插入替换部件以不同颜色和硬度的光敏材料整体打印(如图2所示)。
图2 多色彩多材质一次打印的插入式可替换部件示图
1.5 安装模型
将绵纸包裹在脑干与血管表面,绵纸上覆盖缠绕PE静电薄膜,将模型放置在可以调节角度的亚克力平台上。平台底部插入三根输液管,其中两根连接小脑模型的空腔,用于向小脑中注水(如图3所示)。

图3 模型组装示图
将一根输液管的一端放置在小脑与脑干之间,另一端连接输液泵,用于模拟脑脊液循环。本研究制作了可以测量压力的脑压板,制作一个附带压力感受器的手柄,将手柄的一端与脑压板的中点用微型轴承连接。当脑压板牵拉小脑时,牵拉力可以通过压力感受器传输给万用电表,测量并记录压力。颅神经表面上涂抹一层导电漆(含银的涂层)(如图3所示),模型平台引出一根导线固定在涂层上,导线另一端将电池盒、蜂鸣器及显微手术器械串联,当手术器械触碰导电涂层,形成导电环路时,蜂鸣器报警(如图4所示)。

图4 模型配件示图
1.6 标准化手术训练过程
(1)将模型配件组装完成,利用显微镜进行手术训练。在可替换部件的耳后发迹位置切开皮肤与肌肉层,牵开器撑开切口,电钻钻开直径2 cm骨孔,暴露乙状窦后缘,T形剪开硬膜并悬吊。
(2)开放输液泵,向模型内部灌注模拟脑脊液。显微镜下,利用脑压板牵拉小脑,暴露蛛网膜,显微剪刀剪开PE静电膜,吸引器吸除脑脊液,剪开听神经与舌咽神经之间的绵纸,暴露责任血管。受训者牵拉小脑时,指导者记录万用电表的读数,同时记录蜂鸣器报警的频率。
(3)用显微剥离子挑起责任血管,暴露面神经根部,将Teflon团放在血管与脑干之间(如图5、图6所示)。

图5 手术训练模型示图
1.7 模型训练效果评价

图6 标准化MVD手术模拟训练过程示图
由3名具有100例以上MVD手术经验的神经外科医生,在利用模型进行一次完整的模拟操作之后,采用李克特量表进行评价,1分为不满意,2分为较差,3分为中等,4分为较好,5分为很好。其中5分评价标准为真实开颅手术。同时回答李克特量表的问题,并给出建议。在有经验的神经外科医生辅导下,10名没有MVD经验的住院医生利用仿真模型进行了MVD手术的操作训练,每位训练者进行了5次完整的MVD模拟手术,之后回答李克特量表的8个问题评价训练的效果。
2 结果
2.1 模型评估
由3名神经外科医生对模型皮肤(肌肉)和血管的评分最低为3.7分,皮肤与真实组织相比过于坚硬;血管与真实血管相比过于柔软且缺乏张力,放置Taflon团的感觉与真实手术操作存在差距。颅神经、蛛网膜与小脑的得分均为4.0,对颅神经、蛛网膜的仿真程度比较满意。在释放脑脊液时,模型不能体现小脑压力的降低与操作空间的扩大。颅骨评分达到4.3,开放骨窗的感觉与真实骨骼相似,且能够准确体现乙状窦与骨窗的位置关系,见表1。

表1 3名神经外科医生对MVD模型的8个项目给予评分(分)
2.2 训练效果评估
在接受MVD手术训练后,所有参与训练人员在训练前后分别进行一次测试,训练之前器械触碰颅神经导致的蜂鸣器报警平均次数为7次,训练之后平均次数降为4次,4名实习医师和6名住院医师的调查平均分数高于4.0(见表2)。
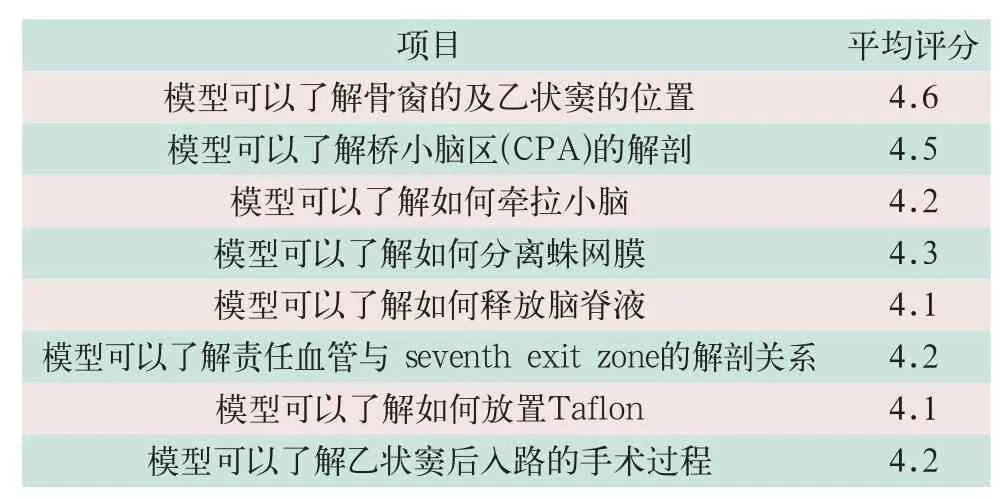
表2 实习医师和住院医师模型评分(分)
训练之前与训练之后脑压板牵拉力量的最大值比较,训练后牵拉脑组织的力量显著下降,见表3。

表3 手术训练前后脑压板记录牵拉小脑牵拉力的最大值(gf)
3 讨论
MVD手术成功实施的关键包括:①准确的骨窗定位;②通过适当牵拉小脑,开放基底池并释放脑脊液,以获得足够大的手术空间,暴露神经和周围结构;③在狭窄的颅神经间隙当中进行分离责任血管,放置Teflon棉团[5]。术中避免过度牵拉小脑和手术器械直接损伤颅神经,可以减少术后并发症的发生[6]。因此,MVD手术训练模型应该有针对性的对上述手术关键点进行有效的培训。
缺乏手术经验的医生通常会用力牵拉脑组织以获取更大的操作空间,但是在MVD手术中,过度牵拉小脑是导致听力减退,小脑损伤的重要原因。Yokoh等[7]报道,脑压板对脑组织的牵拉力在20~30克力(gf)范围内时,不会损伤脑组织。Lee等[6]的研究表明,MVD术后永久失聪的患者手术过程中小脑至颞骨的牵拉距离明显延长,听力损失组中平均距离为13.77 mm,对照组为8.0 mm。本研究的模型在牵拉小脑至颞骨8 mm时,牵拉力为62 gm,牵拉至14 mm时,牵拉力为130 gm,压力测量装置可以让受训医生体会牵拉小脑的力量与手术操作空间的关系,在保证手术操作空间的同时,尽量减少牵拉小脑的力量。受训者在反复训练之后,使用脑压板的牵拉力明显下降。
术中器械误触是造成颅神经、血管等重要结构损伤的重要原因[8]。本研究模型通过附加触碰颅神经报警系统,可以在训练的过程中即时将错误反馈给受训者,同时可以记录触碰神经的频率,对训练效果进行评估。将导电银漆涂在不导电的树脂模型表面,再连接导线与蜂鸣器和不同的手术器械连接,金属器械触碰导电涂层时可以形成环路,引发蜂鸣器报警,此方法简单并且可靠,缺点是涂料使颅神经呈现银色,一定程度降低了颅神经仿真的效果。
MVD手术中,锐性分离蛛网膜,释放CPA池和枕大池脑脊液是减少小脑牵拉和改善显露的关键。目前报道的颅底手术训练模型都不能很好的模拟蛛网膜和脑脊液循环[4,9-10]。绵纸的纤维与蛛网膜的小梁非常相似,而PE静电薄膜可以贴附在血管与神经的模型表面,很好的模拟真实手术中剥离蛛网膜的操作过程。本研究模型用廉价和容易获取的材料制作出了仿真的蛛网膜并模拟存在脑脊液的手术环境,使受训者在更为逼真的环境中接受锐性分离蛛网膜的操作训练。
由于软性光敏树脂打印的血管比较柔软,3名神经外科医生一致认为模型的血管缺乏真实血管的张力。但是,由于模型具有准确的小脑绒球结构和颅神经的间隙,颅神经的弹性也与真实神经相近,所以暴露责任血管与面神经根部,放置Teflon的过程非常接近真实手术的感觉。
因为训练手术止血的模型组件会大幅增加制作时间和成本,并且存在制作工艺的限制[10]。同时多数MVD手术过程中较少会使用止血操作,因此本研究模型未添加模拟出血的组件。
在目前的技术条件下,3D打印模型只是提供了简化的制作过程,由于材料和工艺的限制,模型同真实组织还是会有很大差异。VR技术、尸头训练、动物训练与模型训练会在很长的时期内并存,且相互补充,彼此不能替代。利用一系列的合理手术训练,使外科医生在对患者实际操作之前,最大限度的提高操作技术,将患者的风险降至最低。