miR-146b免疫学研究进展
2019-01-03薛庆节张瑞华熊化保
薛庆节 张瑞华 熊化保③
(济宁医学院基础医学院,济宁 272067)
miR-146家族包括两个成员miR-146a和miR-146b,由两个进化上保守的miRNA基因组成,在人类基因中它们分别由5号染色体和10号染色体上的不同基因转录,它们具有相同的必需序列,其成熟产物在3′端仅有2个核苷酸不同[1,2]。尽管它们的序列相似,但这两个miR是否履行了多余或不同的功能还不清楚;另外,与miR-146a不同,miR-146b在免疫应答方面的生物学信息很少,只知道其与大多数肿瘤生物学密切相关,在许多人类实体瘤中以较低水平表达。
1 miR-146b的特点
一些研究表明其在恶性肿瘤中可作为转移抑制因子,在许多类型的恶性肿瘤中可观察到miR-146b的失调而导致肿瘤的恶化。miR-146b在先天免疫中具有重要作用,当用LPS作用时,miR-146b在人单核细胞系THP-1中的表达显著增加。此外,3′-UTR荧光素酶报告实验表明,TLR信号中间体IRAK1和TRAF6是miR-146b的作用靶点[3,4]。
在人类的3′-非翻译区中,IRAK1和TRAF6同源基因均含有miR-146b的靶位点,表明miR-146b的TLR信号的反馈调控是进化保守的。最近的研究表明,microRNA参与免疫过程及其与炎症性疾病的联系,miR-146b被认为是哺乳动物先天和适应性免疫反应的一个调节剂。在斑马鱼miRNA表达谱芯片分析中,miR-146b家族成员miR-46b均被鼠伤寒沙门氏菌和海马分枝杆菌诱导表达,miR-46b通常在胚胎和成年鱼感染期间被诱导,这些microRNA在胚胎感染模型中的特异性与先天免疫反应联系在一起,因为适应性免疫在发育早期尚未开始发育阶段[5]。在鼠伤寒胚胎感染模型中敲除miR-46b对pro-炎症基因的表达或对已知免疫应答介质的转录调控器和信号转导元件的表达没有重大影响。研究发现,miR-146b的感染诱导型表达受到通过MyD88-Traf6途径的信号缺陷的影响;在用鼠伤寒沙门氏菌和海马分枝杆菌感染斑马鱼期间诱导miR-146b;miR-146b的敲除不影响斑马鱼胚胎中的白细胞发育;在鼠伤寒沙门氏菌感染期间,miR-146b的组合敲除对促炎基因表达不产生明显的影响[6]。
有证据表明,在促炎细胞因子在时,miR-146b可在内皮细胞中被诱导。尽管部分由EGR-3介导的miR-146b基因座的快速转录诱导,但与白细胞黏附分子的表达相比,miR-146b诱导延迟,并且与下游调节炎性基因表达,miR-146b抑制促炎性NF-κB途径、MAP激酶途径以及下游EGR转录因子密切相关[7,8]。因此,HuR是一种通过抑制内皮型一氧化氮合酶(eNOS)表达来促进内皮活化的RNA结合蛋白,是一种新型的miR-146b靶标。有关实验证明,miR-146b可以抑制促炎细胞因子来刺激相应的内皮细胞因子激活的强度和持续时间[7]。重要的是,表达miR-146b的小鼠显示白细胞黏附分子和趋化因子对IL-1b处理的诱导增强。miR-146b的抗炎活性是通过抑制促炎转录因子(即NF-κB,EGR-1/3,AP-1)以及通过调节转录后介导的促炎通路(由HuR的靶向介导)。当其他炎症基因如VCAM-1,ICAM-1和SELE存在时,miR-146b水平在炎症反应的晚期累积即使在没有促炎症细胞因子的情况下也能持续数天升高[8]。由于miR-146b抑制NF-κB和EGR途径的活化,所以响应于促炎细胞因子的miR-146b诱导形成负反馈环以控制内皮活化。miR-146b的转录可维持在炎症反应的后期,甚至在不存在细胞因子的情况下也维持转录。另外,在炎症过程中控制miR-146b成熟的机制仍是未知的,考虑到miR-146b诱导的动力学,我们认为miR-146b可能在解决血管炎症中起重要作用,并且miR-146b的表达时间延长是炎症“记忆”的分子标记。在内皮细胞中,升高到一定水平的miR-146b可以促进细胞因子脱敏,由此最初的细胞因子治疗减弱随后对细胞因子暴露的应答强度[7,9]。
2 IL-10刺激诱导miR-146b表达
有证据表明,IL-10刺激诱导了miR-146b表达,并且在IL-10缺陷的巨噬细胞中miR-146b表达受损。研究数据表明miR-146b靶向基因IRF5,导致巨噬细胞活化的调节;此外,miR-146b缺陷型小鼠发生了M1型巨噬细胞极化增强的肠道炎症[10]。最后,miR-146b模拟物处理可显著抑制M1巨噬细胞活化并改善体内结肠炎发展。总之,IL-10依靠miR-146b在调节M1巨噬细胞中起重要作用。
Curtale等[10,11]报道,LPS通过IL-10依赖性诱导miR-146b的表达,并显示miR-146b通过直接靶向TLR4信号传导途径在人单核细胞中起抗炎作用IL-10或LPS刺激诱导巨噬细胞中的miR-146b表达,并且在IL-10缺陷的巨噬细胞中miR-146b的表达受损。此外,RNA免疫共沉淀实验显示,miR-146b和IRF5可以占据相同的miRNA诱导沉默复合物(miRISC)。此外,miR-146b类似物显著降低由LPS诱导的IRF5 3′UTR活性和IRF5蛋白表达,miR-146b缺陷小鼠表现出增强的M1巨噬细胞极化[12]。最后,用miR-146b模拟物处理可显著抑制M1巨噬细胞活化并改善结肠炎发展。
总之,研究结果表明IL-10-miR-146b-IRF5集合在M1巨噬细胞活化的调节中起重要作用,并强调了miR-146b在控制免疫应答中的作用。另外,Curtale等[10]已经证明LPS通过IL-10依赖性途径诱导miR-146b的表达,通过直接与多靶点的结合(包括TLR4,MyD88,IRAK1和TRAF6)来调节TLR4信号传导途径。人单核细胞中miR-146b的表达导致LPS诱导产生的促炎细胞因子和趋化因子的显著降低。在本研究中,发现在用LPS刺激后,在小鼠M1巨噬细胞中可诱导miR-146b产生,但在IL-10缺陷细胞中miR-146b表达却受损。更重要的是,通过抑制M1巨噬细胞标记基因表达,miR-146b显著抑制M1巨噬细胞分化。
此外,我们确定了miR-146b靶向IRF5,这是M1巨噬细胞分化的关键转录因子,miR-146b缺陷小鼠表现出增强的M1巨噬细胞极化[13,14]。因此可以得出这样的结论,IL-10诱导miR-146b的表达,其靶向IRF5以调节M1巨噬细胞分化。在本研究中,我们发现在患有结肠炎的IL-10缺陷型小鼠中miR-146b表达显着降低,这促使我们在IL-10-/-小鼠中尝试用miR-146b类似物来治疗结肠炎。有趣的是,与对照相比,用miR-146b类似物处理可有效地改善IL-10-/-小鼠的结肠炎症状,可能是通过抑制M1巨噬细胞的分化[13,15]。
3 miR-146b控制M1巨噬细胞的作用
研究显示miR-146b可以控制M1巨噬细胞活化并改善结肠炎发展,在M1巨噬细胞中IL-10依赖性miR-146b的表达可调节巨噬细胞表型的形成[14,15]。miR-146b靶向IRF5进而调节M1巨噬细胞分化的新机制,用miR-146b类似物处理可明显改善结肠炎的发展,并通过在体外和体内抑制M1巨噬细胞激活标记基因的表达来抑制M1巨噬细胞活化[14]。总之,研究结果进一步证实了IL-10依赖miR-146b在M1巨噬细胞活化的调节中起重要作用,且特别显示了miR-146b在控制炎性疾病的免疫应答和发病机制中的有效作用。
前期研究表明,在LPS进入机体后,单核细胞通过IL-10介导的STAT3依赖性上调miR-146b的表达。研究显示miR-146b通过直接靶向多种元件,包括LPS受体TLR4,白细胞介素-1受体相关激酶1(IRAK-1)和TNF受体相关因子6(TRAF6)[13]。此外,在人单核细胞中表达miR-146b导致LPS依赖性的几种促炎细胞因子和趋化因子(包括IL-6、TNF-α、IL-8、CCL3、CCL2、CCL7和CXCL10)的明显降低。因此,miR-146b作为IL-10响应性miR具有抗炎活性基于单核细胞中的TLR4途径多靶向组成和作为IL-10抗炎症反应的分子效应物;IL-10在人单核细胞中可诱导MiR-146b的表达;TLR4是miR-146b的直接靶标[12,13]。miR-146b对TLR信号通路的多靶点研究miR-146a是第一个与炎症反应相关的miR,被认为是由吞噬细胞中的促炎刺激物快速诱导的miR,各种实验已明确了它在炎症反应调节中的作用以及其参与的内毒素耐受。
miR-146b的诱导取决于LPS注射后产生的IL-10的活性,而相反,IL-10不影响miR-146a表达。这与STAT3在miR-146b的诱导中发挥重要作用的ChIP数据是一致的,而miR-146a依赖于NF-κB。生物信息学分析也揭示了在TLR信号传导、IL-1信号传导和NF-κB信号传导途径中miR-146b显著富集,并在先天免疫反应中驱动转录激活编码促炎细胞因子和共刺激分子,然后控制抗原特异性适应性免疫应答的激活[16]。
需要进一步的研究来了解miR-146b是否真正起到参与炎症消退的分子开关的作用,但有趣的是已有报道称这种miR已经在急性炎症的小鼠模型的愈合阶段表达。对miR-146b如何在涉及多受体信号传导的复杂炎症过程的背景下与越来越多的负调控因子协同作用,对其更广泛、更深入地理解,可能有利于新的治疗方法的发现,以治疗失控的炎症反应引起的多种疾病。
4 miR-146b与DC的凋亡和细胞因子的产生
miR-146b在人DC分化和功能中作用有三个重要特点:首先,miR-146b的表达在人单核细胞向imDCs和mDC分化过程中上调[16],在人DC分化过程中miR-146b的表达增加与TRAF6和IRAK1表达显著呈负相关。其次,miR-146b可能是DC凋亡和细胞因子产生的关键调节因子。miR-146b显著促进DC凋亡并抑制IL-12、p70、IL-6和TNF-α的产生。mDCs中miR-146b的沉默可导致DCs分泌更高水平的IL-12、p70以及增加NK细胞产生IFN的能力。另外,在机理上,miR-146b靶向TRAF6和IRAK1,导致NF-κB的抑制并减少Bcl-2表达[16,17]。
因此,现已证实miR-146b可调节人DC凋亡和细胞因子的产生,miR-146b在控制免疫反应过度刺激中具有新的负反馈机制。已确定TRAF6和IRAK1是TLR或细胞因子受体/NF-κB信号通路中的两个关键衔接分子,它们是miR-146b通过负反馈调节的直接靶点。然而,在两种人类骨髓细胞系(THP-1和HL-60)中,用LPS处理8 h后,仅检测到前体和成熟形式的miR-146a上调,而miR-146b没有上调。最近的一项动力学研究表明,LPS刺激的人原代单核细胞中miR-146a的诱导速度比miR-146b快,在刺激后12 h才可以检测到其对miR-146b的诱导作用[18]。相反,在我们的研究中,miR-146b在单核细胞向imDCs和mDCs分化过程中上调,而且都参与了通过细胞凋亡终止DC功能和抑制细胞因子的产生。
miR-146b调节DC凋亡的机制是通过miR-146b-TRAF6/IRAK1-NF-κB途径,miR-146b在DC成熟过程中的上调与TRAF6和IRAK1表达呈负相关。miR-146b的过表达或TRAF6和/或IRAK1的沉默导致DC中IB表达显著增加。这些发现都支持miR-146b作为NF-κB的负调节因子下调TRAF6和IRAK1功能的观点[10,17]。因此,miR-146b可调节细胞存活,miR-146b是单核细胞来源的DC存在的关键调节因子。
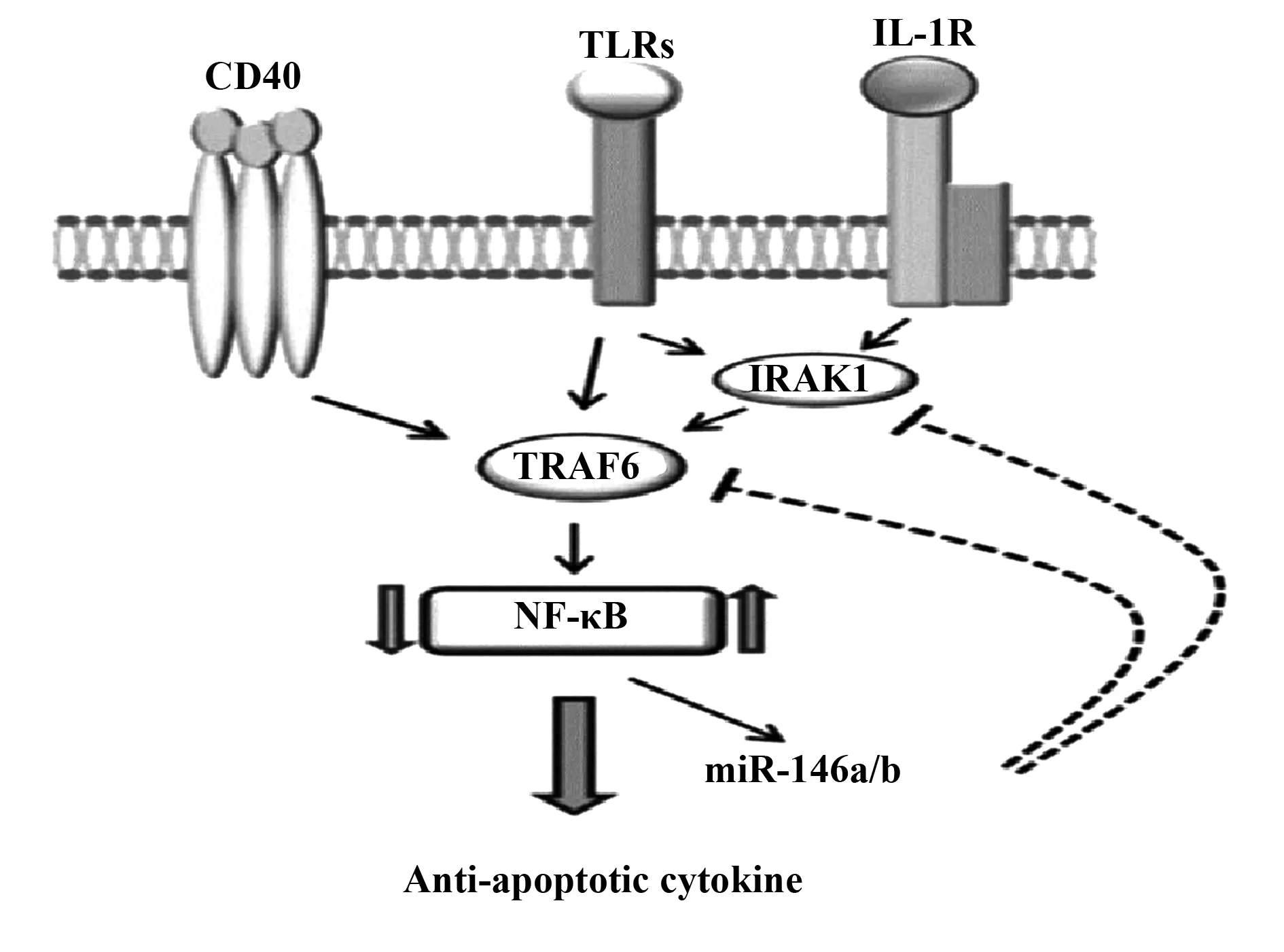
图1 miR-146a/b调控DC的功能(引自:Haein Park等[19])Fig.1 Regulation of DC′s function by miR-146a/b(from Haein park et al[19])
miR-146b诱导DC成熟并导致其凋亡,降低细胞因子的产生,miR-146b可以作为调节机制来防止过度刺激的人类DC中的炎症反应。有人使用信息软件进行计算搜索,发现CD40LG、TLR4、FADD,FAS和SMAD4是miR-146b的预测靶目标。据报道,CD40L可增加DC存活量,上调MHC表达,并诱导DCs中多种细胞因子如IL-12的表达[18]。通过miR-146b介导的沉默,由DC产生的IL-12和由IL-12介导由NK细胞产生的IFN-γ显著增强。
因此,CD40L可能成为miR-146b靶向DC凋亡和细胞因子产生的靶点。CD40L或其他靶分子是否在miR-146b介导的DC凋亡和细胞因子产生中发挥作用,还需要进一步研究,miR-146b在DC存活和炎症激活的调节中起关键作用。miR-146b可能需要对DC凋亡实现具有累加效应,因为每个个体miRNA都可以作为一个微调器。未来的研究也需要进一步明确miR-146b介导的DC凋亡在体内自身耐受和自身免疫中的精确作用。这些发现可能通过控制DC中的miR-146b-TRAF6/IRAK1-NF-κB途径对自身免疫疾病和/或癌症具有治疗意义。
5 miR-146b的表达与人类疾病
miR-146b通过NF-κB和EGR通路来抑制血管炎症,从而在动脉粥状硬化的形成中发挥重要作用[20,21]。我们认为HuR为miR-146b的新的作用位点,HuR在IL-1b产生中促进内皮细胞活化和白细胞募集,但HuR蛋白水平在内皮细胞激活的晚期降低,表明在这个阶段的miR-146b上调可能抑制HuR,从而形成负反馈环。因此,MiR-146b通过协同抑制黏附分子的诱导(通过TRAF6/IRAK1/2靶点)和通过白细胞黏附抑制剂eNOS(靶点为HuR)的表达来抑制内皮激活[13,22]。
这些研究结果表明miR-146b为内皮细胞中的microRNA介导的NF-κB调节网络一部分。除了调节NF-κB途径,miR-146b还导致调控炎性基因表达的EGR和AP-1途径的活化[23]以及miR-146b直接与HuR的结合,进而通过拮抗eNOS的表达来促进内皮细胞的活化。这意味着miR-146b可能比miR-10a、miR-31、miR-17-5p或miR-181b具有更广泛的抗炎作用[24,25]。因此,增加血管中的miR-146b的对于抑制血管内皮细胞对炎性细胞因子的反应可能是有用的,并且可能用于抑制导致动脉粥样硬化的炎症或治疗在败血症中与细胞因子有关的血管损伤。
这可能与这些细胞系中miR-146b的调节不同有关,已经在许多类型的恶性肿瘤中观察到miR-146b的失调,并且一些研究暗示这些miRNA作为转移抑制因子[2,7]。Taganov等[24]研究发现,当人的机体注射LPS时,miR-146b在人单核细胞THP-1细胞系中的表达增加。此外,3′-UTR萤光素酶报告基因检测证实,TLR信号传导中间体IRAK1和TRAF6是miR-146b的潜在作用靶点。
6 miR-146b的表达与癌症
在不同类型的癌症(包括PTC)中观察到miR-146b的不同程度的过表达,PTC中miR-146b的高表达与癌症临床病理相关研究中的恶性程度和侵袭性呈正相关[25-27]。此外,与miR-146b水平较低的患者相比,更高的miR-146b表达水平的总体生存率明显较差[28]。我们假设FNA中的miR-146b可以将PTC与良性甲状腺肿块区分开来,并探讨miR-146b在甲状腺结节初始外科治疗中的影响。进一步探讨miR-146b表达与关键临床病理指标之间的联系,评估miR-146b在预测PTC侵袭和转移的潜在用途以及进一步评估miR-146b在甲状腺FNA细胞学中的诊断效用。有关数据表明,由于miR-146b在恶性和良性病变之间呈显著增加的表达,所以其具有良好的临床诊断潜力[29]。
FNA与miR-146b之间的准确性差异可能反映了miR-146b对PTC具有较强的诊断价值。在晚期疾病阶段的PTC标本中miR-146b表达显著增加,表明其可能是PTC有用的预后标记物。此外,PTC细胞中miR-146b的表达增加与向局部淋巴结或远端器官的转移有关,进一步指出miR-146b的增加参与了PTC的侵袭和转移[29,30]。这项工作代表了生物医学科学的进步,因为它表明miR-146b可用于提高FNA活检的诊断准确性,并将PTC与良性甲状腺瘤分开,可能成为其干预及治疗的潜在目标。
研究发现miR-146b的表达水平与PTC的发生密切相关,这表明调节miR-146b的表达可能是抗癌的有效治疗策略,正常或低表达miR-146b的患者预后明显优于高表达患者[31-33]。研究miR-146b的表达与PTC临床病理特征之间的关系发现miR-146b的表达与PTC的转移和复发密切相关(P<0.01)。miR-146b可能通过影响乳头状甲状腺癌细胞的增殖和迁移能力而导致PTC的复发和转移。目前有证据表明miR-146b主要参与炎症过程[34,35]。因此,这两个基因对炎症的调控也可能影响PTC的进展。Western blot分析显示,miR-146b可显著增加IRAK1的表达。其他研究人员发现,miR-146b可以上调IRAK1的表达,并在卵巢癌的炎症反应中起作用[36,37]。然而现在对miR-146b调控IRAK1蛋白表达及其对PTC发生和预后的影响机制尚不清楚。总之,miR-146b在PTC癌组织中高度表达;并且患者的预后与两种miRNA在癌细胞中的表达水平相关。miR-146b的表达应作为PTC筛查的分子标记,miRNAs可为PTC的临床治疗提供新的靶点。
7 小结
从miR-146b的产生、作用机制、信号通路以及在相应疾病中的作用中,我们可以看出miR-146b与各种疾病的作用密切相关,通过对miR-146b调节和控制可进一步调控各种疾病的发生和发展,为临床提供思考和借鉴。