金丝桃苷介导P53/Caspase通路对人肝癌HepG2细胞增殖和凋亡的调节作用①
2019-01-03熊慧生巫桁锞
蒋 参 熊慧生 巫桁锞 文 军 梁 玲
(重庆大学附属肿瘤医院/重庆市肿瘤研究所/重庆市肿瘤医院中医肿瘤科,重庆 400030)
肝癌是我国高发的一类恶性肿瘤,是造成我国癌症死亡的第四大原因[1]。据统计,2015年我国肝癌新增病例达到466 100人,肝癌死亡人数达到422 100人,并且其发病率呈逐年上升的趋势[2]。手术切除和肝移植是目前肝癌最主要的治疗手段,但仅有30%肝癌患者适合手术治疗[3,4]。并且超过80%的患者确诊时已处于肝癌晚期,即使经过治疗也不能较好的改善患者生活质量, 5年内生存率仅有15%,严重威胁着人类的身体健康[5,6]。因此,寻找新的肝癌治疗药物是延长肝癌患者生存时间、降低肝癌死亡率的关键。近年来天然产物的抗癌活性受到广泛关注[7]。金丝桃苷(Hyperoside,HS)是金丝桃的主要活性成分,可通过诱导肺癌、胰腺癌、结肠癌等癌细胞凋亡发挥抗肿瘤活性[8-10]。也有研究表明HS可能具有抑制肝癌细胞HepG2增殖的活性[11],但作用机制还未见报道。因此,本研究以肝癌细胞HepG2为研究对象,探究HS对肝癌细胞增殖、凋亡的作用及作用机制。
1 材料与方法
1.1材料
1.1.1试验药物 HS购自美国Sigma公司,货号为1335202,分子量为464.38,纯度≥97%。用DMSO助溶,用无血清培养液配制成5 μmol/L的高浓度HS溶液,临用前用正常培养液稀释,DMSO终浓度不超过0.1%。
1.1.2细胞 人肝癌细胞系HepG2购自美国典型培养物保藏中心(American Type Culture Collection,ATCC),货号为HB-8065TM。用含5%胎牛血清、100 mg/ml 链霉素的RPMI1640培养液培养,隔天换液一次,细胞融合度达到85%以上时进行传代培养。
1.1.3试剂 RPMI1640培养液,特级胎牛血清和胰蛋白酶购自美国Invitrogen公司。MTT购自美国Sigma公司。DAPI染色液购自北京索莱宝公司。抗P53、半胱天冬氨酸酶-9(Caspase-9)和Caspase-3抗体购自美国CST公司,HRP标记山羊抗小鼠二抗购自美国Santa Cruz公司。Annexin V-FITC细胞凋亡试剂盒购自英国Abcam公司。
1.1.4仪器 多功能酶标仪、电泳仪和转膜仪购自美国Bio-Rad公司;倒置显微镜购自日本Olympus公司;流式细胞仪购自美国ThermoFhisher公司。
1.2方法
1.2.1MTT检测细胞活性 将细胞接种于96孔板中,细胞密度为1×105个/ml,用含有不同浓度HS(0、0.1、0.2、0.5、1、2、5、10、20、50、100、500 nmol/L)的培养液处理细胞,24 h后每孔加入10 μl MTT溶液于37℃继续孵育4 h。4 h后小心吸去上清液,每孔加入150 μl DMSO,待结晶溶解后用酶标仪检测吸光度,检测波长为570 nm,计算细胞活性,选取最佳用药浓度进行后续试验。
将细胞随机分为HepG2组、HS(10 nmol/L)组、HS(20 nmol/L)组和HS(50 nmol/L)组,每组6个复孔。用0、10、20和50 nmol/L的HS处理细胞,MTT法检测HS处理细胞0、2、3和4 d后各组细胞的增殖倍数(增殖倍数=各组OD值/第0天HepG2组OD值),绘制生长曲线。
1.2.2流式检测细胞凋亡 用0.25%胰蛋白酶收集不同浓度HS(10、20、50 nmol/L)处理的细胞,细胞浓度为1×105个/ml,用Binding buffer洗涤细胞一次,重悬沉淀后加入5 μl FITC-Annexin V和5 μl PI(10 mg/ml)溶液,室温避光孵育15 min,最后用流式细胞仪检测细胞凋亡情况。
1.2.3免疫荧光检测核皱缩情况 将细胞传代培养于12孔板中,用HS(10、20、50 nmol/L)处理细胞。48 h后弃去上层培养液,用预冷的PBS洗涤细胞三次,滴加DAPI即用液,每孔100 μl,室温避光染色10 min,用PBS洗去未结合的DAPI溶液,于荧光显微镜下观察细胞核皱缩情况,计算凋亡细胞百分数(凋亡细胞百分数=核皱缩细胞核数/细胞核总数×100%)。
1.2.4Western blot检测蛋白表达 用RIPA裂解液提取各组细胞蛋白,用BCA试剂盒检测蛋白浓度并调平。取等量的蛋白质用10%SDS-PAGE进行分离并转移至PVDF膜。随后用5%脱脂奶粉封闭,依次加入适宜浓度一抗(P53,1∶1 200;Caspase-3,1∶1 000;Casapse-9,1∶1 000)和二抗,最后滴加ECL进行曝光显影。凝胶成像系统获取蛋白质条带图片,Image J对蛋白质条带灰度值进行定量分析。
2 结果
2.1金丝桃苷对肝癌细胞增殖的影响 如图1B所示,HS浓度达到100 nmol/L及以上时,HepG2细胞活性明显降至80%以下,表明HS浓度高于100 nmol/L时对HepG2细胞有一定的细胞毒性。因此选择10、20、50 nmol/L三个浓度的HS进行后续实验。与HepG2组比较,HS(20 nmol/L)处理细胞4 d能显著降低肝癌细胞增殖倍数(P<0.05,图2);HS(50 nmol/L)处理细胞3 d和4 d均能显著抑制肝癌细胞增殖(P<0.05,图2),表明HS具有抑制肝癌细胞增殖的活性。
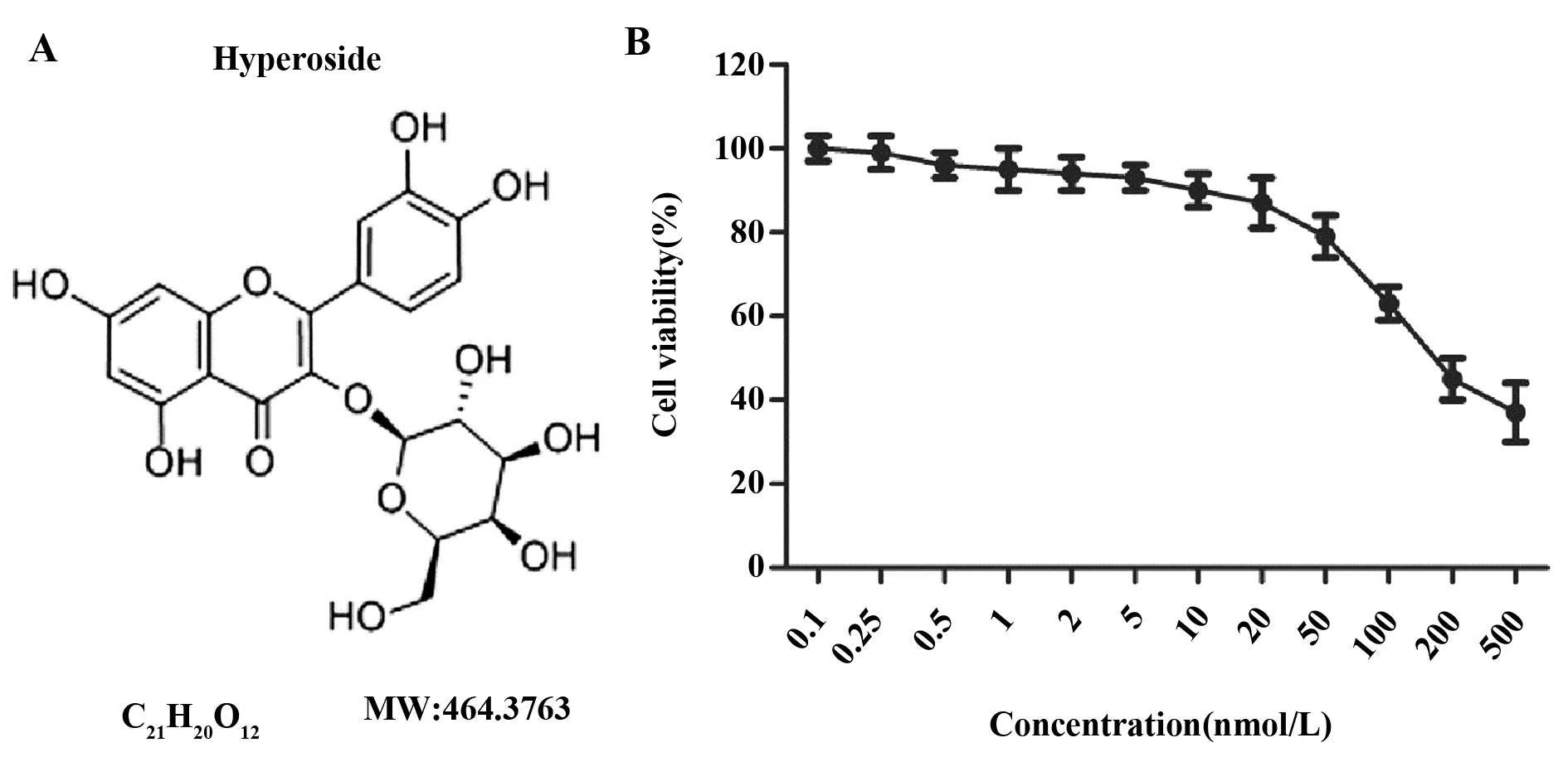
图1 金丝桃苷对HepG2细胞活性的影响Fig.1 Effect of HS on cell viability of HepG2 cellsNote: A.The chemical structure of HS;B.Cells were treated with Hs at different concentrations,and MTT assay was performed for cell viability.n=3,each experiment was repeated at least three times.
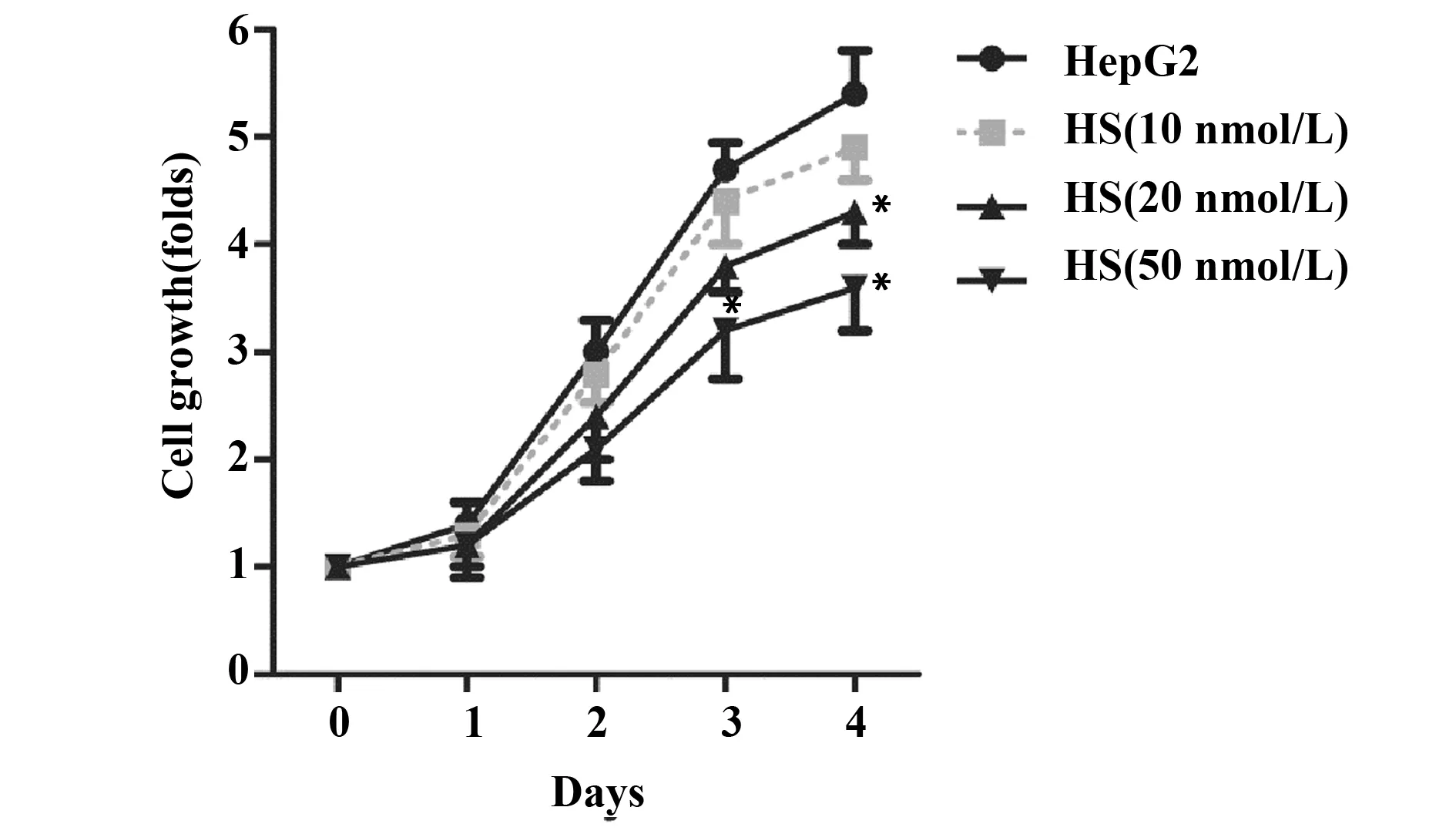
图2 金丝桃苷对肝癌细胞增殖的影响Fig.2 Effect of HS on cell proliferation of hepatoma carcinoma cellsNote: Cells were treated with HS(10,20,50 nmol/L) for 0,1,2,3 and 4 d.Cell growth was determined by MTT assay.*.P<0.05 versus HepG2 group,n=6.
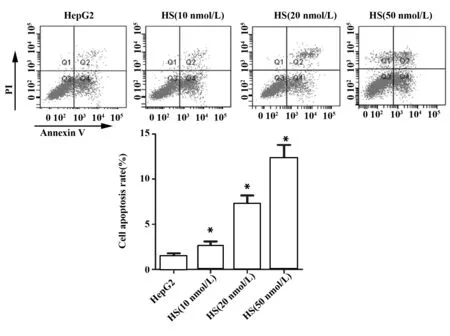
图3 金丝桃苷对肝癌细胞凋亡率的影响Fig.3 Effect of HS on cell apoptosis rate of hepatoma carcinoma cellsNote: Cell apoptosis was determined by flow cytometry.*.P<0.05 versus HepG2 group.n=6.
2.2金丝桃苷对肝癌细胞凋亡的影响 与HepG2组比较,HS(10 nmol/L)组、HS(20 nmol/L)组和HS(50 nmol/L)组细胞凋亡率均显著升高(P<0.05,图3);免疫荧光结果显示,HS(10 nmol/L)组、HS(20 nmol/L)组和HS(10 nmol/L)组皱缩细胞核数多于HepG2组,凋亡细胞百分数与HepG2组比较明显升高,差异具有统计学意义(P<0.05,图4),提示HS可诱导HepG2细胞凋亡。
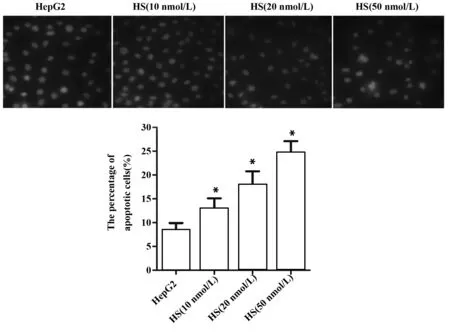
图4 金丝桃苷对肝癌细胞核皱缩的影响Fig.4 Effect of HS on nuclear shrinkage of hepatoma carcinoma cellsNote: Nuclear shrinkage was visualized by immunofluorescence.*.P<0.05 versus HepG2 group,n=6.
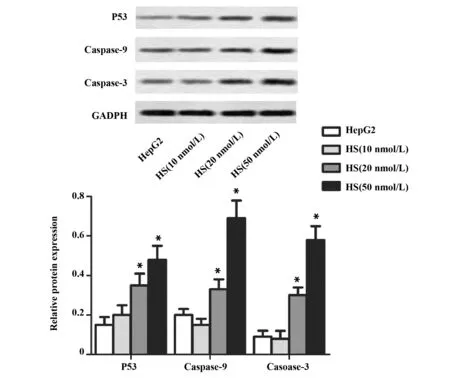
图5 金丝桃苷对P53/Caspase信号通路的影响Fig.5 Effect of HS on P53/Caspase signaling pathwayNote: Western blot was performed for protein levels of P53,Caspase-9 and Caspase-3,GAPDH was used as loading control.*.P<0.05 versus HepG2 group,n=6.
2.3金丝桃苷对P53/Caspase信号通路的影响Western blot实验结果表明,HS(20 nmol/L)组和HS(50 nmol/L)组细胞P53、Caspase-9和Caspase-3的蛋白表达水平与HepG2组比较明显升高,差异有统计学意义(P<0.05,图5),表明HS可诱导肝癌细胞P53/Caspase信号通路激活。
3 讨论
细胞增殖不受控制是癌症发生的主要机制之一。天然产物提取物Goniothalamin可抑制多类结肠癌细胞增殖,发挥抗癌作用[12]。北美刺人参也可通过抑制胰腺癌细胞增殖减缓肿瘤的生长[13]。HS是金丝桃的主要活性成分。研究表明,HS可抑制多类癌细胞增殖。Liu等[14]研究发现,HS能诱导肺癌细胞发生细胞周期阻滞,抑制细胞增殖相关通路激活,从而抑制肺癌细胞增殖。HS还能抑制子宫内膜癌细胞增殖[15]。也有研究发现,HS对肝癌细胞增殖也具有一定的抑制作用[11]。本文研究也发现,高浓度的HS能降低肝癌HepG2细胞活性。在无明显细胞毒性的剂量下,HS作用3、4 d能显著降低肝癌细胞增殖倍数,进一步表明HS具有抑制肝癌细胞增殖的作用。
研究表明,诱导癌细胞凋亡是大多数抗癌药物抑制癌症发展的作用机制[16-19]。近年来大量研究发现多类天然产物提取物也能通过诱导癌细胞凋亡发挥抗癌作用[20]。有研究发现,蟾酥灵能通过增强内质网应激诱导肝癌细胞凋亡[21]。藤黄酸可调控线粒体硫氧还原蛋白还原酶的表达促进肝癌细胞凋亡[22]。Li等[23]研究发现,桔梗皂苷D可诱导促凋亡蛋白PARP和Bax的表达,从而降低肝癌细胞存活率。也有研究表明,金丝桃提取物HS能诱导癌细胞凋亡减缓多类癌症的发展,但其对肝癌细胞凋亡的作用还较少见报道[24-26]。本文研究发现,HS能显著升高肝癌细胞凋亡率,并表现剂量依赖性,提示HS能诱导肝癌细胞凋亡,并随剂量的升高作用逐渐增强。此外,免疫荧光结果显示,HS还能诱导HepG2细胞发生细胞核皱缩。细胞核形态改变是细胞凋亡的主要特征之一,生姜提取物可诱导胰腺癌细胞发生细胞核皱缩,降低癌细胞活性[27,28]。怡红草素在诱导肝癌细胞HepG2细胞凋亡的同时,细胞核也出现明显改变[29]。结合实验结果进一步表明HS能诱导肝癌细胞凋亡,从而发挥抗肝癌作用。
细胞凋亡是指细胞发生程序性死亡,由多条信号通路共同调控,这些信号通路主要通过改变线粒体通透性,诱导线粒体释放凋亡诱导因子而启动细胞凋亡过程[14,30]。Caspase家族是细胞凋亡的最终执行者,Caspase家族蛋白的激活可诱导DNA降解、介导DNA损伤,最终导致细胞凋亡[31]。P53是Caspase家族蛋白的上游调控因子,在氧化应激、紫外照射等多种应激条件诱导DNA损伤过程中均呈高表达状态[32,33]。P53作用于线粒体可诱导细胞色素C表达,细胞色素C可直接诱导Caspase-9活化,活化的Capase-9可进一步促进Caspase-3激活,从而导致细胞凋亡[34,35]。P53介导的P53/Caspase细胞凋亡信号通路是多类化疗药物治疗癌症的重要机制之一。Alhazmi等[36]研究表明,黑种草种子提取物可通过激活P53/Caspase信号通路诱导乳腺癌细胞凋亡。紫草素可通过诱导P53表达升高Caspase-9表达水平,从而诱导细胞凋亡[37]。本研究采用Western blot法检测了HS处理肝癌细胞后,细胞P53、Caspase-3和Caspase-9的蛋白表达水平。结果显示,HS在诱导P53表达的同时也能升高肝癌细胞Caspase-3和Caspase-9的表达水平,提示其能够诱导P53/Caspase信号通路的激活,可能是HS诱导肝癌HepG2细胞凋亡的作用机制之一。
综上所述,HS可抑制肝癌细胞增殖、诱导肝癌细胞凋亡,并能促进凋亡蛋白Caspase-3和Caspase-9的表达,其作用机制可能与诱导P53/Caspase信号通路的激活有关。本研究仅初步探讨了HS抗肝癌的作用机制,之后将通过体内实验验证并进一步探究其具体的分子作用机制,为临床开发新的肝癌治疗药物奠定实验基础。