力学拉伸对巨噬细胞极化影响的研究
2019-01-03陈咪咪褚耿磊黄迎康
陈咪咪 褚耿磊 黄迎康 李 斌 施 勤
(苏州大学附属第一医院 苏州大学医学部,苏州 215007)
巨噬细胞(Mφ),是一种广泛分布于全身血液、组织的免疫细胞[1],能够吞噬和杀灭胞内寄生虫、细菌、肿瘤细胞以及自身衰老和异常的细胞,在机体的免疫防御、免疫自稳和免疫监视中发挥重要作用。巨噬细胞主要由骨髓干细胞发育而来,在多集落刺激因子(M-CSF)或粒细胞巨噬细胞集落刺激因子(GM-CSF)等刺激下,发育成单核母细胞,再进一步分化成为前单核细胞并进入血液,在此处分化成为成熟的单核细胞[2,3]。单核细胞穿过血管内皮,迁移到不同的组织,分化成为组织特异性的巨噬细胞。巨噬细胞按照其表型和分泌的细胞因子可以分为两种极化类型,即经典活化的M1型和选择性活化的M2型巨噬细胞。在 IFN-γ、LPS和TNF-α等因子的刺激下,分泌炎症因子,发挥炎症功能的巨噬细胞称为M1型巨噬细胞,主要针对微生物的炎症反应,通过大量分泌相关细胞因子杀死病原体和肿瘤细胞,发挥宿主免疫功能和防御功能[4-6];选择性活化的M2型巨噬细胞主要分泌抗炎因子TGF-β、IL-4、IL-10等,M2型巨噬细胞会抑制炎症反应,尤其在炎症反应后期和促进创伤修复和纤维变性中发挥重要作用,一般与寄生虫感染、组织重构、纤维化以及肿瘤疾病发展相关[7-9]。因此诱导环境中巨噬细胞M2的极化成为促进组织工程和再生医学的运用的策略之一。
力学刺激在维持细胞稳态中起非常重要的作用,参与了骨骼、肌肉、肺、血管等组织和器官的发生、发育及生长。有文献表明,力学刺激强度与炎症反应的强弱有关,已知核因子-κB(NF-κB)是涉及炎症,生长调节和凋亡以及多种基因的多效调节剂,与炎症反应密不可分[10,11]。本实验中通过力学拉伸这一形式探索力学刺激对巨噬细胞极化的影响及其可能涉及的调控机制。
1 材料与方法
1.1实验材料、试剂 小鼠单核巨噬细胞白血病细胞Raw264.7细胞系购自上海中科院并在本单位保存,DMEM高糖培养基(Hyclone,美国)、胎牛血清(FBS,Gibco,美国)、100 U/ml青霉素、0.1 mg/ml链霉素、鼠尾胶原(Sigma,美国)、活/死细胞染色试剂盒(Thermo Fisher,美国)、凋亡试剂盒(BD,美国)、CCK-8试剂盒(同仁,日本)、CD11b-PE、CD86-FITC、CD206-FITC抗体(eBiosicence,美国)、磷酸盐缓冲液粉末(博士德生物科技有限公司,中国)、逆转录试剂盒(TaKaRa,日本)、SYBR-Green(Bio-Rad,美国)、NIK、P65、Pi-P65抗体(Abcam,英国)、辣根过氧化物酶标记山羊抗小鼠IgG(H+L)和辣根过氧化物酶标记山羊抗兔IgG(H+L)(碧云天,中国)、化学发光试剂ECL显影液(Thermo Fisher,美国)。
1.2方法
1.2.1细胞处理 提前12 h向无菌的拉伸皿内加入配制的collagenⅠ溶液(1 ml的PBS溶液中加入100 μl的鼠尾胶原),放在培养箱内静置过夜。12 h后,接种1×105Raw264.7细胞,放置在培养箱内静置2 d。2 d后开始拉伸,设置5%的幅度,频率为0.5 Hz(拉伸的长度与原始长度的比例为5%),每天拉伸4 h,连续拉伸3 d、5 d后,再继续培养24 h,收集细胞上清液和细胞进行流式细胞术、PCR和Western blot等实验。
1.2.1.1活/死细胞染色检测细胞生长状态 吸掉上清液,用PBS溶液轻轻地洗一遍,按照活/死细胞染色试剂盒说明书配制,即A(钙黄绿素)∶B(溴乙菲啶豪莫二聚体)∶培养基为 1 μl∶2 μl∶2 ml,加到各组的拉伸皿内,室温避光孵育30 min,PBS溶液清洗2次,通过倒置荧光显微镜(Zeiss,德国)进行观察拍照。
1.2.1.2流式细胞术检测细胞生长状态 吸掉上清液,用PBS溶液轻轻地洗一遍,0.25%胰酶消化细胞,1 000 r/min,离心5 min,弃上清,立即置于冰上,分别加入相对应体积的PBS+2%FBS溶液以及相对应的PI和AV,每孔分别加入PI、AV为5 μl、10 μl,加到各组的拉伸皿内,4℃室温避光孵育30 min,离心,1 000 r/min离心5 min,弃上清(洗去未结合的凋亡试剂),每孔加入200 μl PBS+2%FBS溶液,转移至96孔板内,流式细胞仪(Merk Millipore,德国)测试。
1.2.1.3Cell Count Kit (CCK-8)实验检测细胞生长状态 吸掉上清液,用PBS溶液轻轻地洗一遍,按照CCK-8试剂∶培养基为1∶10配制液体,将配好的液体加入各组的拉伸皿内,完全覆盖细胞,37℃培养箱孵育2 h,每皿分别吸出100 μl转移至96孔板内,450 nm测其吸光度值。
1.2.2细胞表型分析 0.25%胰酶消化细胞,1 000 r/min,离心5 min,弃上清,立即置于冰上,分别加入相对应体积的PBS+2%FBS溶液以及相对应的荧光抗体(CD11b、CD86、CD206),冰上孵育30 min 后,1 000 r/min离心5 min,弃上清(除去未结合的荧光抗体),每孔加入200 μl PBS+2%FBS溶液,转移至96孔板内,流式细胞仪(Merk Millipore,德国)测试。
1.2.3实时荧光定量PCR Trizol溶液裂解细胞,通过氯仿-异丙醇-75%酒精等试剂提取RNA,通过测量其在260 nm处的吸光度计算总RNA的浓度,1 μg RNA通过逆转录后得到cDNA,然后再进行实时定量荧光PCR(Bio-Rad,美国)。检测的引物分别为致炎基因IL-1β、TNF-α、iNOS和抗炎基因IL-4、IL-10和TGF-β(本实验引物由金唯智生物科技有限公司合成,基因序列如表1)。
表1基因引物序列
Tab.1Geneprimersequence

GenePrimer sequenceβ-actinForward:5′-GTGACGTTGACATCCGTAAAGA-3′Reverse:5′-GCCGGACTCATCGTACTCC-3′IL-1βForward:GCAACTGTTCCTGAACTCAACT-3′Reverse:5′-ATCTTTTGGGGTCCGTCAACT-3′iNOSForward:5′-ATAGTCCTTCCTACCCCAATTTCC-3′Reverse:5′-GATGAATTGGATGGTCTTGGTCC-3′TNF-αForward:5′-TGTTACTGCCAGGACCCATA-3′Reverse:5′-CTTCCTTGATGGTCTCCACA-3′IL-4Forward:5′-GGTCTCAACCCCCAGCTAGT-3′Reverse:5′-GCCGATGATCTCTCTCAAGTGAT-3′IL-10Forward:5′-GCTCTTACTGACTGGCATGAG-3Reverse:5′-CGCAGCTCTAGGAGCATGTG-3′TGF-β1Forward:5′-CAGTACAGCAAGGTCCTTGC-3′Reverse:5′-ACGTAGTAGACGATGGGCAG-3′
1.2.4Western blot 0.25%胰酶消化细胞,1 000 r/min,离心5 min,弃上清后立即置于冰上,加入100 μl 的蛋白裂解液, 4℃摇床上震荡20 min, 14.8×103g离心20 min,上层无色液体为蛋白溶液。通过BCA试剂盒测出各组蛋白浓度,调节蛋白浓度,加入1/4体积的5×buffer溶液,100℃金属浴5 min。蛋白上样量为20 μg,孵育抗体有actin、P65、磷酸化P65和NF-κB诱导激酶(NIK)抗体,一抗4℃孵育过夜,选择相对应的Western blot二抗(辣根过氧化物酶标记山羊抗小鼠IgG和辣根过氧化物酶标记山羊抗兔IgG),室温孵育1 h。使用增强的化学发光试剂ECL显影液来使蛋白条带显影,通过放射自显影仪器曝光(Bio-Rad,美国),Image Lab软件(Bio-Rad,美国)分析条带的灰度值,检测目标蛋白的表达水平。
2 结果
2.15%幅度的力学拉伸对Raw264.7细胞的生长无影响 细胞可以感受微环境的改变并产生生物学反应。力学刺激对小鼠Raw264.7细胞的增殖作用通过活/死细胞染色、CCK-8和流式凋亡实验检测,如图1A所示,未拉伸对照组的Raw264.7细胞几乎都是活细胞(绿色)。经过5%幅度拉伸的Raw264.7细胞几乎也都是活细胞,图1B中能观察到零星的死细胞(红色),但相对于对照组来说其差异性并不显著。流式凋亡结果(图1C、D)表明,经过5%幅度作用的Raw264.7细胞与对照组细胞的凋亡率相似,5%幅度拉伸组的凋亡率略大于对照组,但两者之间的凋亡率并没有显著性的差异。由图1E可得,对照组和5%幅度拉伸组的OD值都由0.53增加到4.0,两组之间差异无统计学意义,因此,表明拉伸不影响细胞增殖。以上结果显示5%幅度的力学拉伸不影响小鼠Raw264.7细胞的生长。
2.2拉伸抑制巨噬细胞M1方向极化而促进巨噬细胞M2方向极化 为了探索5%幅度的力学拉伸对Raw264.7细胞极化的影响,本实验用流式方法来检测Raw264.7细胞CD11b阳性的细胞表面CD86分子(M1型巨噬细胞的标志物)和CD206分子(M2型巨噬细胞的标志物)的表达量。结果显示,相对于对照组,5%幅度的拉伸可以有效抑制CD86分子的表达。而CD206分子的表达略高于对照组。第3天对照组CD86/CD206比值是5%幅度拉伸CD86/CD206比值的2.5倍(图2A、B、E),第5天对照组CD86/CD206比值是5%幅度拉伸CD86/CD206比值的15倍(图2C、D、F)。因此,5%幅度的拉伸可以显著性增加Raw264.7细胞CD206/CD86的比值,表明5%幅度的力学拉伸可以显著地促进Raw264.7细胞M2方向极化。
2.35%拉伸调节Raw264.7细胞炎症相关基因的表达 qRT-PCR结果显示,5%幅度拉伸作用细胞3 d 后,细胞在致炎基因与抗炎基因的表达上与对照组几乎没有差异。而5%幅度拉伸作用细胞5 d后,细胞相对于对照组会显著抑制致炎症基因IL-1β、TNF-α和iNOS的表达(图3A),同时促进抗炎基因IL-4、IL-10和TGF-β的表达(图3B)。以上结果表明5%幅度拉伸促进Raw264.7细胞更多的表达M2抗炎基因,并抑制M1炎症基因的表达。
2.45%幅度的力学拉伸抑制细胞NF-κB信号通路的激活 由PCR和流式实验结果发现5%幅度的拉伸在抑制炎症和促进抗炎都有很好的效果。为了研究力学刺激是如何引起Raw264.7细胞发生极化作用的,我们通过Western blot技术研究与炎症调控相关NF-κB信号通路变化。通过WB结果可以看出,与对照组相比,5%幅度拉伸明显地抑制了Raw264.7细胞NIK蛋白和磷酸化P65的表达量,5%幅度拉伸后磷酸化P65的表达量是仅有对照组的1/2,而P65的蛋白表达量并无差异(图4)。由此推断,5%幅度拉伸抑制了Raw264.7细胞NF-κB信号通路的激活。
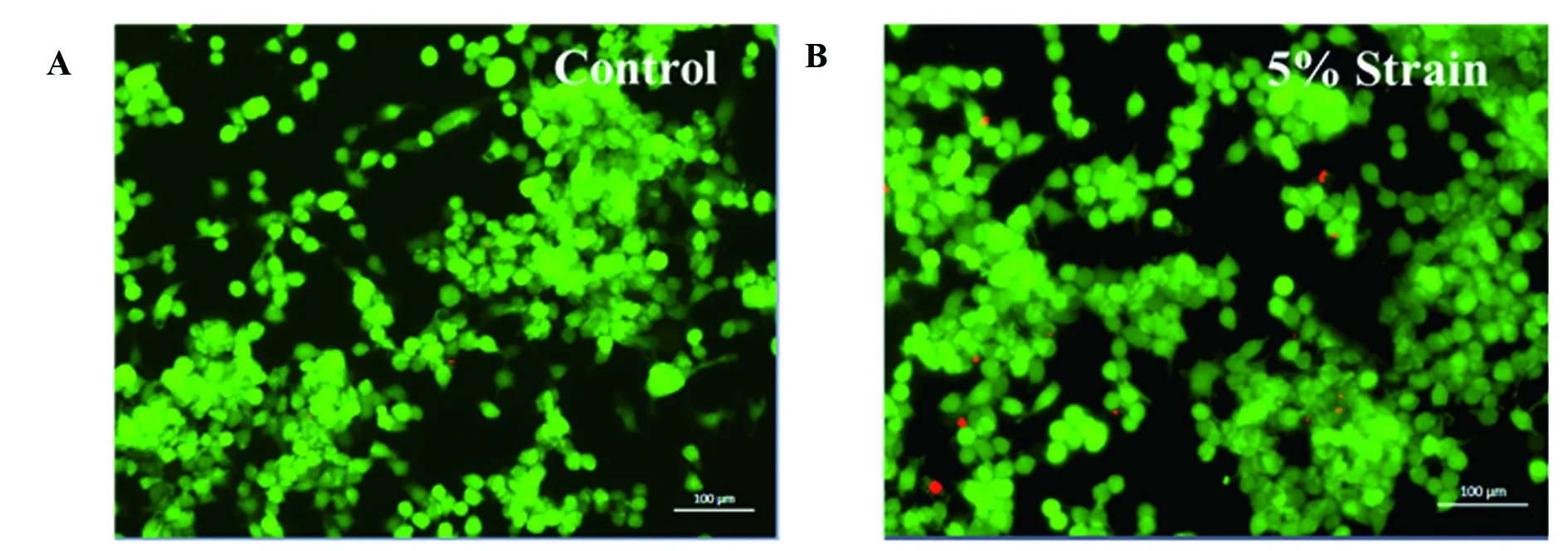
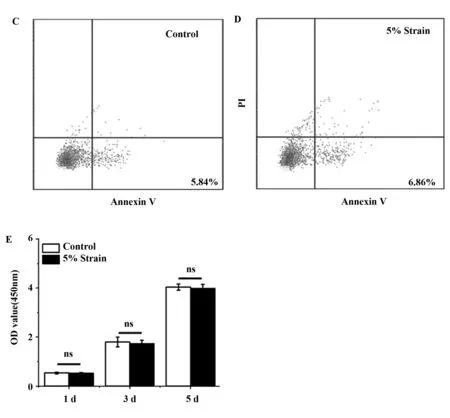
图15%幅度拉伸对Raw264.7细胞生长的影响
Fig.15%amplitudecyclictensilestrainaffectgrowthofRaw264.7cell
Note: A,B.The result of live/dead cell staining on the fifth day;C,D.The result of flow apoptosis analysis on the fifth day;E.The result of CCK-8.
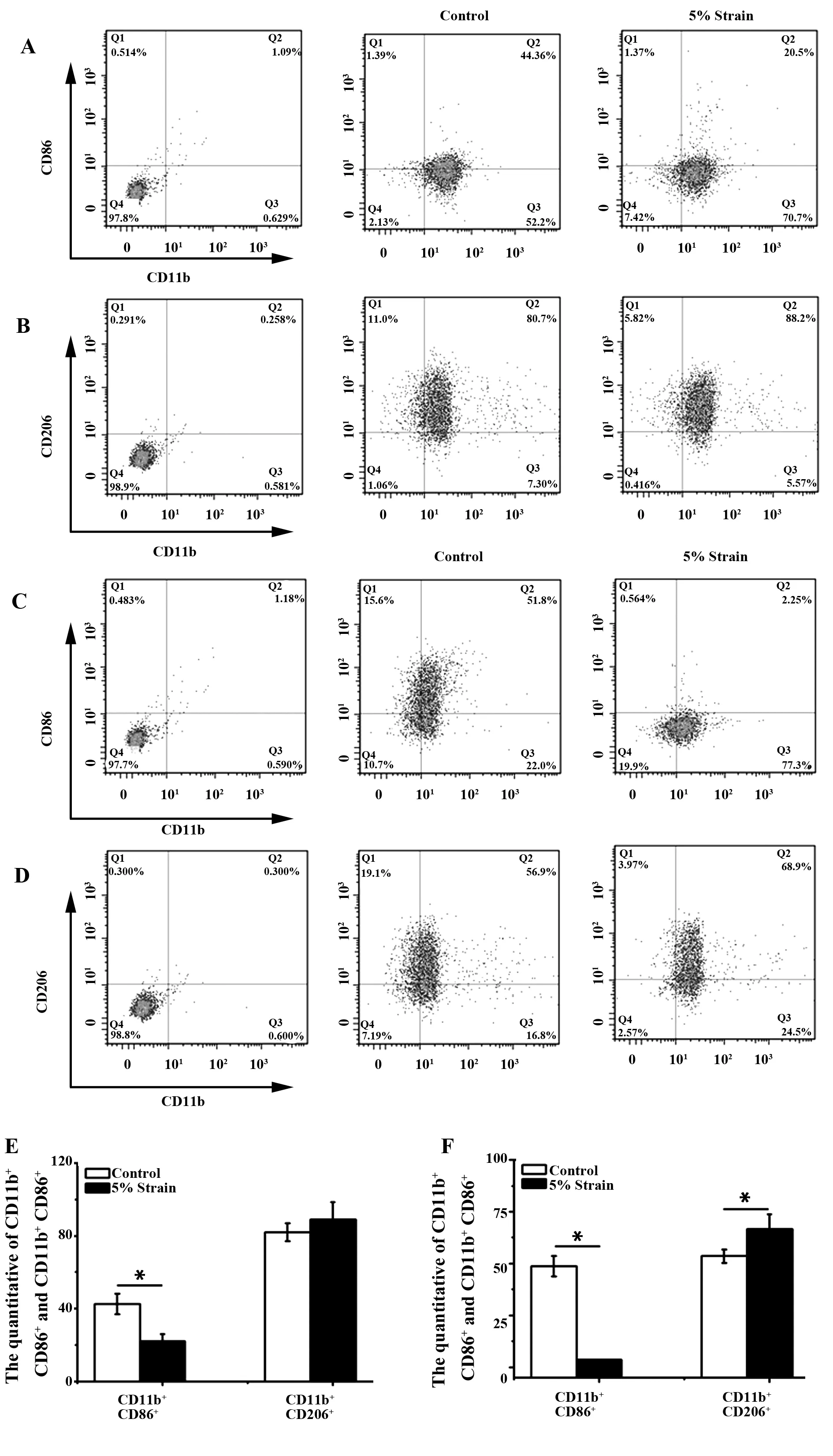
图2 5%幅度的拉伸对Raw264.7细胞表面CD86和CD206分子表达的影响Fig.2 Effect of 5% amplitude cyclic tensile strain on CD86 and CD206 expression of Raw264.7 cellsNote:A,B,E.The result of flow analysis on the third day;C,D,F.The result of flow analysis on the fifth day;compared with control group,*.P<0.05.
3 讨论
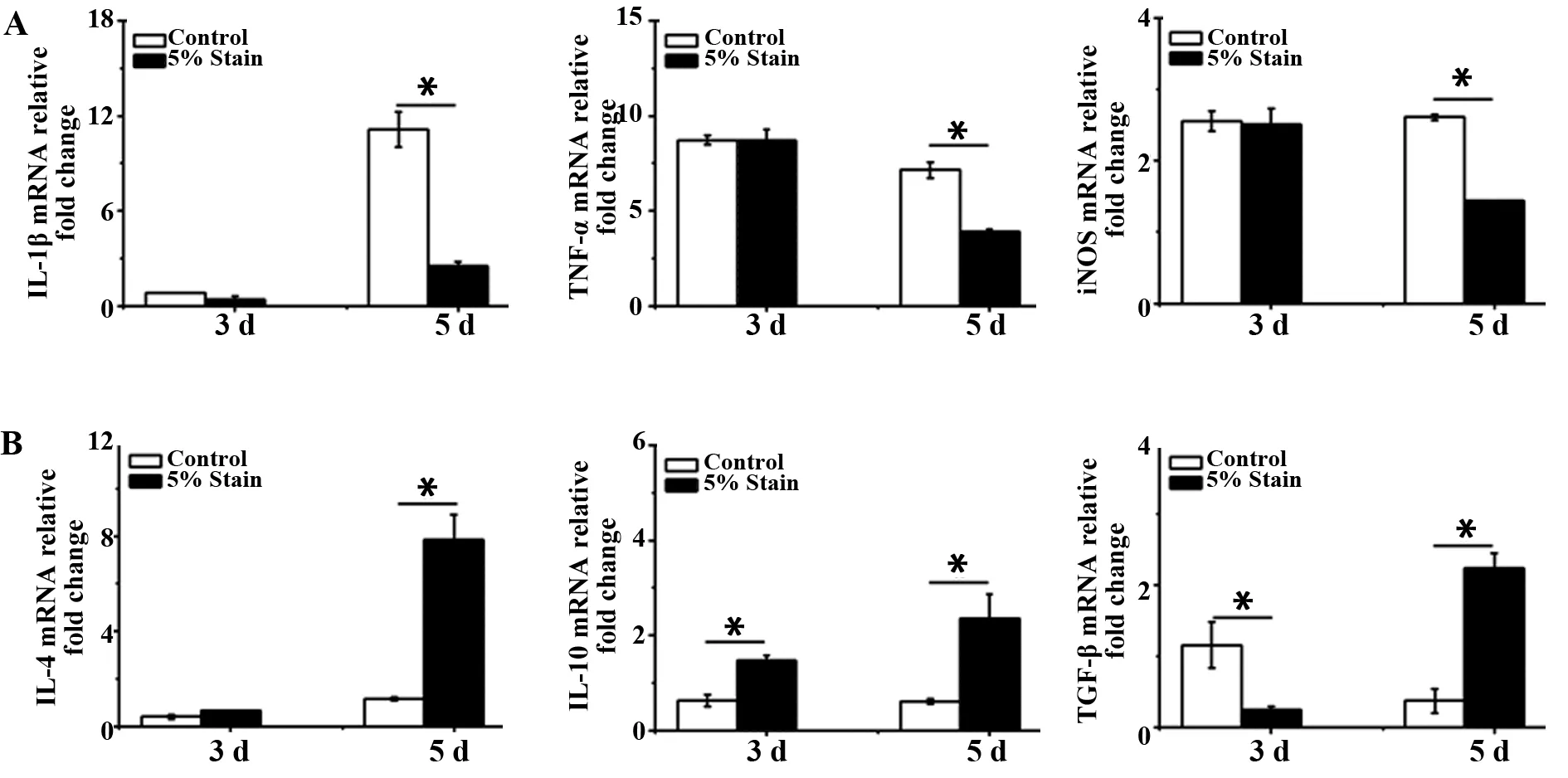
图3 5%幅度的拉伸对细胞因子基因表达的影响Fig.3 Effect of 5% amplitude cyclic tensile strain on expression of inflammation and anti-inflammation genesNote:Compared with control group,*.P<0.05.
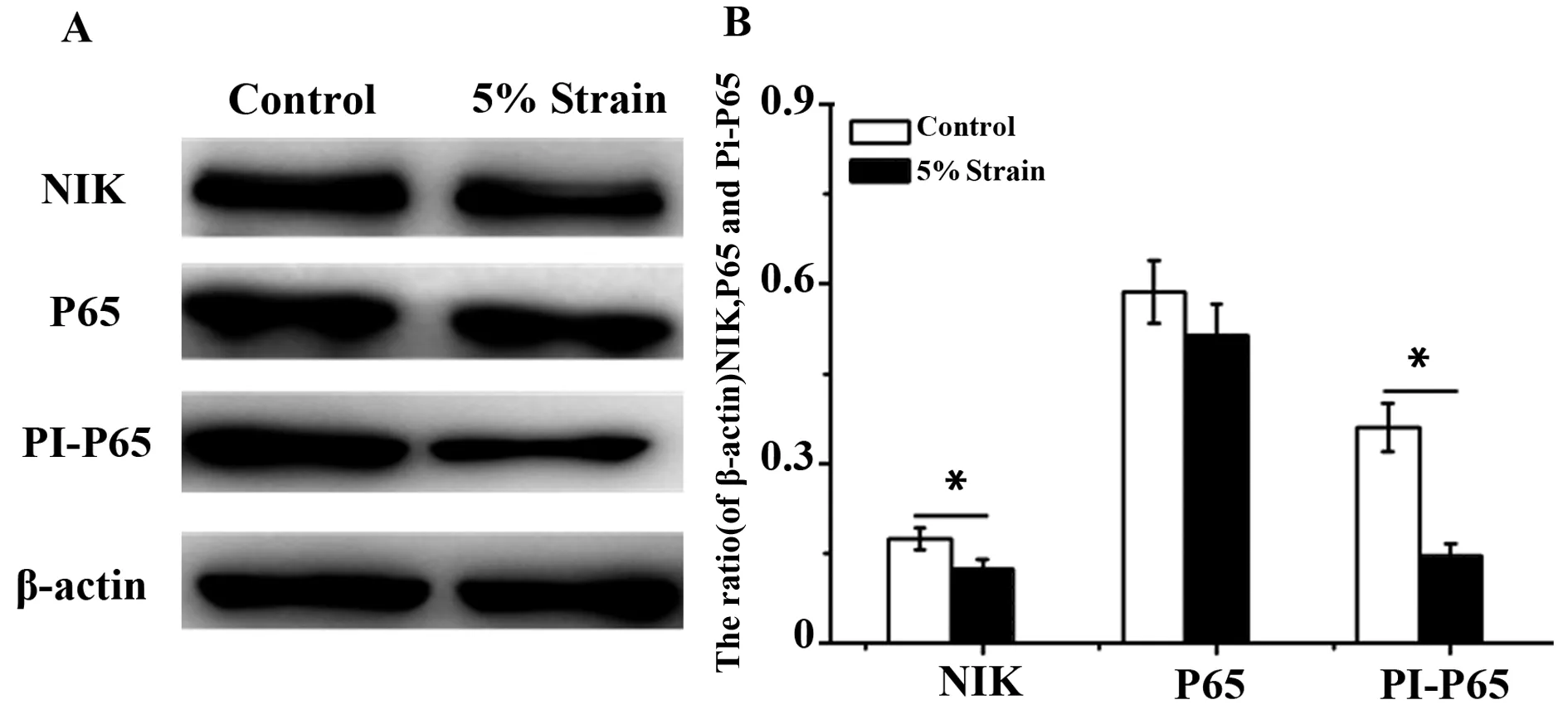
图4 5%幅度的拉伸对NF-κB信号通路激活的影响Fig.4 Effect of 5% amplitude cyclic tensile strain on activation of NF-κB signaling pathwayNote:Compared with control group,*.P<0.05.
随着科学与医学的进步,人类发现巨噬细胞涉及几乎每一种人类疾病,并在疾病的预防及治疗中发挥重要作用。巨噬细胞是免疫系统的重要组成部分,它们不同的表型,经典活化(M1)和替代性活化(M2),在组织再生活动如外来体反应(FBR)和组织重塑中起关键作用[7],因此调控巨噬细胞的M1/M2比例为再生治疗提供了新的思路和策略。巨噬细胞在组织修复中发挥重要作用[12-14],如在血管修复方面,在炎症早期,M1型巨噬细胞会分泌VEGF、IL-1β和TNF-α等,而这些炎症因子可以有效防御病原体或细菌感染伤口。如果炎症反应在适当的时期没有终止,就会导致组织损伤,因此,在发生炎症反应之后,必须要有组织的修复过程,M2型巨噬细胞则通过分泌PDGF招募间质干细胞和周细胞,使其附着在新生毛细血管内皮细胞上来稳定新生血管[15]。此外,M2巨噬细胞能够调节炎症反应和适应性Th2免疫,促进血管生成,组织重塑和修复[8,16]。
机械刺激的生理水平对于组织中细胞的生长和成熟是重要的,存在于这些组织中的巨噬细胞也暴露于机械刺激并做出反应。有研究证明3%~8%幅度的力学刺激对于大多数细胞无损伤,在本实验中活/死细胞染色实验中可以看出5%幅度的拉伸对细胞的生长状态并不会有太大的损伤。有文献报道低幅度的拉伸(6%)可以通过下调Raw264.7细胞mRNA的活化水平而显著性抑制IL-1β的表达,通过抑制IL-1β细胞因子的表达,拉伸应变可以显著降低IL-1β依赖性免疫应答[17]。另有文献报道在体外,只有低幅度拉伸刺激会引起抗炎反应,而高幅度拉伸(15%~18%)会促进炎症反应[18,19],因此在本研究中,我们选择研究5%幅度的拉伸对Raw264.7细胞的M1/M2极化的影响。有文献报道,CD86和CD206可分别作为M1和M2巨噬细胞的表面标志[20]。如图2、3所示,M1激活标志物CD86、IL-1β、TNF-α及M2激活标志CD206、IL-4[20],相对于对照组而言,5%拉伸刺激后,Raw264.7细胞的CD206+/CD86+的表达比例增强,在基因表达方面,抗炎基因IL-4和IL-10的表达增强,炎症基因IL-1β和TNF-α的表达显著性下降,而且连续拉伸5 d后,抑制炎症基因和促进抗炎基因的表达效果要强于3 d。综上所述,我们可以认为通过合适的拉伸幅度确实可以显著抑制炎症表达和促进抗炎反应,从而进一步促进组织的重塑和再生。
当细胞暴露于不同的机械应变水平下,作用于细胞骨架的力会导致多个机械传感器激活的差异性,从而导致细胞的表达发生变化。随着对细胞骨架认识的逐渐深入,人们发现细胞骨架在细胞对力学刺激的感受和信息传导的过程中起重要作用。机械刺激作用于细胞后,可以通过蛋白激酶C、整合素以及丝裂原激活蛋白激酶等多条信号通路,且各种信号传导通路中存在交联,从而影响细胞骨架的重组,并将力学刺激进一步转换成化学信号,最终完成其生物效应[21]。NF-κB参与机体免疫、炎症和细胞凋亡等多种条件下的基因调控,静息状态下,NF-κB与抑制蛋白IκB-α结合,存在于胞浆中。当细胞受到外界刺激后,IκB磷酸化降解,P65与IκB解离进入细胞核,与靶基因启动子或增强子的κB序列结合,启动和调控众多促炎细胞因子和炎症介质(如TNF-α等)表达[22]。目前证实NF-κB可诱导细胞因子(如IL-β、IL-6、TNF-α)的过度或持续的表达,进而导致炎症细胞浸润,聚集于炎症部位,最终形成炎症反应[23]。如图所示,Western blot结果可以得到5%幅度的力学刺激对NF-κB信号通路的激活有抑制作用,当细胞外的拉伸信号传至细胞内,导致巨噬细胞向M2方向的极化,抑制了巨噬细胞分泌炎症因子。巨噬细胞将感受到的力学刺激在体内转化为生物信号,传至细胞下游,引起NIK蛋白表达发生变化,继而进一步引起P65蛋白核移位的变化,最终导致NF-κB信号通路激活被抑制。巨噬细胞在5%幅度的力学刺激后会通过抑制NF-κB信号通路的激活,进而抑制巨噬细胞向M1极化,促进巨噬细胞向M2方向极化。
研究表明,IL-1β、IL-6、TNF-α等炎症因子能刺激破骨细胞活化,抑制细胞骨形成。文献报道抗炎物质15-Deoxy-△12,14-S前列腺素J2被用于大鼠股骨皮质缺损时,可减弱周围软组织中IL-6、IL-1β和TNF-α的表达同时促进和促进与骨再生有关的生长因子的分泌和随后的新骨形成[24]。研究发现,脉狭窄血管再通后肾功能得到改善、纤维化减轻,并使M1/M2比值降低,另外M2巨噬细胞通过刺激产生鸟氨酸以促进细胞增殖,通过促进TGF的产生及合成多胺和胶原进行组织修复[25]。5%幅度的拉伸通过抑制NF-κB信号通路从而抑制巨噬细胞向M1方向极化,促进巨噬细胞向M2方向极化,并引起抗炎因子分泌的增多,从而在组织修复中发挥作用。综上所述,5%幅度拉伸的力学刺激Raw264.7细胞,抑制了NF-κB信号通路的激活,同时抑制了CD86分子的表达和促进了CD206分子的表达;进一步分析发现适度力学刺激下Raw264.7细胞可降低致炎症因子IL-1β、IL-6、TNF-α的分泌而提高抗炎症合成,促进Raw264.7向M2方向极化,为通过力学刺激调控巨噬细胞的极化促进组织重塑和再生提供了实验依据。