长链非编码PCA3靶向miR-194影响前列腺癌细胞增殖和凋亡行为①
2019-01-03韩兴涛杨凌博魏澎涛李小辉孙建涛杨锦建
韩兴涛 杨凌博 魏澎涛 李小辉 孙建涛 杨锦建
(洛阳市中心医院泌尿外科,洛阳 471000)
前列腺癌是泌尿外科最常见的恶性肿瘤之一,尤其是在发达国家,前列腺癌的发病率一直居高不下[1]。虽然亚洲地区的前列腺癌发生率稍低于西方发达国家,但是近年来有不断增长的趋势[2]。广泛的前列腺特异性抗原筛选技术的进步使前列腺癌的早期诊断率有所增加[3]。但是目前仍没有公认的标准诊断方法,研究前列腺癌发展的分子和细胞机制是目前的主要研究热点。
前列腺癌基因3(Prostate cancer antigen 3,PCA3)是在前列腺癌组织发现的一种表达水平异常的分子标志物[4]。PCA3是一种具有自我更新能力的基因,在多种人类肿瘤中呈现过表达状态,包括肺癌、乳腺癌、前列腺癌、卵巢癌等[5-8]。PCA3还是一种具有促癌作用的功能性lncRNAs,有研究指出PCA3的表达异常可以导致细胞生长速度减缓,影响肿瘤细胞的发展进程[9]。
微小RNA(miRNA)是一种单链非编码的调节RNA,可以通过碱基配对起到抑制蛋白质表达的作用,从而影响mRNA翻译或降解过程[10]。异常表达miRNA在各种人类恶性实体肿瘤中都存在,包括前列腺癌[11]。有研究发现由miR-194介导的BMI蛋白表达的机制与前列腺癌的侵袭直接相关[12]。因此探讨相关miRNA在前列腺癌中的表达及机制有助于推动前列腺癌的诊断和治疗的进展。
本研究拟探讨PCA3和miR-194对下游通路蛋白的影响作用,通过对前列腺癌细胞生物学行为的验证及下游通路的激活情况,明确PCA3和miR-194在前列腺癌中的可能作用机制,以期为前列腺癌的诊治提供一个潜在的新靶标。
1 材料与方法
1.1材料 前列腺癌细胞株PC-3M-2B4、PC3、Du145和LNCaP均购自上海细胞研究所,用含有10%胎牛血清的RPMI1640培养液在37℃、 5%CO2的培养箱中培养和传代。Ras、MEK1、MEK2抗体购自美国Abcam公司(ab52939、ab32091、ab32517)。脂质体Lipofectamine 2000、PCA3+siRNA和miR-194-mimic购自重庆艾生生物科技公司。Trizol购自北京天辰生物科技公司。反转录试剂盒(FSQ-101)购自日本TOYOBO公司(FSQ-101)。PCR试剂盒购自成都荣海生物公司。荧光素酶活性检测试剂盒购自北京Promega公司。荧光素酶报告载体购自上海吉尔生物公司。
1.2方法
1.2.1qPCR试验 使用Trizol试剂提取前列腺癌细胞的总RNA,并使用TM miRNA分离试剂盒(Ambion,Austin,TX,USA)进一步纯化miRNA部分。通过光谱测定RNA样品的浓度和纯度。PCA3的引物序列:5′-CATTTATATTGCTGGCCCTTCTGC-TTTC-3′(正向)和5′-GAAAGCAGAAGGGCCATAAAAGTAATG-3′(反向)。 miR-194的引物序列:5′-GAGTTTGATCATGGCTCAGAGAGTTTGATCCTG-3′(正向)和5′-CGACGGCCAGTCTTACCAGGAAACAGCTATG3′(反向)。使用实时PCR系统进行实时反转录PCR(qPCR)。使用U6管家基因作为对照。使用2-ΔΔCt方法计算肺癌细胞的miRNA相对表达量。实验重复3次。
1.2.2双荧光素酶活性测定 为了检测PCA3和miR-194的相关关系,我们使用双荧光素酶实验进行测定,将24孔板中的LNCaP细胞与0.4 mg荧光素酶报告载体和0.1 mg含有海肾萤光素酶(Promega)的pRL-TK对照载体共转染,根据 siPORTneoFX使用方法操作,在转染后48 h制备裂解物。使用双荧光素酶报告基因测定系统(Promega),测定转染24 h后荧光素酶活性。实验重复3次。
1.2.3克隆形成实验检测前列腺癌细胞的增殖能力 常规培养的前列腺癌LNCaP细胞经胰酶消化后,1 000 r/min离心3 min,离心半径12 cm,弃去上清液。加入5 ml的无菌PBS溶液,轻轻吹散洗涤细胞沉淀并再次离心。反复洗涤3次后加入培养液,制备成单细胞悬液。测定前列腺癌LNCaP细胞浓度并调整为1 000 cells/ml,将单细胞悬液均匀种植在无菌6孔板内,进行克隆形成培养。分为PCA3+siRNA实验组和NC对照组。每3 d更换一次培养基,14 d后观察肿瘤细胞克隆形成情况。实验重复3次。
1.2.4细胞凋亡实验 实验前约24 h,接种两瓶LNCaP细胞,标记①、②,每瓶含约6 ml培养液,置37℃、5%CO2培养箱培养。 实验前约2.5 h,当细胞密度达到70%时,①号瓶加入三尖杉酯碱200 μl,使终浓度为1 μg/ml;②号瓶中加入同等量的PBS(pH7.4)作对照。共同放入培养箱中继续培养2.5 h。染色:将瓶中的细胞摇匀取200 μl于1.5 ml的离心管中,加入配置液2 μl,PI 染液20 μl,染色15 min。滴片:取载玻片用双面胶围成一小室,从离心管中各取以上染色后的细胞悬液10 μl,加入小室内盖上盖玻片,荧光镜下用紫外激发光,高倍镜下观察,区别三种细胞,并注意三者比例。
1.2.5Western blot蛋白印迹分析 用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离细胞总蛋白,并将其转移到硝酸纤维素膜(Bio-Rad,Hercules,CA)上。使用5%脱脂牛奶充分封闭膜,并与一抗(Ras、MEK1、MEK2浓度1∶1 000),内参GAPDH(浓度1∶2 000),4℃,孵育过夜。次日,TBST充分冲洗过后,使用二抗辣根酶标记物(浓度1∶2 000)孵育2 h,TBST充分冲洗过后,使用碧云天化学发光试剂ECL显影液检测目标蛋白的表达水平。使用GAPDH作蛋白内参对照。实验重复3次。
1.3统计学方法 所有实验数据统计使用SPSS统计软件进行分析。组间数据分析使用t检验。P<0.05时差异具有统计学意义。
2 结果
2.1前列腺癌细胞株中PCA3和miR-194的表达水平 qPCR结果表明:与其他细胞株相比,LNCaP细胞中PCA3 mRNA表达水平明显较高[(1.52±0.23) vs (0.29±0.08),P=0.004],差异有统计学意义,见图1A;miR-194在LNCaP细胞株中表达水平比其他前列腺癌细胞低(P=0.016),见图1B。所以我们挑选LNCaP作为进一步生物学功能实验的细胞株。
2.2双荧光素酶检测PCA3和miR-194之间的关系 为明确与PCA3相关的miRNA的情况,我们使用生物信息学预测工具发现PCA3可能与miR-194有直接作用,两者有相似的结合序列,见图2A。为了验证PCA3能否与miR-194 3′UTR结合,我们将PCA3-siRNA与miR-194共转染到前列腺癌LNCaP细胞中。双荧光素酶报告基因结果显示:PCA3-siRNA可以明显抑制miR-194的荧光素酶活性(P=0.025),见图2B。结果表明,PCA3-siRNA能与miR-194的3′UTR特异性结合。

图1 PCA3和miR-194在前列腺癌细胞株中的表达Fig.1 PCA3 and miR-194 expression in prostate cancer cell lines
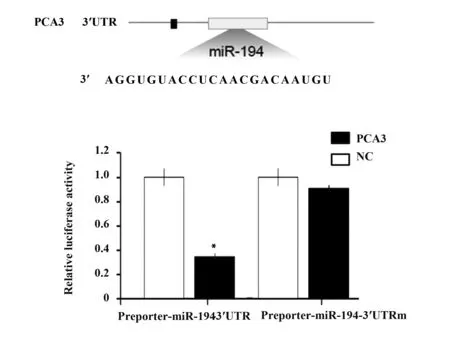
图2 双荧光素酶检测PCA3和miR-194之间的关系Fig.2 Dual luciferase assay for the relationship between PCA3 and miR-194Note:A.Binding sites for PCA3 and miR-194;B.Double luciferase to detect the relationship between PCA3 and miR-194.*.P<0.05.
2.3PCA3对前列腺癌细胞增殖和凋亡的影响 克隆形成结果显示(图3A、B):PCA3+siRNA组的细胞数目明显少于NC对照组的细胞数目[(170.25±5.61)vs(58.36±3.95),P=0.019],差异有统计学意义。凋亡试验结果表明,PCA3+siRNA组细胞凋亡数目明显多于NC对照组的细胞凋亡数目,表明PCA3可以抑制肿瘤细胞的凋亡行为,见图3C。综上结果表明,抑制PCA3的表达可以减弱前列腺癌LNCaP细胞的增殖能力,且可在一定程度上加速其凋亡进程。
2.4miR-194和PCA3对前列腺癌细胞增殖作用的逆转影响 为了检测miR-194和PCA3对前列腺癌LNcaP细胞增殖和凋亡能力的影响,克隆形成结果显示(图3A):PCA3-siRNA+miR-194-mimic组的细胞数目明显多于PCA3+siRNA的细胞数目[(195.59±11.42)vs(78.34±5.64),P=0.008],差异有统计学意义,见图4A、B。凋亡试验结果(图4C),表明PCA3+siRNA+miR-194-mimic组细胞凋亡数目与PCA3+siRNA组的细胞凋亡数目相近,说明miR-194可以在一定程度上逆转肿瘤细胞的凋亡行为。综上结果表明,miR-194可以逆转PCA3对前列腺癌LNCaP细胞增殖能力的影响,且可在一定程度上逆转LNCaP细胞的凋亡行为。
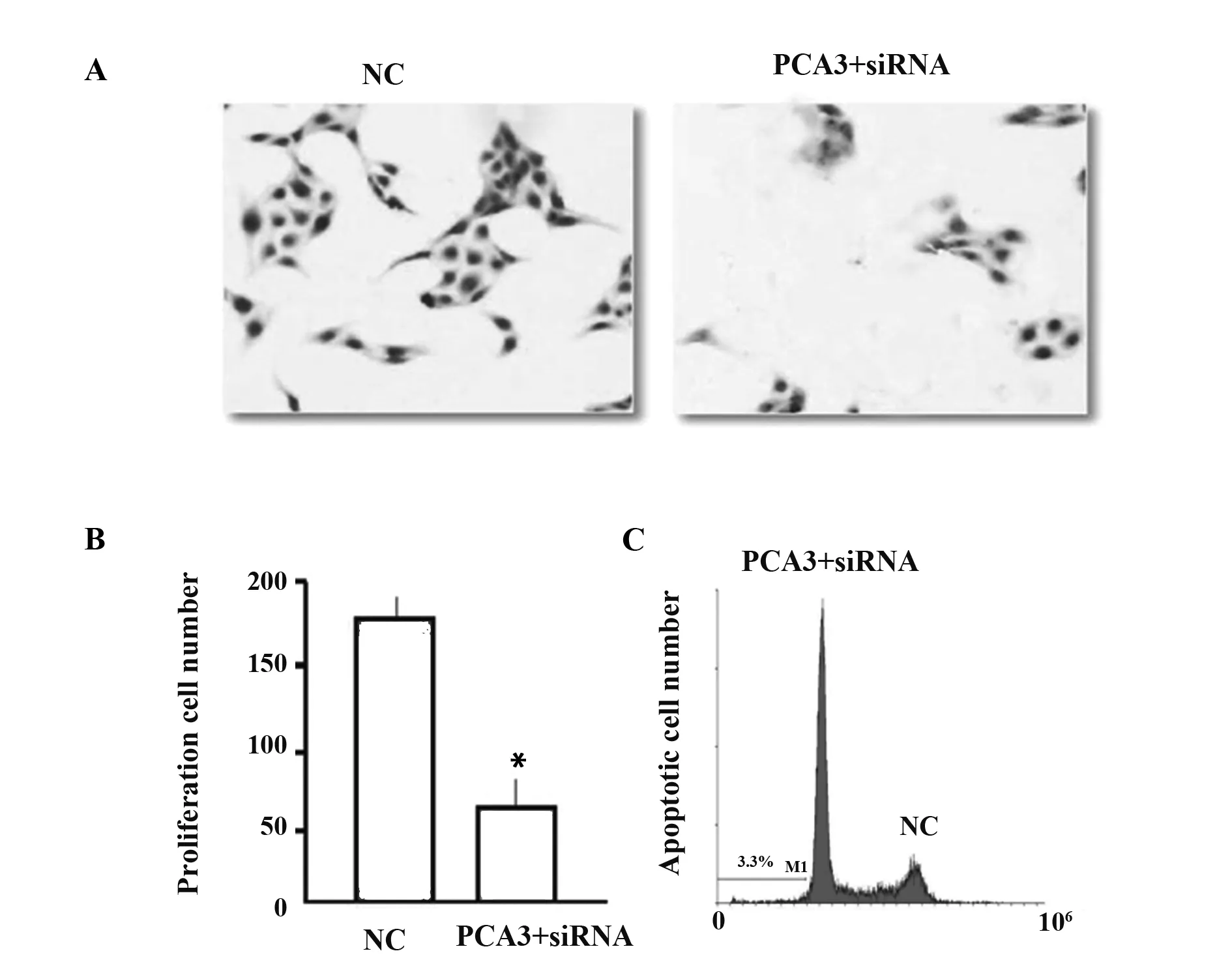
图3 PCA3对前列腺癌细胞增殖和凋亡的影响Fig.3 Effect of PCA3 on proliferation and apoptosis of prostate cancer cellsNote:A.Effect of PCA3 on proliferation of prostate cancer cells;B.PCA3 on apoptosis of prostate cancer cells;C.Apoptosis assay was used to detect the effects of PCA3 on the apoptosis of prostate cancer cells.*.P<0.05.

图4 miR194对PCA3逆转前列腺癌细胞增殖的影响Fig.4 Effect of miR-194 on the reversal effect of PCA3 on proliferation of prostate cancer cellsNote:A.miR-194 reverses the proliferation of prostate cancer LNcaP cells;B.miR-194 on apoptosis of LNCaP cells in prostate cancer;C.Apoptosis assay was used to detect the effects of PCA3 and miR-194 on the apoptosis of prostate cancer cells.*.P<0.05.

图5 PCA3对ERK信号通路的激活情况Fig.5 Activation of ERK signaling pathway by PCA3Note:A.Effect of PCA3 on protein expression in ERK signaling pathway;B.The corresponding expression level of the ERK signaling pathway protein.*.P<0.05.

图6 miR-194对ERK信号通路的影响Fig.6 Effect of miR-194 on ERK signaling pathwayNote:A.Effect of miR-194 on the reversal of protein levels in ERK signaling pathway;B.Effects of miR-194 on the expression of ERK signaling protein.*.P<0.05.

图7 抑制PCA3后前列腺癌LNCaP细胞成瘤能力减弱Fig.7 Prostate cancer LNCaP cells have reduced tumorigenic ability after inhibition of PCA3Note:A.Ability in the vivo tumorigenicity of LNCaP cells were enhanced in nude mice after silencing PCA3;B,C.Comparison of tumor volume and quality in nude mice.*.P<0.05.
2.5PCA3对ERK信号通路的激活情况 在PCA3+siRNA实验组中MEK1和MEK2的表达情况比NC组的明显降低[MEK1(0.85±0.16)% vs(0.25±0.05)%,P=0.016;MEK2(0.89±0.09)% vs(0.36±0.10)%,P=0.019],而Ras的表达水平升高[Ras(0.51±0.06)% vs(0.98±0.12)%,P=0.021],见图5A、B。结果表明,抑制PCA3后,ERK信号通路相关蛋白的激活水平受到一定的影响,表明PCA3的表达和ERK信号通路的激活有相关关系。
2.6miR-194对ERK信号通路的影响 在PCA3+siRNA+miR-194-mimic组中MEK1和MEK2的表达情况相比PCA3+siRNA组升高[MEK1(0.52±0.06)% vs(0.21±0.05)%,P=0.033;MEK2(0.75±0.11)% vs(0.31±0.08)%,P=0.031],而Ras的表达水平升高[Ras(0.60±0.06)% vs(1.23±0.22)%,P=0.013],见图6A、B。结果表明,过表达miR-194后,ERK信号通路相关蛋白水平得到一定的恢复,表明miR-194在一定程度上可以逆转PCA3对ERK信号通路的抑制作用,间接说明PCA3可能是通过miR-194对下游ERK信号通路进行调控的。
2.7抑制PCA3后,前列腺癌LNCaP细胞成瘤能力减弱 裸鼠体内成瘤实验表明,与对照组相比,抑制PCA3后的前列腺癌LNCaP细胞在裸鼠体内成瘤能力明显减弱,4周后肿瘤体积较对照组大[(1.35±0.15)cm3vs(0.39±0.16)cm3,P<0.05],4周后肿瘤质量较对照组重[(1.34±0.09)g vs (0.42±0.12)g,P<0.05],差异有统计学意义。见图7。说明抑制PCA3后前列腺癌LNCaP细胞的裸鼠体内成瘤能力相应减弱。表明PCA3对前列腺癌细胞的成瘤能力有一定的增强作用,可能在前列腺癌的发展过程中起到一定的促癌作用。
3 讨论
前列腺癌是最常见的泌尿系统恶性肿瘤之一,尤其在西方发达国家[13]。目前前列腺癌的早期检测主要依赖于直肠指检和前列腺特异性抗原(PSA)的筛查,但是,由于其阳性预测值较低,只有10%~35%的患者可以早期筛查出来,而且前列腺活检的可实施性不高[14]。针对前列腺癌的分子基因方面的研究是目前的研究热点,尤其是新的前列腺癌基因筛查。
美国学者报道,PCA3针对前列腺癌的诊断准确性较高,在多数前列腺癌患者中都存在异常表达,和PSA联合筛查可以提高前列腺癌72%的诊断特异性和58%的敏感度[15]。也有学者指出,PCA3和前列腺癌的临床病理参数有一定的关联[16]。以前的研究已经将PCA3列为前列腺癌的高效诊断指标,然而其在前列腺癌中的作用方式及机制说法不一。我们通过生物信息学预测PCA3和相关miRNA在前列腺癌中的表达关系,然后进一步验证其可能的作用机制,为揭示PCA3在前列腺癌中的具体作用方式提供支持。
miRNA是一类内源性的、高度保守的非编码单链RNA,广泛存在于植物和多细胞动物的基因组中[17]。miR-194的编码基因位于染色体12p36上,研究表明,miR-194受多种抑癌基因的直接调控,从而影响下游靶基因发挥生物学功能。何涵等[18]使用miR-194-mimic转染肝细胞癌细胞,发现肝癌细胞的增殖能力明显减弱。miR-194已被证实在多种肿瘤的生长过程中扮演重要作用。例如,在最近的一项研究中发现,miR-194是通过减少肝细胞EMT来影响肝癌细胞的转移[19]。
本研究试图通过研究PCA3和miR-194之间的相互关系,推断出PCA3和miR-194在前列腺癌中的作用方式。首先通过双荧光素酶实验证实PCA3可以调控miR-194的表达及活性,然后通过MTT增殖实验和细胞凋亡实验检测PCA3对前列腺癌细胞增殖能力和凋亡行为的促进作用,之后转染miR-194-inhibitor后发现前列腺癌细胞被抑制的增殖能力和凋亡行为得到一定程度的逆转,表明PCA3是通过调控miR-194表达活性影响前列腺癌细胞的生物学行为。同时Western blot实验检测到ERK信号通路的关键蛋白表达水平也受PCA3和miR-194的调控。ERK信号通路受到多种miRNA调控,介导不同肿瘤细胞的生长和凋亡行为[20]。针对ERK通路蛋白在细胞中的表达水平不同,有研究提出其可能和细胞表面受体数量和活性相关,当其表达上调或激活时,可以影响细胞本身的增殖行为[21]。
本研究通过以上实验提示PCA3和miR-194可能通过ERK信号通路参与前列腺癌细胞增殖过程和凋亡行为,为前列腺癌的早期诊断和治疗方式的改变提供一定的理论支持,为前列腺癌的治疗效果和预后监测提供帮助。