铜绿假单胞菌F190—342-I21—83基因的克隆及其融合蛋白的原核表达
2019-01-03张明亮闫新武孙长江顾敬敏崔子寅韩文瑜
张明亮,闫新武,孙长江,顾敬敏,崔子寅,韩文瑜*
(1.河南省动物疫病防控与营养免疫院士工作站,河南 安阳 455000; 2.吉林大学 动物医学学院,吉林 长春130062; 3.安阳工学院 生物与食品工程学院,河南 安阳455000; 4.河南省孟津县动物卫生监督所,河南 孟津 471100)
铜绿假单胞菌(Pseudomonasaeruginosa)属革兰氏阴性杆菌,能够引起以鼻孔及嘴角流血为主要特征的水貂出血性肺炎,造成发病水貂突然死亡。自1953年首次确认铜绿假单胞菌是水貂出血性肺炎的病原以来,该病在全球迅速扩散,给水貂养殖业带来了巨大的损失[1]。长期以来,抗生素是防治水貂出血性肺炎的有效武器。然而,随着抗生素的滥用,铜绿假单胞菌的耐药性呈现日渐升高的趋势,常规抗生素对其防治效果越来越差。因此,亟须开发新的防治手段。
F基因和I基因分别编码铜绿假单胞菌的2种外膜蛋白。研究表明,铜绿假单胞菌的外膜蛋白F在铜绿假单胞菌黏附真核细胞的过程中起着重要的作用,参与了诸多侵染过程[2]。铜绿假单胞菌拥有众多血清型,但外膜蛋白F高度保守的特性突出。外膜蛋白F作为铜绿假单胞菌重要的孔蛋白,在前期的研究中展现出了良好的免疫原性,能够使动物和人类免受多种血清型铜绿假单胞菌的感染,已被证实是应对铜绿假单胞菌的重要保护性抗原[3]。此外,外膜蛋白I作为重要的保守抗原,也能诱导动物产生高滴度的抗体,在清除感染动物体内铜绿假单胞菌方面显示出很大的优势[4]。F190—342-I21—83是F蛋白和I蛋白重要肽表位的融合体[5],在小鼠感染模型、烧伤模型等研究中凸显出产生保护性抗体的优越性[6]。但在铜绿假单胞菌引发的水貂出血性肺炎的病原检测方面以及保护性生物制品的开发方面,关于F蛋白和I蛋白的应用尚属空白。因此,本研究在临床分离的水貂源铜绿假单胞菌ZHDL9菌株基因组的基础上,克隆出铜绿假单胞菌外膜蛋白F和I的表位基因F190—342(F1)和I21—83(I2),将其无缝融合后,构建原核表达重组质粒pET-28a-F1I2,在大肠杆菌BL21(DE3)中诱导表达融合蛋白F1I2,旨在为防治水貂出血性肺炎生物制品的研究与开发提供理论基础。
1 材料和方法
1.1 菌株、质粒及血清
水貂源铜绿假单胞菌ZHDL9菌株、大肠杆菌克隆菌株DH5α、表达菌株BL21(DE3)、表达质粒pET-28a及ZHDL9菌株水貂阳性血清(效价1∶2 000)均来自于河南省动物疫病防控与营养免疫院士工作站。
1.2 主要试剂
铜绿假单胞菌选择性分离培养基(溴化十六烷基三甲铵琼脂培养基)购自青岛高科园海博生物技术有限公司;ExTaqDNA polymerase、T4 DNA 连接酶、DL15000 DNA Marker及DL2000 DNA Marker均购自Takara公司;限制性内切酶购自Promega公司;质粒及细菌基因组提取试剂盒均购自Omega公司;TAB显色液购自福建迈新生物科技有限公司;HRP标记的兔抗水貂IgG购自北京博奥森生物技术有限公司;His标签蛋白纯化镍柱购自Thermo公司;标准蛋白质Marker购自NEB公司。
1.3 引物的设计与合成
参照GenBank公布的OprF序列(JX040481.1)与OprI序列(X58714.1)分别设计含有EcoRⅠ和HindⅢ酶切位点的引物PF1/PF2与PI1/PI2,引物合成由北京六合华大基因科技股份有限公司完成(表1)。

表1 铜绿假单胞菌F1和I2基因的PCR扩增引物序列
注:下划线部分为限制性酶切位点。
1.4 铜绿假单胞菌基因组及质粒提取
参照Omega公司基因组提取试剂盒及质粒提取试剂盒说明书获得铜绿假单胞菌ZHDL9菌株基因组及质粒提取产物。
1.5 铜绿假单胞菌F1I2融合基因的获取
以获得的ZHDL9菌株基因组为模板,采用引物PF1/PF2扩增F1基因片段,反应程序为:94 ℃ 2 min;94 ℃ 30 s,65 ℃ 45 s,72 ℃ 45 s,30个循环;72 ℃ 10 min。以获得的ZHDL9菌株基因组为模板,采用引物PI1/PI2扩增I2基因片段,反应程序为:94 ℃ 2 min;94 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,30个循环;72 ℃ 10 min。
将上述所得F1和I2基因进行融合,共分2步进行。第1步反应程序为:94 ℃ 2 min;94 ℃ 15 s,60 ℃ 15 s,72 ℃ 15 s,10个循环;72 ℃ 5 min。第2步反应程序为:94 ℃ 2 min;94 ℃ 40 s,62 ℃ 1 min,72 ℃ 1 min,30个循环;72 ℃ 10 min。
将最终获得的F1I2融合基因克隆至pMD18-T质粒中,阳性重组质粒命名为pMD18-T-F1I2,送至上海生工生物工程技术服务有限公司测序。
1.6 重组表达菌株BL21(pET-28a-F1I2)的构建及鉴定
将获得的重组质粒pMD18-T-F1I2与质粒pET-28a同时用限制性内切酶HindⅢ和EcoR Ⅰ 进行双酶切,然后回收F1I2融合基因片段和pET-28a质粒片段,并用T4 DNA连接酶连接。转化至大肠杆菌感受态BL21(DE3),将阳性转化子BL21(pET-28a-F1I2)扩大培养,小批量制备质粒,用内切酶EcoR Ⅰ 和HindⅢ消化后,经1%琼脂糖凝胶电泳检测鉴定。
1.7 融合蛋白F1I2的诱导表达及纯化
将重组菌株BL21(pET-28a-F1I2)和对照菌株BL21(pET-28a)分别接种至含50 μg/mL KANA的LB液体培养基中,37 ℃培养至OD600为0.6时,加入1 mmol/L的IPTG,25 ℃诱导8 h。分别取适量菌液于1.5 mL EP管中,离心后弃上清,使用无菌PBS重悬菌体,并加入5×Loading Buffer,煮沸10 min,离心后取上清,用12% SDS-PAGE检测目的蛋白的表达。电泳结束后,将蛋白胶置于染色液中,染色2 h。最后,将蛋白胶置于脱色液中脱色至条带清晰。
将诱导表达的重组菌BL21(pET-28a-F1I2)离心后,用无菌PBS洗涤2遍,取适量的MES Buffer重悬沉淀。将重悬菌液置于小烧杯中,并在冰浴中超声破碎,待菌液超声破碎至澄清时,取出菌液。6 000 r/min、4 ℃离心10 min,取上清。上清经0.8 μm滤器过滤后加入准备好的His标签蛋白纯化镍柱,进行F1I2融合蛋白的纯化。最后向纯化柱中加入适量的洗脱液洗脱蛋白质,SDS-PAGE检测纯化后的融合蛋白F1I2。
1.8 融合蛋白F1I2表达的检测
Western Blotting检测重组蛋白的表达情况。首先将重组菌BL21(pET-28a-F1I2)和对照菌BL21(pET-28a)的纯化蛋白样品电泳后转印至聚偏二氟乙烯(PVDF)膜,转膜时间为7 min。转膜结束后,将其置于封闭液中,室温封闭4 h。以ZHDL9菌株水貂阳性血清为一抗、HRP标记的兔抗水貂IgG为二抗,TAB避光显色后观察结果。
2 结果与分析
2.1 F1基因和I2基因的克隆及信息学分析
对PCR扩增得到的F1基因(图1A)和I2基因(图1B)进行1%琼脂糖凝胶电泳后,分别得到462 bp和189 bp的条带,与目的条带大小相符。
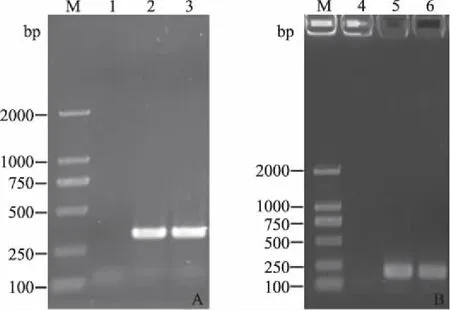
M:DL2000 DNA Marker; 1、4:阴性对照; 2、3:F1基因PCR扩增产物; 5、6:I2基因PCR扩增产物图1 F1基因(A)和I2基因(B)的PCR扩增结果
将PCR扩增得到的F1和I2基因序列分别与NCBI上登录的铜绿假单胞菌序列MFY72、ATCC3542、LMG1242和W15AUG19、ATCC3542、PAO1进行比对分析,同源性分别在99.6%~100.0%和99.5%~100.0%,表明F1基因序列和I2基因序列与已报道的序列相比高度保守(图2A和2B)。
2.2 重组表达菌株BL21(pET-28a-F1I2)的构建及鉴定
F1基因和I2基因经融合PCR后,通过1%琼脂糖凝胶电泳,得到的F1I2融合基因条带与651 bp的预测条带大小相符,表明成功构建了融合基因F1I2(图3A)。将得到的融合基因F1I2连接至pMD18-T质粒,得到重组质粒pMD18-T-F1I2(图3B),经限制性内切酶EcoR Ⅰ 和HindⅢ消化后,出现的条带与651 bp的目的条带大小一致(图3B)。对酶切鉴定正确的重组质粒pMD18-T-F1I2进行测序,分析结果表明,序列不存在核苷酸的缺失和插入。将测序正确的F1I2基因片段连接至pET-28a质粒,转化至大肠杆菌感受态BL21(DE3),培养阳性转化子BL21(pET-28a-F1I2)后,小批量制备质粒,用内切酶EcoRⅠ和HindⅢ消化,电泳后所得条带与651 bp的目的条带大小一致,表明成功构建了重组表达菌株BL21(pET-28a-F1I2)(图3C)。
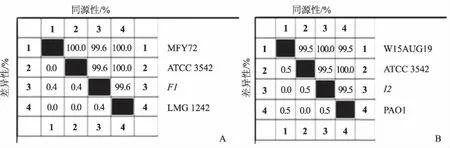
图2 F1基因序列(A)和I2基因序列(B)同源性分析
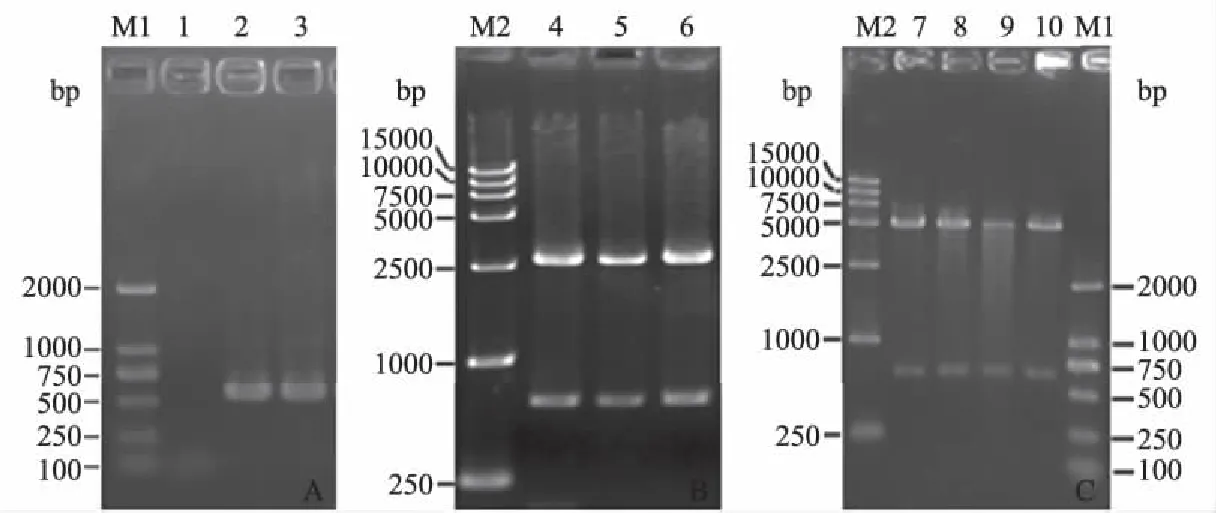
A:融合基因F1I2的PCR扩增; B:重组质粒pMD18-T-F1I2的双酶切鉴定; C:重组表达质粒pET-28a-F1I2的双酶切鉴定。M1:DL2000 DNA Marker; M2:DL15000 DNA Marker; 1:阴性对照; 2、3:F1I2 PCR扩增结果;4—6:pMD18-T-F1I2酶切结果; 7—10:pET-28a-F1I2酶切结果图3 重组原核表达菌株BL21(pET-28a-F1I2)的构建及验证
2.3 融合蛋白F1I2的表达及纯化
分别用IPTG诱导重组表达菌株BL21(pET-28a-F1I2)和对照菌BL21(pET-28a),通过SDS-PAGE电泳,结果发现,与对照菌株BL21(pET-28a)相比,可在BL21(pET-28a-F1I2)中约30 ku处观察到蛋白质表达条带,与预测的F1I2融合蛋白大小相符(图4)。同时得到的融合蛋白F1I2可以被His镍柱纯化,表明其具有良好的可溶性。

M:蛋白质分子质量标准; 1:空载体对照;2、3:重组菌表达; 4:纯化的F1I2蛋白图4 BL21(pET-28a-F1I2)表达产物的SDS-PAGE电泳分析
2.4 融合蛋白F1I2的Western Blotting分析
重组菌和对照菌经SDS-PAGE电泳、转膜后,以ZHDL9阳性血清作为一抗,HRP标记的兔抗水貂IgG作为二抗,结果显示,可在约30 ku处观察到反应条带,表明原核表达的融合蛋白F1I2能与铜绿假单胞菌ZHDL9株感染的水貂血清发生特异性的免疫反应,而对照菌则不能发生反应(图5)。
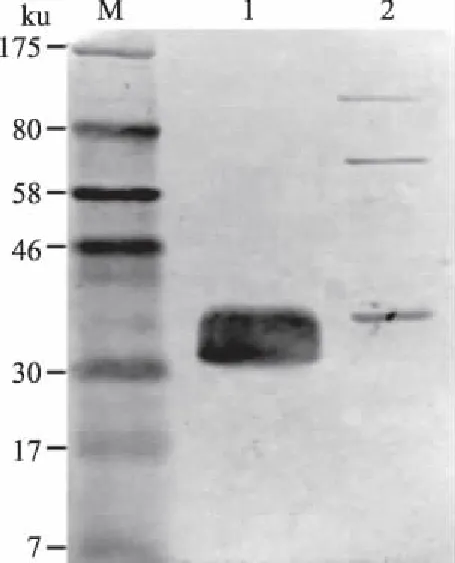
M:蛋白质分子质量标准; 1:重组菌; 2:对照菌图5 融合蛋白F1I2的Western Blotting分析
3 结论与讨论
铜绿假单胞菌是一种重要的人兽共患病原菌,广泛存在于天然环境中,常常引起医院病人的获得性感染,特别是患败血症、免疫受损或被抑制的病人,同时还能升高囊性纤维化病人的发病率和死亡率[7]。铜绿假单胞菌也能感染狗、猫、猪、水貂、狐狸、貉子等动物,疫苗被认为是防控感染性疾病最有力的武器[8-9]。近些年来,众多有效的铜绿假单胞菌抗原及新的抗原携带系统逐渐被筛选与开发出来,其中包括一些铜绿假单胞菌的结构部分,如鞭毛、菌毛、脂多糖、外膜蛋白和所分泌的毒素A等物质,它们均已被证明是有效疫苗的靶抗原[10]。
一般情况下,细菌能够通过感应胞外的信号来调节代谢以适应环境的变化,铜绿假单胞菌是通过外膜来感应胞外信号,这些外膜组分可能作为毒力因子的成分参与侵染过程[11]。外膜蛋白F在铜绿假单胞菌众多孔蛋白中占有很少的比例,但它能够允许离子及小分子的营养物质以非特异性的方式扩散[12]。通常情况下,外膜蛋白F被认为是一种结构蛋白,能将外膜锚定在肽聚糖层[13]。由于外膜蛋白F位于铜绿假单胞菌的外膜表面,由它介导的病原与宿主之间相互作用的现象被逐渐揭示,许多研究表明,外膜蛋白F确实参与诸多侵染进程,例如它能够介导病原菌与真核细胞的黏附[14],以及厌氧条件下生物膜的形成[15]。此外,外膜蛋白F与IFN-γ相互作用后能够促使细菌产生凝集素PA-1L和吩嗪绿脓毒素[16],这2种毒素的产生表明外膜蛋白F可作为宿主免疫系统的传感器[17]。与此同时,外膜蛋白F也可能通过激活QS系统促使了2种毒素的产生[18-19]。这些研究表明,外膜蛋白F通过修饰QS系统可增强细菌的毒力,进而介导了与宿主的相互作用,但有趣的是,接种外膜蛋白F和I融合蛋白的人血清能够抑制铜绿假单胞菌与IFN-γ的结合,这表明IFN-γ新的作用机制能够消除铜绿假单胞菌的毒力[20-21]。因此,外膜蛋白F能够作为铜绿假单胞菌疫苗的重要候选蛋白,来防御铜绿假单胞菌的感染。外膜蛋白I也被学者们广泛研究,据报道,OprI可以结合到呼吸道和肠道黏膜表面,有望作为黏膜免疫的载体,促进抗原传递到抗原提呈细胞[22]。与此同时,研究者利用重组外膜蛋白I免疫小鼠,小鼠获得了能够抵御铜绿假单胞菌攻击的能力[23]。近些年来,人们将2种蛋白质的重要抗原部位融合表达发现,其也具有较好的免疫效果。研究表明,在小鼠模型中,接种OprF-OprI疫苗可以预防小鼠全身性绿脓杆菌感染[24]。在人体Ⅰ/Ⅱ期临床试验中,为健康志愿者肌肉注射OprF-OprI疫苗,疫苗作用安全且能够诱导特异性抗体产生[25]。
本研究获得铜绿假单胞菌的重要外膜蛋白表位基因F1和I2,并将其融合在一起进行表达,为铜绿假单胞菌疫苗的设计及开发奠定了基础。融合得到的表位疫苗具有很多优势,能被具有多种遗传背景的主要组织相容性复合体(MHC)分子识别并结合,从而得到高效的递呈;它在细胞免疫方面也具有独特的优势,可有效应对病原微生物的变异和免疫反应中的诸多不利因素。因此,本研究利用pET-28a表达载体成功表达了可溶性较好的F1I2融合蛋白,它能与特异性血清发生较好的反应,为F1I2融合蛋白功能的进一步研究及新型高效生物制品的研发奠定了基础。
