百合鳞茎腐烂病病原菌的鉴定及生物学特性研究
2019-01-03,,,,*
,,,,*
(1.聊城大学 农学院,山东 聊城 252059; 2.中国农业大学 园艺学院/花卉发育与品质调控北京市重点实验室,北京 100193)
百合为百合科(Liliaceae)百合属(Lilium) 球根花卉,其花姿雅致、花色丰富、馨香宜人,在我国被广泛栽培用作切花、盆花和庭院用花等[1]。此外,百合还具有较高的药用与食用价值[2-3]。由镰刀菌引起的百合鳞茎腐烂病(又称根腐病、枯萎病)是百合的主要病害,病原菌主要从肉质根或鳞茎盘基部的伤口侵入,造成肉质根和盘基变褐腐烂,并逐渐向上发展,鳞片出现褐色凹陷病斑,后期鳞片从盘基脱落。染病植株地上部分明显矮化,叶片自下而上黄化干枯,最后全株枯萎死亡[4]。
近年来,北京市昌平区温室栽培的百合出现大面积的鳞茎腐烂病,严重影响了种球、切花的产量和质量,制约百合周年生产。为确定该地区百合鳞茎腐烂病的病原菌,采集了东方百合杂种系索邦的鳞茎腐烂病病株,对病原物进行分离和鉴定,并分析了主要致病菌的生物学特性,为深入研究该病的发病规律和防治技术奠定理论基础。
1 材料和方法
1.1 试验材料
采样地点为北京市昌平区李村百合生产合作社,寄主为东方百合杂种系(Liliumoriental hybrids)索邦(Sorbonne),采集病株具有典型鳞茎腐烂病症状。
1.2 试验方法
1.2.1 病原菌的分离与纯化 采用组织分离法,用清水冲洗具有典型鳞茎腐烂病症状的鳞茎片,于超净工作台内切取病健组织交界处,剪成2 mm ×3 mm大小,用75%乙醇浸泡30 s,无菌水漂洗 3次,再于7.5%的次氯酸钠中浸泡3 min,无菌水冲洗3次,置于马铃薯葡萄糖琼脂培养基(PDA)上25 ℃恒温培养3~5 d,观察分离结果,纯化后保存菌种待鉴定。
1.2.2 病原菌致病性测定 离体测定:将分离纯化的菌株在PDA上培养7 d后,用打孔器制成直径5 mm的菌饼备用。选取索邦健康鳞茎片,用75%乙醇进行表面消毒,无菌水冲洗。用灭菌解剖针在鳞茎片上刺孔,将菌饼贴在孔上,以贴PDA培养基为对照。保湿培养,每天观察发病情况。
活体测定:将索邦种球消毒后栽种在直径12 cm的花盆中,基质为经过高温灭菌的细河砂。拌入PDA上培养7 d的分离菌,1盆1皿,以拌入PDA培养基为对照。25 ℃培养,及时观察发病状况。
根据柯赫氏法则[5],对接种发病的百合鳞茎片再次进行病原菌的分离与鉴定。
1.2.3 病原菌鉴定 形态鉴定:将分离纯化的病原菌分别在PDA上25 ℃恒温培养,观察菌落特征。同时用水作为浮载剂,用BX51奥林帕斯显微镜观察菌丝和孢子形态,拍照。
分子生物学鉴定:使用Omega Bio-Tek公司的D3390-02 Fungal DNA Kit提取病原菌基因组DNA。采用真菌核糖体基因内转录间隔区(ITS)通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行rDNA-ITS序列扩增[6]。PCR反应程序:95 ℃ 5 min; 95 ℃ 30 s,54.5 ℃ 30 s,72 ℃ 1 min,33个循环;72 ℃ 10 min。PCR产物用1%的琼脂糖凝胶电泳检测,将500 bp左右的条带切胶回收,连接pMD18-T载体并转化至大肠杆菌DH5α感受态细胞中,经Amp抗性筛选和菌落PCR检测后,将含有目的基因片段的阳性克隆送上海铂尚生物技术有限公司测序。所得序列在NCBI网站用BLAST进行比对分析,利用MEGA 5.0构建系统发育树。
1.2.4 病原菌生物学特性分析 将直径7 mm的尖孢镰刀菌菌块接种于供试培养基平板(直径9 cm)中央,置于培养箱中培养,研究培养基种类、温度、光照、pH值、碳源、氮源对病原菌菌丝生长和产孢量的影响。
培养基的影响:供试培养基分别为PDA、改良沙氏葡萄糖蛋白胨琼脂培养基(mSDA)、查氏培养基(CZA)、基础培养基(BM)等4种固体培养基。
温度的影响:培养温度分别为5、10、15、20、25、30、35、40 ℃。
光照的影响:设置全光照、光暗交替(12 h光照/12 h黑暗)、全黑暗3个处理。
pH值的影响:pH值梯度设置为3、4、5、6、7、8、9、10、11、12。
2.自主研发模块化注入工艺。以实用、高效、绿色、环保为目标,开展三次采油注入工艺模块化、标准化研究。创建了采出水处理、分散溶解、在线熟化、喂入、辅剂加入、注入、配电、储存稀释8个模块单元,具有工厂化预制、橇装化安装、可重复利用的特点。施工现场只需要进行橇块间管道、配电快速连接,大幅度缩短了配注系统流程,提高了效率,降低了成本,提升了信息化管理水平。与常规固定式建站模式相比,设计时间缩短至1 个月,缩短了80%的时间;占地面积减少65%,地面配套设施减少25%,建设周期缩短一半,建设投资减少32%。通过驱油体系研发和注入工艺研发,为现场规模推广三次采油提高采收率奠定了基础。
碳源的影响:以查氏固体培养基为基础培养基,将葡萄糖分别用等量的蔗糖、麦芽糖、乳糖、果糖、海藻糖、阿拉伯糖、可溶性淀粉、微晶纤维素代替,制成不同碳源的培养基,以无碳源培养基为对照。
氮源的影响:以查氏固体培养基为基础培养基,将天门冬酰胺分别用等量的硫酸铵、氯化铵、蛋白胨、酵母浸膏、尿素、甘氨酸、硝酸钠代替,制成不同氮源的培养基,以无氮源培养基为对照。
试验中若无特殊说明,培养条件均为:PDA培养基、25 ℃、12 h光照/12 h黑暗。每个处理3皿,重复3次。培养5 d后采用十字交叉法测量菌落的直径,6 d后采用血球计数板法测量孢子量。
1.3 数据处理
利用Excel 2007和SPSS 18软件分析、处理数据。
2 结果与分析
2.1 百合鳞茎腐烂病病原菌的分离与鉴定
2.1.1 病原菌形态及分子生物学鉴定 从索邦鳞茎腐烂病斑上分离纯化得到15个菌株(编号为BH1—BH15),其培养性状和形态特征为:在PDA培养基上25 ℃恒温培养,菌落圆形,气生菌丝绒毛状或絮状,易产生色素,颜色多样;菌丝有隔,分生孢子梗无色,有少量分枝;小型分生孢子无色,形态多样,多为单细胞,少数为1~3分隔;大型分生孢子无色,镰刀形,3~10分隔。根据培养性状和菌丝、孢子形态,初步鉴定15个分离菌株均为镰刀菌(Fusarium)。
对15个分离株进行rDNA-ITS 测序,分离株BH15的序列长度为564 bp,与序列号为KR364579、MG183708、MH569611、KM268689等腐皮镰刀菌(Fusariumsolani)的同源性为99%。其余分离株的序列一致,长度均为544 bp,与序列号为MG836253、MH512964、MG020429、KX786247等尖孢镰刀菌(Fusariumoxysporum)的同源性为100%。根据BH1和BH15的ITS序列构建的系统发育树如图1。
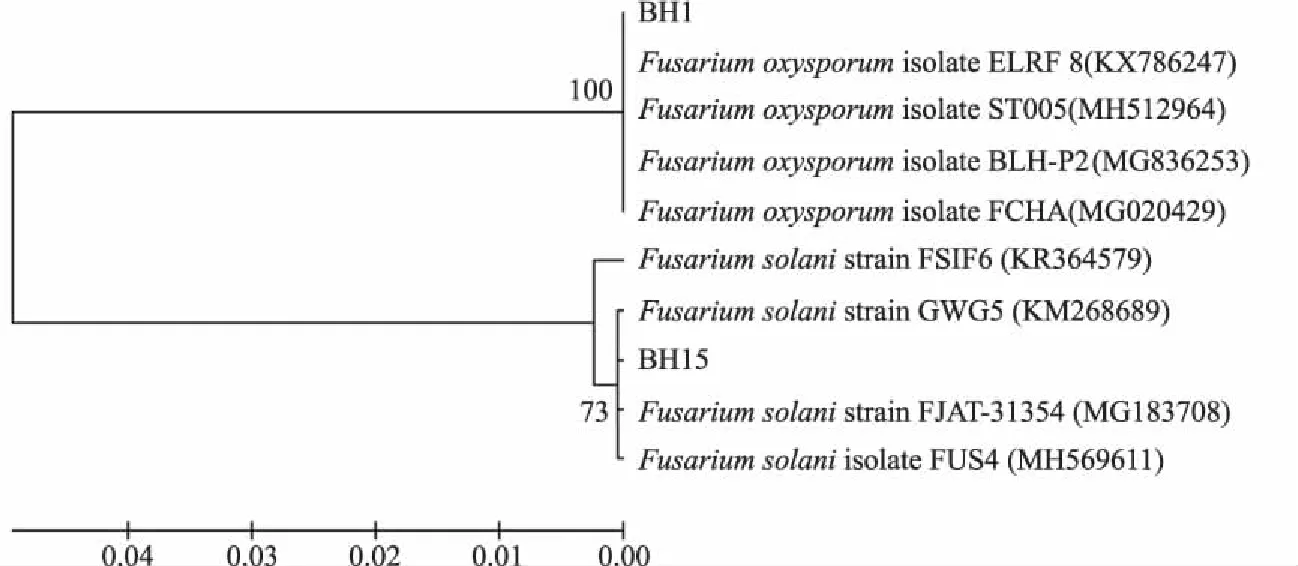
图1 菌株BH1和BH15基于ITS 序列同源性构建的系统发育树
菌株BH1(尖孢镰刀菌)在25 ℃的PDA培养基上,单菌落圆形,气生菌丝羊毛状,白色,菌落有浅紫色轮纹(图2A、B),培养4 d的菌落直径为5.0~5.1 cm。菌丝有隔,分生孢子梗无色,有少量分枝,分枝呈锐角状,菌丝内可见许多圆形内容物(图2C)。小型分生孢子无色,单细胞,椭圆形、卵圆形、柱形等,中央宽,两端渐窄;大型分生孢子无色,镰刀形,细长,0~5个隔膜,多数为3隔(图2D)。菌株BH15(腐皮镰刀菌)在25 ℃的PDA培养基上,单菌落圆形,气生菌丝棉絮状,白色、浅粉色,培养基背面中央紫红色(图2E、F)。与BH1相比,菌株BH15生长较慢,培养4 d菌落直径为4.3~4.4 cm;产孢细胞为简单瓶梗,瓶梗较短(图2G);分生孢子比较粗壮,小型分生孢子较大,大型分生孢子多,马特型,较胖,两端较钝(图2H)。
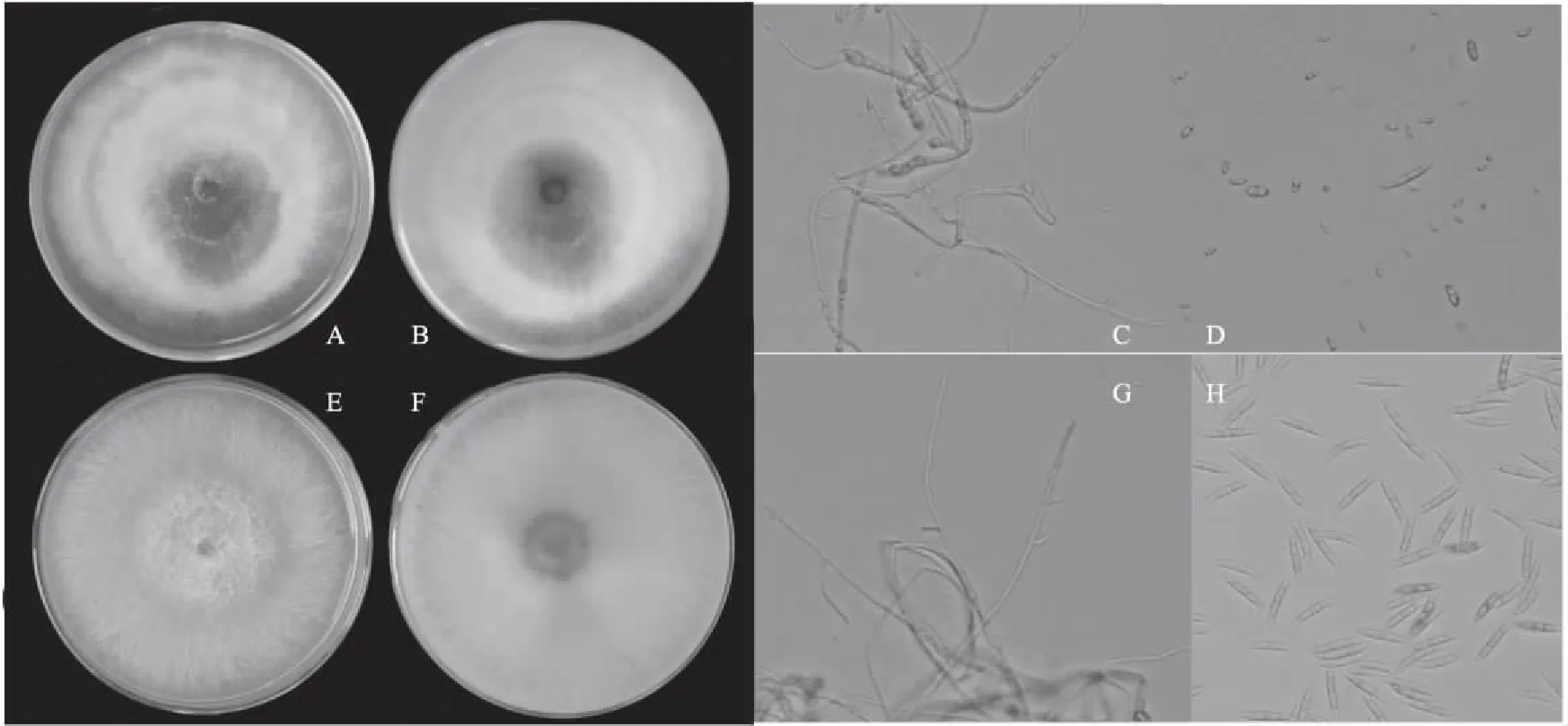
A、B:菌株BH1正面、背面; C、D:菌株BH1菌丝、分生孢子形态; E、F:菌株BH15正面、背面; G、H:菌株BH15菌丝、分生孢子形态图2 菌株BH1和BH15的培养性状与形态特征
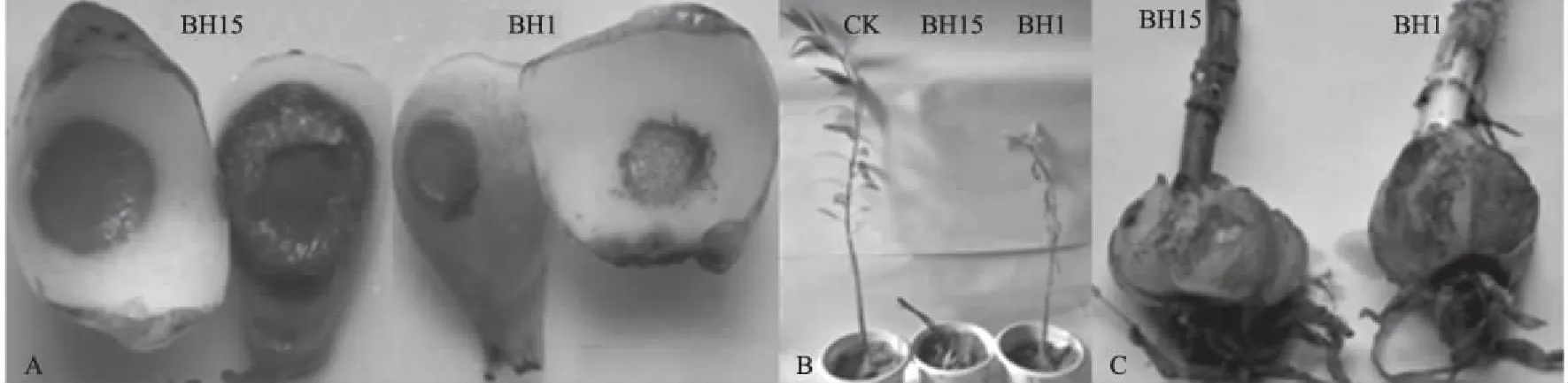
A:离体接种鳞茎片病症; B:活体接种地上部分病症; C:活体接种鳞茎病症图3 百合接种BH15和BH1后病症
离体接种时,BH15菌株接种4 d左右开始出现病症,鳞片腐烂程度强,BH1菌株8 d才出现病症,鳞片腐烂程度弱;活体接种时,BH15菌株接种15 d开始显症,植株地上部发病严重而死亡,BH1菌株接种20 d显症,地上部表现脱叶、矮小,但不死亡。因此,BH15菌株的致病性较强。
从发病组织上再次分离纯化病原菌,其在PDA培养基上的培养性状及菌丝、孢子特征均与接种前对应的菌株一致。根据柯赫氏法则,百合鳞茎腐烂病的病原菌为尖孢镰刀菌(Fusariumoxysporum)和腐皮镰刀菌(Fusariumsolani)。
2.2 百合鳞茎腐烂病病原菌尖孢镰刀菌的生物学特性
2.2.1 培养基对尖孢镰刀菌菌丝生长和产孢量的影响 不同培养基对尖孢镰刀菌的菌丝生长和产孢量有显著影响(表1)。培养至第5 天,该菌在BM培养基上的菌落直径最大,为63.27 mm,但菌丝稀疏,在PDA培养基上的菌落直径次之,为56.33 mm,菌落致密。PDA培养基上的孢子量最大,为10.00×107个/皿,其次为CZA培养基,BM和mSDA培养基的产孢量较低。综上,PDA培养基为尖孢镰刀菌的适宜培养基。

表1 不同培养基上尖孢镰刀菌菌落的生长情况和孢子量
注:同列不同小写字母代表差异显著(P<0.05),下同。
2.2.2 温度对尖孢镰刀菌菌丝生长和产孢量的影响 不同温度对菌丝生长量和产孢量的影响显著(表2)。温度过低(5 ℃)或过高(40 ℃)时,菌丝停止生长和产孢。该菌在10~35 ℃条件下均可生长,25 ℃时生长最快,其次为30 ℃。25 ℃条件下的产孢量最大,为9.88×107个/皿,其次为30 ℃时,二者无显著差异。因此,尖孢镰刀菌生长和产孢的适宜温度为25~30 ℃,最适温度为25 ℃。
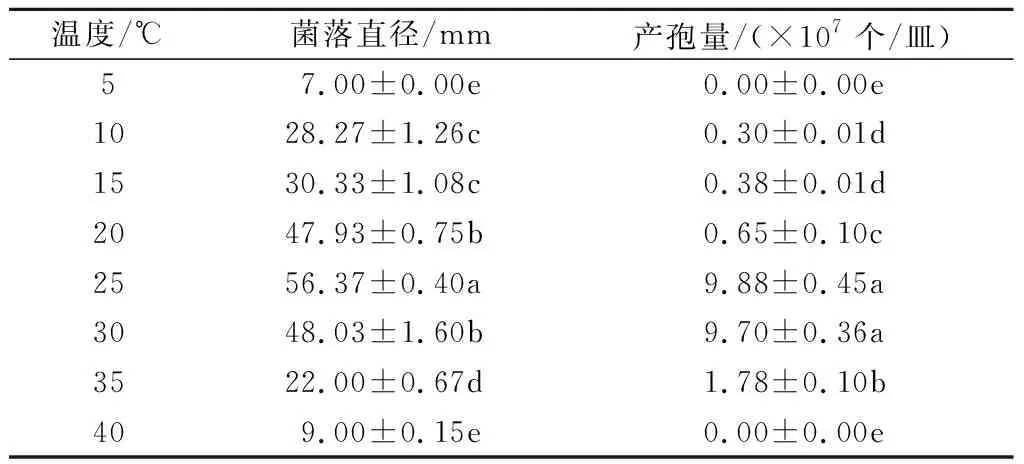
表2 不同温度下尖孢镰刀菌菌落的生长情况和孢子量
2.2.3 光照对尖孢镰刀菌菌丝生长和产孢量的影响 从表3可以看出,尖孢镰刀菌在全光照、光暗交替和全黑暗条件下均能较好生长。光暗交替条件下菌丝生长最快,与全黑暗处理相比,菌落直径差异不显著,但显著高于全光照处理。光暗交替条件下的产孢量最高,达9.75×107个/皿,显著高于全光照和全黑暗环境。

表3 不同光照下尖孢镰刀菌菌落的生长情况和孢子量
2.2.4 pH值对尖孢镰刀菌菌丝生长和产孢量的影响 从表4可以看出,尖孢镰刀菌在pH值4~12内均可生长,在pH值为5及碱性的环境条件下生长较快,但在高pH值(10~12)下菌丝疏松。培养基的酸碱度影响色素的形成,pH值5~8时,该菌易产生红色色素。pH值为3时不产孢,在pH值4~12内,产孢量先增加后降低,当pH值为7时,产孢量最大,达7.70×107个/皿。
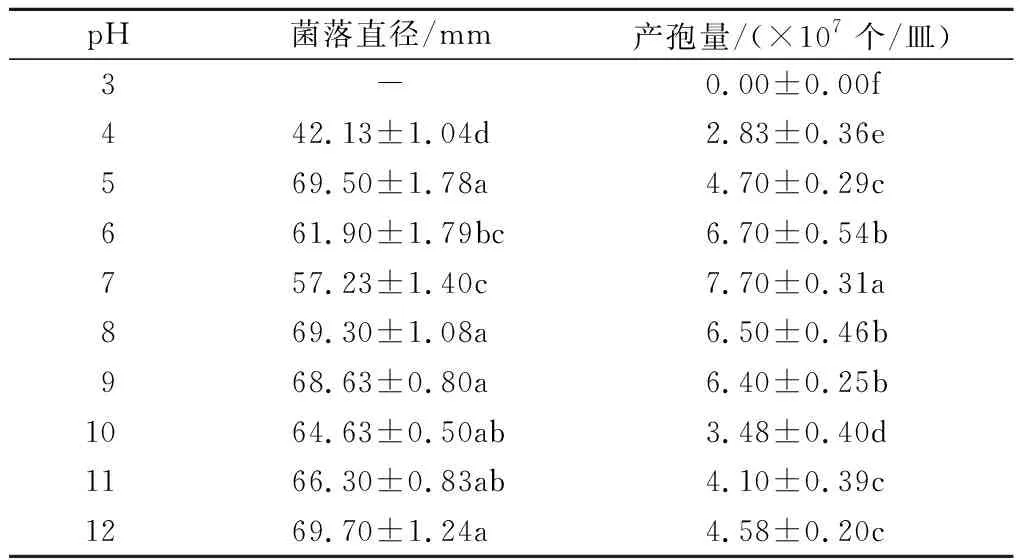
表4 不同pH值下尖孢镰刀菌菌落的生长情况和孢子量
2.2.5 碳源对尖孢镰刀菌菌丝生长和产孢量的影响 尖孢镰刀菌在有糖和无糖培养基上均能生长(表5)。最适宜菌丝生长的碳源为乳糖,5 d时菌落直径可达60.33 mm,其次为麦芽糖、葡萄糖,与对照(无碳)相比,海藻糖和可溶性淀粉抑制了菌丝的生长。该菌在以葡萄糖和海藻糖为碳源的培养基上产孢量较多,分别是对照的5.50倍和5.33倍。
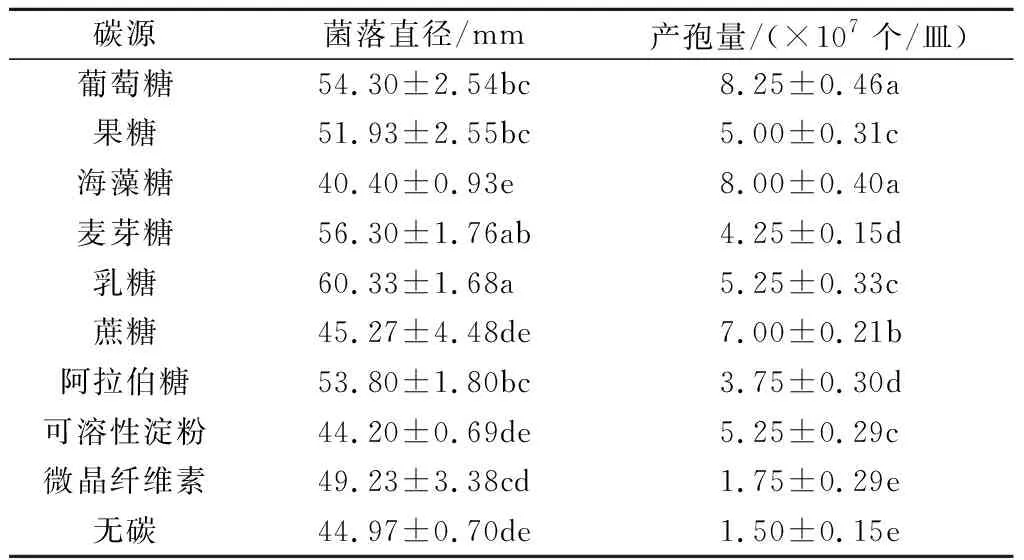
表5 不同碳源下尖孢镰刀菌菌落的生长情况和孢子量
2.2.6 氮源对尖孢镰刀菌菌丝生长和产孢量的影响 虽然尖孢镰刀菌在无氮培养基上也可生长,但菌丝非常稀疏、不产孢,说明尖孢镰刀菌对氮素的要求较高(表6)。菌丝生长氮源以硝酸钠和酵母浸膏最好,硫酸铵和氯化铵最差,表明该菌对硝态氮和有机氮的利用效果较好,对铵态氮的利用效果较差。氮源也影响其色素的产生,蛋白胨和酵母浸膏有利于产生红色色素。以甘氨酸为氮源时,病原菌的产孢量最高,达3.93×107个/皿,显著高于其他处理,其次是酵母浸膏、蛋白胨和尿素,而在无氮与铵态氮条件下均不产生分生孢子,表明有机氮有利于尖孢镰刀菌产孢。
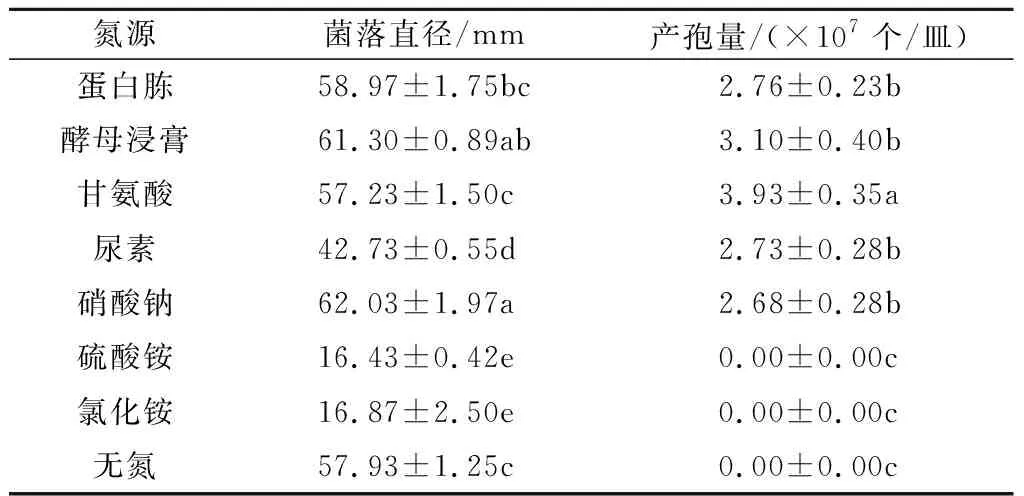
表6 不同氮源下尖孢镰刀菌菌落的生长情况和孢子量
3 结论与讨论
在生长期或贮藏期,百合较易发生鳞茎腐烂病。引起贮藏期鳞茎腐烂的病原真菌主要有圆孤青霉(Penicilliumcyclopium)、匍枝根霉(Rhizopusstolonifer)、黑曲霉(Aspergillusniger)、丛花青霉(Penicilliumcorymbiferum)和尖孢镰刀菌等[7]。生长期鳞茎腐烂病的病原菌主要有尖孢镰刀菌、腐皮镰刀菌、串珠镰刀菌(FusariummoniliformeSheldon)和层出镰刀菌(Fusariumproliferatum)等[8]。研究表明,不同地区百合生长期鳞茎腐烂病的病原菌不完全相同。甘肃省临洮县兰州百合枯萎病病原菌经分离,被鉴定为尖孢镰刀菌、茄病镰刀菌(Fusariumsolani)和禾谷镰刀菌(Fusariumgraminearum)[9]。湖南省隆回县龙牙百合生长期鳞茎腐烂病和云南省嵩明县观赏百合根腐病的病原菌均为尖孢镰刀菌[10,4]。引起甘肃省会川县观赏百合根腐病的主要致病菌为尖孢镰刀菌和茄病镰刀菌[11]。虽然不同地区的病原菌不完全相同,但主要致病菌均为尖孢镰刀菌,仅严重侵染百合的为百合专化型(F.oxysporumf.sp.lilii),对百合和唐菖蒲都致病的为唐菖蒲专化型(F.oxysporumf.sp.gladioli)[12-13]。本研究鉴定北京昌平地区东方百合杂种系索邦鳞茎腐烂病病原菌为尖孢镰刀菌和腐皮镰刀菌。从分离数量上,尖孢镰刀菌占优势,占总分离株的93.3%;从致病性上,腐皮镰刀菌在显症时间和致病程度上都强于尖孢镰刀菌。尖孢镰刀菌也能引起该地区食用百合鳞茎腐烂[14],但与该研究结果相比,本研究还鉴定了腐皮镰刀菌为致病菌。
百合鳞茎腐烂病是土传病害,病原菌主要以菌丝体在鳞茎内或以菌丝体、厚垣孢子及菌核随病残体在土壤中越夏越冬,成为次年百合发病的初侵染源。高温高湿、排水不良、氮肥施用过多、通风不畅、土壤偏酸、连作等均有利于该病发生[15]。本研究的病样采集自昌平郊区的温室观赏百合生产基地,由于多年连作,病害逐年加重。为利于病害的流行预测和防治,进一步研究了主要致病菌尖孢镰刀菌的生物学特性。该菌生长和产孢的最适培养基为PDA培养基;生长和产孢的适宜温度为25~30 ℃,最适温度为25 ℃;菌丝生长的最适pH值为5,产孢的最适pH值为7;菌丝在12∶12光暗交替条件下生长最快,产孢量最高;对多种不同碳源均能利用,菌丝生长的最适碳源为乳糖,产孢的最适碳源为葡萄糖;对有机氮和硝态氮利用较好,菌丝生长的最适氮源是硝酸钠和酵母浸膏,产孢的最适氮源是甘氨酸。本研究仅选择了4种培养基,有一定的局限性,应进一步筛选其他培养基,如增加百合培养基、百合葡萄糖培养基等专用培养基[7]。本研究中,适宜病原菌菌丝生长的温度和pH值范围与红景天根腐病菌基本相同[16]。光暗交替有利于尖孢镰刀菌菌丝生长,这与王中武等[17]对尖孢镰刀菌的研究结果一致,但尖孢镰刀菌亚麻专化型在持续黑暗环境下生长最好[18]。地域或寄主不同,尖孢镰刀菌对碳源、氮源的利用情况有差异。尖孢镰刀菌亚麻专化型生长与产孢的最适氮源为氯化铵[18],而本试验的结果表明,铵态氮显著抑制了尖孢镰刀菌的菌丝生长与产孢。硝态氮有利于兰州百合枯萎病病原菌尖孢镰刀菌的生长和产孢,与本试验的结果相近,但其生长和产孢的最适碳源为蔗糖[19],与本试验的结果不同。在生产实际中,可通过改变栽培环境、合理施肥、合理轮作等方式来抑制病原菌的生长与产孢,从而减轻百合鳞茎腐烂病的发生。
