实时荧光定量PCR HBV-DNA检测系统性能验证方法的探讨
2019-01-02李艳梅江忠勇李志强
李艳梅,江忠勇,李志强
目前在我国临床分子诊断学中,诊断项目主要为感染性疾病病原体核酸的扩增检测,如乙型肝炎病毒(HBV)、丙型肝炎病毒(HCV)、人类免疫缺陷病毒(HIV)等,采用的方法基本上都是实时荧光定量PCR。虽然PCR技术在我国各个临床实验室的运用极其广泛和成熟,但仍然不同于临床生化、血液等其他学科在标准化管理上有一套普遍认可的完整的管理体系,这就使得各个实验室的操作管理系统存在很大的差异,实验结果也可能相差甚远[1]。ISO15189和美国病理学家学会(CAP)认可要求中规定,在开展某一检测项目前,需进行方法学性能验证[2-3]。为了保证PCR实验室结果的准确性,规范实验室操作流程,本研究以血清HBV-DNA检测为例,对PCR定量检测系统的性能验证方法进行分析,拟为建立有关性能验证的SOP提供依据。
1 材料与方法
1.1 标本 2017年1~12月临床需要行HBV检测患者的送检全血标本,在采集后2 h内分离血清,并于当天检测或于-20℃保存备用。
1.2 仪器与试剂 Bio-Rad CFX96实时荧光定量PCR扩增仪,低速瞬离器、经校准合格的各类加枪;HBV定量检测试剂(湖南圣湘生物科技有限公司,批号2017020)及其配套的定值血清和质控品。
1.3 实验方法
1.3.1 精密度 依据CLSI EP15-2,选择HBVDNA浓度在厂家声明检测范围内的临床送检标本,每天1个分析批次、2个水平浓度,每一水平浓度重复测定3次,连续检测5 d,每个水平浓度累计得到15个结果。分别计算两个水平浓度的重复性精密度(CV批内)和中间精密度(CV批间)。 判读标准:根据国家标准GB/T214中的规定,方法精密度的重复性限为CV<5%;以能力验证/室间质评评价界限(靶值的对数值±0.4)作为允许总误差TEa,CV批内<3/5TEa且CV批间<4/5TEa为符合要求。
1.3.2 准确度 选择代表方法可报告范围中的高、低决定性浓度的厂家定值血清标本,每天各重复2次测定,检测5 d,每个浓度测定累计得到10个检测结果。判读标准:|log检测值-log定值|≤0.4(能力验证/室间质评)且 CV<5%(国家标准GB/T214中关于方法精密度的重复性限的规定)为合格。
1.3.3 线性范围 依据CLSI EP6文件,以HBVDNA浓度为4.6×106IU/ml的定值血清为母液,用HBV-DNA检测阴性且外观正常的血清进行10倍浓度梯度稀释,直至低于厂家声明线性下限的一个浓度梯度(4.6×10、4.6×102、4.6×103、4.6×104、4.6×105、4.6×106IU/ml),每个浓度检测3次取均值。以理论值与实测值作线性回归分析,得出相关系数和线性范围,R2≥0.98为符合要求(厂家声明)。
1.3.4 检测下限 以厂家提供的HBV-DNA阳性定值血清为母液,用正常混合血清稀释至厂家声明的检测下限后,重复检测10次,以检测出≥9次为符合要求。
1.3.5 检测下限灰区标本的非特异性扩增 在对HBV-DNA高值母液血清标本稀释为10~100 IU/ml的标本中,选取两份分别完成15次检测。分析每次反应曲线的起跳情况,计算起跳率(需≥95%)。准确性判断标准:|log靶值-log检测值|<0.8,即判读标准完成结果的正确性>50%。
1.4 检验程序质量保证
1.4.1 人员 由取得PCR上岗证的操作人员进行操作。
1.4.2 质控和溯源性 试验过程均跟阴阳对照、校准品及标准定值血清,根据Westgard多规则质控方法,判断当次质控结果是否在控,如失控则重新检测。所用的标准定值血清为二级标准,溯源于国家一级标准品。本实验室参加2017年原国家卫计委临床检验中心室间质评,结果通过。
1.5 统计学方法 所有检测浓度先行以10为底的log转换后,应用SPSS17.0统计软件对数据进行统计学分析。一致性检验采用配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 精密度 HBV-DNA定量检测低、高值的CV批内分别为 1.47%和 0.79%,CV批间分别为 2.09%和0.995%,精密度验证通过(表1)。
2.2 准确度 HBV-DNA定量低、高值的定值血清标本检测结果中,CV值分别为3.59%和1.58%,准确度验证通过(表2)。
2.3 线性范围 本试验6个浓度梯度的线性回归分析R2=0.9623(P<0.98),去掉最低浓度梯度后,回归方程为:y=1.005x-0.2633,R2=0.9991 (P>0.98),证实检测系统在(4.6×102~4.6×106)IU/ml范围内呈线性关系(图 1),在厂家声明的线性范围(1×102~5×109IU/ml)内。
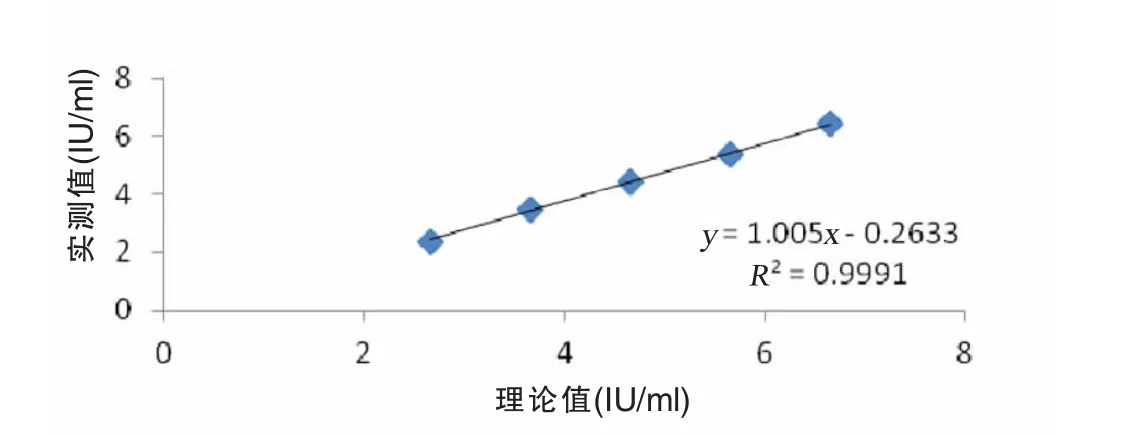
图1 线性范围验证回归曲线
2.4 检测下限 厂家声明的HBV-DNA检测下限为100 IU/ml,在此浓度10例标本全部检出,大于最低要求的9例,检测下限验证符合厂家声明。
2.5 检测下限灰区标本的非特异性扩增 在两份灰区标本共计30次检测结果中,所有反应均起跳,起跳率100%(>95%),正确性符合率分别为53.33%和66.67%(>50%),未在两份稀释血清标本中检测到非特异性扩增。

表1 HBV-DNA检测精密度评价结果

表2 HBV-DNA检测准确度评价结果
3 讨论
本研究参照文献方法及相关管理体系文件的建议[4-8],设计了本实验。对定量的分子检测技术而言,目前尚没有统一的国际参考标准来确定什么样的精密度是可被临床诊断实验室所普遍接受的,一般试剂盒厂家所声明的范围,是本实验室工作参照的最低标准。在此基础之上,可以参照国内外相关的其他权威标准,以此运用于自己的实验室。
根据《临床检验方法确认与性能验证》中“如何验证厂家的声明”的相关方案[10],本实验参照能力验证/室间质评评价标准来评价正确度。在方法“1.3.2”中,本研究在正确度的试验结果上,加入精密度的判断标准以完成对准确度的判读。可见,准确度包括正确度和精密度。
分子检测技术的分析测量范围是一个鉴别实时定量PCR效率的重要指标,目前还没有一个标准化的方法来鉴别。最常用的方法是成倍或对数梯度稀释参考物或已知阳性的靶核酸标本,核酸的梯度最少应有5个以上的测定梯度点来确定。由于高浓度临床标本较难获得,本试验选用厂家提供的高浓度定值血清为母液,进行多梯度点的稀释。通过各个梯度点实测值与理论值的线性回归分析,以证明该PCR检测技术符合验证实验所达到的设计要求。对HB-DNA定量检测而言,是否检出核酸是判断HBV是否处于复制状态的一项指标,所以,定量检出下限的验证也是性能验证中不可缺少的一项。本实验增加了对检测下限灰区标本的扩增情况分析,结果表明,本系统所用试剂盒在灰区浓度的检测具有较好的灵敏性和稳定性。
关于分子检测系统的性能验证内容,其他参考文献还提到分析灵敏度、特异性(交叉反应性和抗干扰能力)、分子检测方法临床验证、核酸提取效率(完整性、产率与纯度)等[11]。本实验的核酸扩增效率均在90%~110%之间,但由于设备、试剂成本等多因素的限制,未能进行上述所有项目的验证,而所完成的项目是在诸多PCR荧光定量性能验证相关文献报道的基础上设计的。结果证明,本实验设计方案可以运用于临床检验工作中,能满足预期临床检测要求,也可为本实验室建立有关性能验证SOP提供依据。
综上所述,本实验室HBV-DNA检测系统性能符合要求,设计的性能验证方法可行性好,可为建立有关系统性能验证的标准化操作规程(SOP)提供参考依据。
