钇掺杂亚稳相γ-Bi2O3的合成及光催化性能
2019-01-02李洪全郑树凯丁帮福闫小兵
李洪全,郑树凯,丁帮福,闫小兵
(河北大学电子信息工程学院,河北保定 071002)
随着人口增长和工业发展,环境污染问题日益严峻,有效解决污染问题迫在眉睫[1]。近年来,半导体光催化降解技术在环境污染方面展现出广泛应用潜力,半导体光催化材料合成与性能研究成为目前研究热点之一。
在众多光催化材料中,氧化铋(Bi2O3)作为一种p型半导体材料,具有化学性质稳定、无毒以及独特光学性能,其在电子陶瓷、光电器件、高温超导和催化剂等方面显示出广阔应用前景[2]。Bi2O3具有多种晶体结构,根据不同空间群结构分为单斜α-Bi2O3、四方β-Bi2O3、体心立方 γ-Bi2O3以及面心立方 δ-Bi2O3[3]。它们带隙的大小分别为 2.80、2.48、2.75、3.01 eV,所以亚稳β相能够吸收波长最广的太阳光,而δ相只对紫外光响应,从光催化剂对太阳光吸收角度看,β相具有最好的催化效率[4-5]。Zhang等[6]利用沉淀法制备纯的和铟掺杂β-Bi2O3粉末,在降解甲基橙溶液时,铟掺杂样品具有更好的催化性能,主要原因来源于铟掺杂提升价带和导带边位置。此外,α和γ相Bi2O3也被用来作为催化剂降解工业燃料,水热法合成不同浓度钐掺杂的α相Bi2O3,质量分数为1%的钐掺杂Bi2O3在光催化降解亚甲基蓝和苯酚时具有最好的催化活性[7]。化学沉淀法合成非金属硫掺杂γ-Bi2O3,光催化效果随着掺杂浓度的增加呈现先增强后减弱,硫掺杂引入新的能级杂化导致带隙变小而增强催化性能[8]。综上,不同晶型Bi2O3在光催化降解污染物领域具有潜在研究价值。
一般来说,合成Bi2O3方法主要有化学沉淀法、溶胶-凝胶法、微乳法、水热合成法、雾化-燃烧法、固相法以及等离子体法等[9]。在众多制备方法中,沉淀法工艺简单,易于控制和操作,有利于实现规模化工业生产,是目前最常用制备超细Bi2O3粉体的方法之一。由于β-Bi2O3和γ-Bi2O3是亚稳相,一般很难得到纯相,为了获得纯相,沉淀法过程中加入合适的沉淀剂来调节溶液pH值,例如加入200 mL 0.21 mol/L的氢氧化钠和 0.4 g草酸溶液才获得纯 γ-Bi2O3和 β-Bi2O3[10]。Tsenge等[11]用聚乙二醇-8000作为封端剂合成三维立方γ-Bi2O3,并对晶体结构、光致发光和导电性能进行研究。Sun等[12]采用水热反应时间22 h制备γ-Bi2O3,并研究其对罗丹明B的光催化降解性能。由于制备γ-Bi2O3过程中,总是伴随α相共存现象。Liu等[13]利用化学沉淀法详细研究α-Bi2O3和γ-Bi2O3的相变过程及生长机理。未加表面活性剂时,在反应温度75、85℃时,随着反应时间延长,纯α相逐渐过渡到共存相,再到纯γ相,再经过共存最后回到纯α相。而加入不同表面活性剂能够抑制γ相向α相的转变[14]。形貌表征结果表明,α相为棒状而γ相为四面体形状,相应生长机理为棒状碎裂而逐渐堆叠成四面体。从上看出,制备γ-Bi2O3的反应温度影响没有得到详细研究。计算发现γ-Bi2O3的价带和导带主要是O2p态和Bi3d态组成,为了提高光催化效率,除了调节价带,掺杂铋位调控导带也具有可行性。
本文中采用化学沉淀法,通过85、100℃以及高于100℃加热搅拌为主要手段,制备纯相γ-Bi2O3和钇(Y)掺杂γ-Bi2O3,研究温度对化学反应时间的影响。该方法搅拌后不需要高温煅烧,使大规模制备操作更加简单。为了检查样品晶相、微观形貌、带隙大小,对样品进行X射线衍射(XRD)、扫描电子显微镜(SEM)以及紫外可见漫反射光谱表征测试;并采用包含35%的非局域杂化密度泛函理论计算γ-Bi2O3的能带和态密度特征;利用制备样品对罗丹明B(RhB)进行光催化降解,期望带隙和形貌变化使得钇掺杂样品比纯相具有更好的光催化性能。
1 实验
1.1 实验过程
沉淀法合成样品所需药品如表1所示,所有试剂均为分析纯,在使用前未经过进一步处理。

表1 沉淀法合成样品所需药品Tab.1 Drugs required for sample synthesis by precipitation method
实验过程中所使用的去离子水采用蒸馏装置自制。按照化学计量比用分析天平分别称取一定量的Bi(NO3)3·5H2O和Y(NO3)3·6H2O粉末,首先将Bi(NO3)3·5H2O溶于20 mL浓度为1 mol·L-1的稀硝酸中,磁力搅拌 20 min,再向其中加入 Y(NO3)3·6H2O,作为掺杂样品的Y源,最后加入200 mL浓度为2 mol·L-1NaOH溶液,在某一温度下连续搅拌,过滤,用乙醇和去离子水冲洗3次,在60℃烘箱中干燥6 h。总的化学方程式为

根据式(1),掺杂时各材料占比如表2所示。
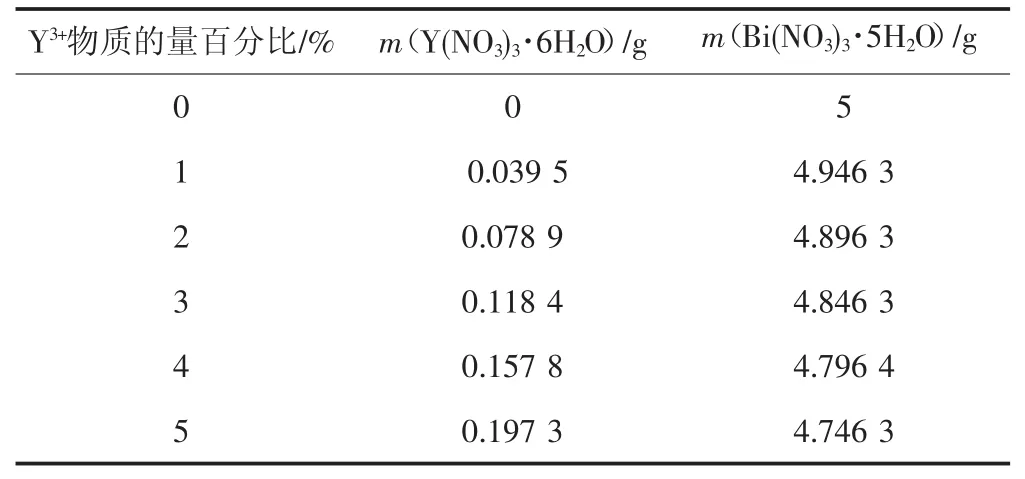
表2 掺杂时各材料占比Tab.2 Ratio of materials in doping
1.2 样品表征
采用TD-3500 X射线衍射仪(丹东通达科技有限公司)对样品进行晶相表征,辐射源为Cu靶,测试管电压为35 kV,管电流为25 mA,步进角度为0.05°,采样时间为0.6 s,扫描速度为5(°)/min,扫描角度范围10~80°;用FESEM Hitachi S-4800扫描电子显微镜(FESEM)分析样品形貌;采用TU-1901型双光束紫外可见分光光度计(北京普析通用仪器有限责任公司)进行紫外-可见漫反射光谱测试,并用白色BaSO4为参比样品。在无光照条件下将50 mg样品加人50 mL罗丹明 B(质量浓度为 10 mg·L-1)溶液中,搅拌60 min使其达到吸附-脱附平衡;然后采用250 W汞灯光源进行光催化降解实验,每隔30 min取样3 mL离心测定上层清液脱色率;采用TU-1901型紫外-可见分光光度计测定溶液吸收光谱,获得相对浓度,依据罗丹明B脱色率的变化评价样品光催化活性[15]。
1.3 计算过程
理论计算依据投影缀加波赝势密度泛函理论。首先利用广义梯度近似优化单胞结构,然后利用包含35%非局域杂化泛函理论进行自洽和能带结构计算[16]。氧和铋价电子构型为2s22p4和5d106s26p3,其他电子作为芯电子不参与计算。截断能采用500 eV,计算单元包含60个原子。当总能迭代小于10-4eV以及每个原子的残余力小于0.03 eV/A。时,结构弛豫完成。优化完的晶格常数从10.08A。增大到10.398A。,增长量小于3%,说明优化的结构是合理的。优化后的γ-Bi2O3晶体结构以及铋原子局域配位结构示意图如图1所示,铋有一种位置;而氧有2种位置,分别用O1和O2表示。每个铋原子周围有O1和O2各2个,形成四面体配位。根据空间群分析,Bi和O1位具有C1对称性,而O2位具有C2对称性。
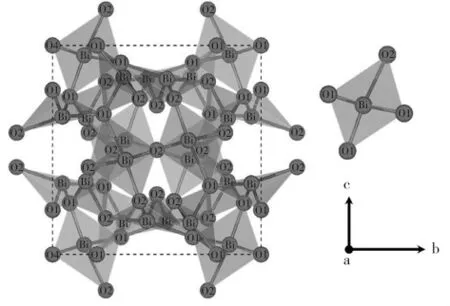
图1 优化后的γ-Bi2O3晶体结构以及铋原子局域配位结构示意图Fig.1 Schemmatic diagram of optimized γ-Bi2O3crystal structure and local coordination structure of bismuth
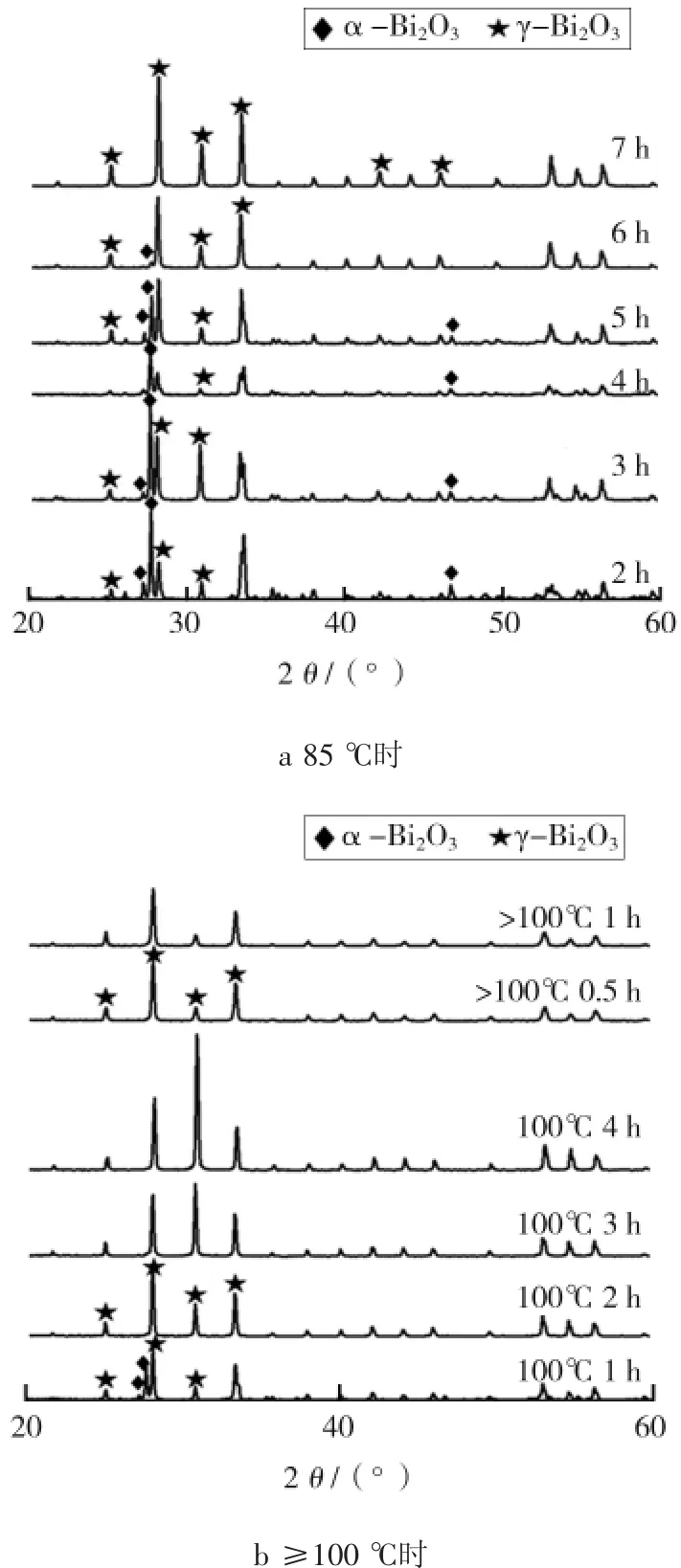
图2 85、≥100℃温度下不同反应时间时制备的γ-Bi2O3样品的XRD谱图Fig.2 XRD patterns of γ-Bi2O3samples prepared in temperature 85℃and≥100℃for different reaction times
2 结果与讨论
2.1 结构与形貌
γ-Bi2O3具有合适的带隙值,因此具有较好的光催化效果,分别在85、≥100℃温度下不同反应时间时制备γ-Bi2O3,对样品XRD测试结果如图2所示。由图2a可知,85℃下搅拌2~6 h时样品是α-Bi2O3与γ-Bi2O3共存,且随着时间增加α相减少而γ相占比增多。7 h样品的衍射峰与γ-Bi2O3的标准卡片(PDF#74-1375)相对应,说明在85℃搅拌7 h完全转变为纯立方相γ-Bi2O3。由图2b可知,在100℃搅拌1 h时样品是α-Bi2O3与γ-Bi2O3共存,2 h完全转变为纯相γ-Bi2O3。在高于100℃下搅拌0.5 h时样品完全转变为γ-Bi2O3。由此可得,搅拌时温度越高,完全转变为γ-Bi2O3的反应时间越短。
在100℃下,不同掺杂浓度的Y掺杂γ-Bi2O3的XRD谱图如图3所示。所有样品的衍射模式与标准谱相匹配,说明Y掺杂后并没有新的相产生,进一步说明Y进入晶格格位。在四配位时,Y3+和Bi3+离子半径分别为90、103 pm,而O2-半径为140 pm,因此从价态和离子半径判断,Y占据Bi位而非O位。

图3 不同掺杂浓度的Y掺杂γ-Bi2O3的XRD谱图Fig.3 XRD patterns of γ-Bi2O3doped with different concentration Y doping
微观形貌、尺寸、分散性以及粒子之间的界面效应强烈地影响光催化性能,纯γ-Bi2O3和Y掺杂γ-Bi2O3的SEM图像如图4所示。由图4a、4b可知,纯γ-Bi2O3是一些分散的四面体形状构成,且四面体大小均一,都在8 μm左右,此外四面体之间存在堆积和交错生长。通过放大四面体,发现表面上附着有大小不一的小颗粒。当钇引入到晶格中,从图4c—4h可以看出,四面体形貌尺寸大小不再单一,而是出现大小不同的四面体。对于1%(质量分数)掺杂,还出现花状形貌。随着掺杂量增加,形貌尺寸差异更大,此外四面体聚集程度不断增强。由图4a、4c、4e、4g可知,四面体表面的碎裂小颗粒数目和尺寸随掺杂逐渐增多,因此掺杂导致的形貌变化会导致不同催化性能。

图4 纯γ-Bi2O3和Y掺杂γ-Bi2O3的SEM图像Fig.4 SEM images of γ-Bi2O3and Y doped γ-Bi2O3
2.2 光催化性能
利用同样实验方法制备α-Bi2O3粉末并测试催化性能,光催化降解RhB如图5所示。
相应的罗丹明B光催化降解效率-时间曲线如图5a所示,可知α-Bi2O3在180 min内降解31.47%;γ-Bi2O3在180 min内降解62.46%;而掺杂1%、3%、5%Y的γ-Bi2O3样品在180 min分别降解67.3%、69.86%、76.98%。这表明掺杂样品的催化性能要优于纯相γ-Bi2O3,且随着掺杂浓度提高,催化效率不断增强;γ-YxBi2-xO3的光催化性能比α-Bi2O3较高。
为了更直观地体现这一结果,图5b显示一级反应速率常数的柱状图。一级反应速率常数ka常被选作标定不同催化剂的光催化性能的基本动力学参数,其计算公式为


图5 光催化降解RhBFig.5 Photocatalytic degradation of RhB
式中:ka、C0、C、t分别为一级反应速率常数、反应物起始浓度、经t时间照射后反应物的浓度、照射时间[17]。由图5b可知,γ-YxBi2-xO3反应速率远远快于α-Bi2O3,随着Y杂质引入,反应速率逐步加快。
为了分析光催化性能提高的原因,对样品进行紫外可见漫反射光谱测试,漫反射光谱和函数关系图如图6所示。纯的和Y掺杂样品在450~550 nm可见光区域具有较强的吸收,这个吸收来源于价带到导带的电子跃迁,Y掺杂导致吸收边蓝移,增加太阳光的吸收波长。通过Kubelka-Munk函数拟合可以得到制备样品的带隙值[18],如图6b所示,横坐标波长通过1 240/λ转换为能量,纵坐标漫反射强度转换为[F(R)hν]1/2,如图 6b 所示。通过延长[F(R)hν]1/2与 hν曲线的线性部分与横轴的交点来确定样品带隙值。纯相与掺杂Y 5%的带隙值分别为2.66、2.62 eV。这表明Y掺杂减小γ-Bi2O3的带隙,带隙越小,可见光响应的区域越大,对可见光的利用率越大,光催化效率越高。

图6 漫反射光谱及[F(R)hν]1/2与能量的函数关系Fig.6 Diffuse reflectance spectra and[F(R)hν]1/2as a function of energy
进一步通过杂化密度泛函理论计算γ-Bi2O3的能带结构和态密度分布,结果如图7所示。由图7a可知,理论计算带隙值与实验值基本符合,主要来源于杂化密度理论修正密度理论中的非局域交换项。γ-Bi2O3为间接带隙半导体,光照时电子从价带顶跃迁到导带底或能量更高的空态,在价带和导带产生大量空穴和电子。由于间接带隙特性电子空穴很难复合发光,因此它们的分离有利于降解实验中氧化还原反应进行。从图7b看出,O 2p和Bi 3d组成价带和导带,电子激发跃迁是允许跃迁,提高电子空穴的分离速率。

图7 γ-Bi2O3的能带结构和态密度分布Fig.7 Band structure and state density distribution of γ-Bi2O3
3 结论
以NaOH为沉淀剂,采用沉淀法成功制备亚稳相γ-Bi2O3及Y掺杂γ-Bi2O3样品。通过光催化降解罗丹明B,发现γ-YxBi2-xO3样品比α-Bi2O3样品的光催化效率高,且随着掺杂浓度提高,催化活性也逐渐提高。光催化性能提高的原因有:
1)形貌。随着掺杂浓度提高,四面体颗粒不断聚集,周围碎裂的微小颗粒不断增大,增大了接触面积。
2)带隙变小。随着掺杂浓度的增加,带隙逐渐变窄,可见光响应的区域越大;对可见光的利用率越大,光催化效率越高。
