木糖浓度及补料发酵对树干毕赤酵母乙醇发酵的影响
2019-01-02吴仁智芦志龙陈小玲黄日波
吴仁智,陈 东,黄 俊,陆 琦,芦志龙,陈 英,陈小玲,黄日波*
(1.广西科学院国家非粮生物质能源工程技术研究中心 非粮生物质酶解国家重点实验室 广西生物质产业化工程院广西生物炼制重点实验室,广西 南宁 530007;2.广西大学 生命科学与技术学院 亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
木糖是自然界中第二丰富多聚糖—半纤维素的主要降解产物[1-2],若能利用其转化为燃料乙醇,意义重大。目前已知能利用木糖发酵生产乙醇的较为优良的酵母菌种有管囊酵母(Pachysolen tannophilus)[3-4]、树干毕赤酵母(Pichia stipits)[5]和休哈塔假丝酵母(Candida shehatae)[6-7]等。而以树干毕赤酵母利用木糖发酵产乙醇的能力最强[5,8]。为此,笔者曾以树干毕赤酵母CICC1960作为原始菌株,通过60Co诱变,选育出一株较为优良的突变菌株1K-9[9]。而为实现菌株高浓度酒精发酵,需进行高浓度糖(底物)发酵。实际上,在酵母酒精发酵过程中,底物浓度会对酵母发酵的结果产生很大的影响。若底物浓度过低,则会被酵母细胞迅速耗尽,底物供应的不足会造成酵母细胞过早地从指数生长期向平衡期转变,发酵提前结束,乙醇浓度不高;反之,高浓度底物带来高渗透压,产生底物抑制作用,从而影响酵母细胞生长,生物量不足,影响发酵的进行,造成乙醇产量也不高。
补料发酵(fedbatchfermentation)对于解决底物不足以及实现高浓度酒精发酵等均具有重要的意义。其一般先在一定浓度的底物下进行发酵,经过一定时期,消耗了一部分底物后,再补加一定浓度的底物继续进行发酵,最终获得高浓度的目标产物。1987年补料发酵就应用在支链淀粉(pullulan)生产上,能解决高浓度底物对细胞生长的问题从而提高支链淀粉的产量[10]。除此之外,补料发酵已成功应用在丙酮-丁醇-乙醇发酵[11]、纤维素酶[12]、谷氨酰胺转移酶[13]、木糖醇[14]、2,3-丁二醇[15]等的生产。不论是实验室规模[16],还是工业化生产[17],采用补料发酵对于酒精发酵来说,效果均较为理想。鉴于此,本实验首先第一轮发酵分别进行不同浓度木糖对菌株1K-9乙醇发酵的影响试验,确定出一个对此菌株生长、发酵较为理想的木糖浓度,然后第二轮进行补料发酵:采用含有上述较为理想浓度的木糖培养基进行酒精发酵,一段时间后进行补料发酵,考察酒精发酵的酒度等一系列参数,然后进行比较,从而确定补料发酵是否有效,即通过探究不同浓度木糖以及补料发酵对优良菌株1K-9发酵木糖产乙醇的影响,旨在提高木糖乙醇发酵水平。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与试剂
木糖(分析纯):生工生物工程(上海)股份有限公司;蛋白胨、酵母粉(均为生化试剂):英国OXOID公司;3,5-二硝基水杨酸(3,5-dinitrosalicylicacid,DNS)、四水合酒石酸钾钠、氢氧化钠、苯酚、偏重亚硫酸钠、乙腈(均为分析纯):国药集团化学试剂有限公司。
1.1.2 菌种
树干毕赤酵母(Pichia stipitis)1K-9菌株:本实验室保存,由购买自中国工业微生物菌种保藏中心的Pichia stipitis CICC 1960菌株经60Co诱变选育[9],其醪液酒精浓度比原始菌株的提高了10.05%。
1.1.3 培养基
酵母浸粉木糖(yeast peptone xylose,YPX)培养基:木糖2%,蛋白胨2%,酵母粉1%,121℃灭菌20 min,自然pH,固体培养基添加2%的琼脂。
发酵培养基:分别为5%、10%、15%、20%、25%、30%木糖培养基。
1.2 仪器与设备
6890N气相色谱仪:美国安捷伦仪器公司;ECLIPSE80i显微镜(荧光):日本尼康仪器有限公司;DU800分光光度计:美国贝克曼库尔特有限公司;320R台式超速离心机:德国赫提驰仪器有限公司;ZWY-240摇床:上海智城分析仪器制造有限公司。
1.3 方法
1.3.1 菌株活化
将甘油或斜面保存的菌株在实验前接种于YPX培养基,30℃、180 r/min培养过夜,转接2次,同条件下培养菌数至2×108个/mL,4 ℃条件下保存,2 d内使用。
1.3.2 不同浓度木糖对酵母乙醇发酵的影响
活化的菌株接种至不同木糖含量(5%、10%、15%、20%、25%、30%)的发酵培养基,初始菌数2×108个/mL,装液量100mL/250mL,30℃、130r/min进行乙醇发酵,定时取样检测乙醇含量、残留木糖含量、菌数等指标。
1.3.3 补料发酵
同1.3.2,但先采用10%木糖培养基进行木糖乙醇发酵:装液量50 mL/250 mL,30℃、130 r/min发酵36 h时补加等体积20%木糖培养基继续发酵,定时取样检测乙醇含量、残留木糖含量、菌数等指标。
1.3.4 测定方法
菌数测定:取发酵醪液,即时进行菌数测定:样品根据情况适当稀释,利用血球计数板计数[18]。
乙醇含量测定:用气相色谱法测定乙醇含量,乙腈作为内标,参照文献[16]的方法。
木糖含量测定:取培养基或发酵液12 000 r/min离心5 min,吸取100 μL上清或上清的稀释液后用3,5-二硝基水杨酸法测定,具体综合参照美国能源部的方法[19]和GHOSE T K等[20]方法进行(测定吸光值OD520nm)。
2 结果与分析
2.1 发酵培养基木糖含量对菌株生长、乙醇产量及木糖利用情况的影响
酵母菌株生长需要一定的培养条件,当糖浓度低时,酵母细胞会快速利用完糖,而当糖浓度过高,其面临的渗透压会增高,会抑制酵母细胞的生长。为此,分别采用了含有不同浓度木糖的培养基对菌株1K-9进行生长及产乙醇情况的比较,目的是为了考察不同浓度木糖对菌株1K-9生长及产乙醇的影响,结果见图1。
由图1a可知,当培养基木糖含量为5%~10%时,木糖含量的增加有利于酵母的生长,且能快速促进酵母的生长。木糖含量较低(5%)时,菌数增长比较缓慢,36 h、48 h、60 h菌数分别为(6.29±0.55)×108个/mL、(8.62±1.76)×108个/mL和(9.97±0.44)×108个/mL。随着木糖含量的增加,能快速促进酵母的生长,采用10%木糖培养基培养,36 h时菌数为(13.62±1.60)×108个/mL,且能长时间维持在高菌数状态(36~60 h),这对于酵母酒精发酵非常有利。但当木糖含量>10%时,会表现出一定的抑制作用。采用15%木糖培养基培养,36 h时菌数为(11.79±3.05)×108个/mL,比10%木糖培养基低。当培养基木糖含量>15%时,菌株增殖速度较低浓度时变缓,20%木糖培养基培养36 h时菌数仅为(7.57±0.62)×108个/mL,需要培养至84 h时菌数才达到最大值(13.88±0.13)×108个/mL。当木糖含量>20%时,菌株的生长明显受到抑制,且随着木糖含量的增高抑制更明显,木糖含量25%和30%培养36h时菌数分别只有(6.77±1.43)×108个/mL和(3.21±0.10)×108个/mL。因此,最有利于高产菌株1K-9生长的培养基木糖含量为10%。
由图1b可知,5%、10%和15%木糖培养基醪液的乙醇含量分别于发酵36h、48h、108h达到最大值(2.56±0.03)%vol、(4.71±0.05)%vol和(6.20±0.13)%vol。而10%木糖培养基相对于其他5种培养基,酵母最能迅速发酵生成乙醇。培养基木糖含量为20%时,培养108h醪液的乙醇含量为(4.24±0.04)%;培养基木糖含量为25%和30%时,发酵醪液的乙醇含量较低,最高值分别为(1.81±0.03)%和(0.79±0.07)%。
由图1c可知,5%木糖培养基发酵36 h时醪液中残留木糖为(15.72±0.23)g/L,72 h利用完木糖;10%木糖培养基发酵72 h时醪液中残留木糖为(4.03±0.03)g/L,84 h利用完木糖;15%木糖培养基发酵108 h时醪液中残留木糖为(4.73±0.62)g/L;而含高浓度糖的培养基,20%、25%、30%木糖培养基发酵132 h醪液中残留木糖仍很高,分别为(48.93±1.16)g/L、(158.66±1.21)g/L和(209.47±0.43)g/L,后两种有大量的糖残留。利用低浓度木糖发酵,菌株能快速代谢木糖,而高浓度糖发酵,菌株受到一定的抑制造成大量的木糖残留。酒精发酵一般要求达到一定的酒度(酒度太低,能耗高,一般采用高浓度乙醇发酵)且残留糖含量越低越好。
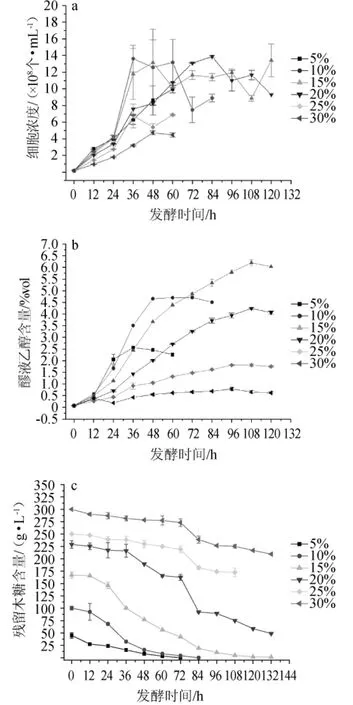
图1 发酵培养基中木糖含量对菌株1K-9生长(a)、乙醇产量(b)及木糖利用情况(c)的影响Fig.1 Effect of xylose concentration on growth(a),ethanol production(b)and xylose utilization(c)of strain 1K-9 in fermentation medium
综合分析可知,10%木糖浓度酵母能迅速生长且能维持高菌数的时间较长(36~60 h)、最能迅速发酵生成乙醇。因此,最有利于菌株1K-9发酵的培养基木糖含量为10%。
2.2 补料发酵
10%木糖培养基培养36 h时酵母能迅速生长至一较高的菌数值。为此,菌株1K-9先采用10%木糖进行乙醇发酵,即菌株经活化3次后,种子液以10%接种量、50 mL10%木糖培养基,发酵36 h补加等体积的20%木糖培养基继续发酵,整个发酵过程菌数变化、醪液乙醇产量和残糖含量见图2。
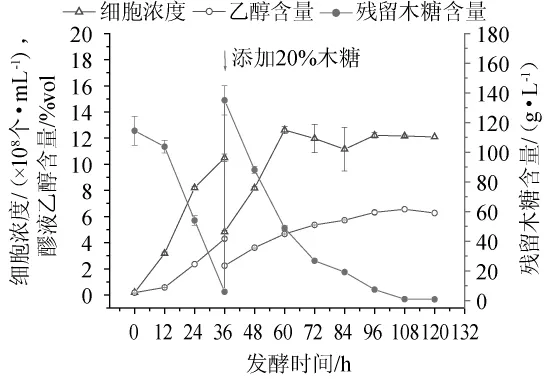
图2 补料发酵过程中菌株1K-9生长、乙醇产量及木糖利用情况Fig.2 Growth,ethanol production and xylose utilization of strain 1K-9 during fed-batch fermentation
由图2可知,补料发酵60 h时,菌数含量达到最高值(12.62±0.27)×108个/mL,其后续的发酵菌数仍能保持较高菌数,发酵至108h时菌数也达到了(12.16±0.07)×108个/mL,较未补料发酵时有所提高;发酵108 h时醪液中残留的木糖含量为(1.03±0.02)g/L较未补料发酵时有所降低;乙醇含量达到了6.56%vol,较未补料时提高了1.85%vol。因此,采用10%木糖培养基发酵36 h后立即添加20%木糖培养基进行补料继续发酵,是十分有效的。
3 讨论
补料发酵过程一般先采用低浓度底物进行发酵,一定时期补加相应浓度底物继续发酵,既能解决菌种生长的问题,又能解决底物富足进行发酵从而达到研究者们所期望的目标产物浓度的问题,已经广泛应用在发酵领域,并成功实现了诸多发酵产物的工业化生产。不论是实验室规模[16],还是工业化生产[17],采用补料发酵对于酒精发酵来说,效果均较为理想。曾开展了糖蜜乙醇发酵,先采用20°Bx糖蜜培养酵母菌数至2×108个/mL后,补加等体积高糖度糖蜜(55 °Bx)继续发酵[16],效果显著。此外,甘蔗糖蜜酒精高产酵母菌株MF1001实行高浓发酵生产试验也是类似的方法,采用低浓度罐发酵待菌数繁殖至一定浓度(一般是2×108个/mL左右)后,再混合高浓度罐发酵,也就是低高浓度糖蜜罐混合发酵[17]。
4 结论
菌株1K-9先采用10%木糖培养基进行乙醇发酵,36h补加等体积的20%木糖培养基继续发酵,发酵至108 h时菌数达到了(12.16±0.07)×108个/mL,较未补料发酵时有所提高;发酵108h时醪液中残留的木糖含量为(1.03±0.02)g/L,较未补料发酵时有所降低;乙醇含量达到了6.56%vol,较未补料时提高了1.85%vol。为此,补料发酵是有效的。
