代谢参数指导补料速率提升糖化酶发酵水平
2021-12-06李迎凯张健胡江峰
李迎凯,张健,胡江峰
(1.天津市经济贸易学校,天津 300381;2.天津科技大学生物工程学院,天津 300457)
糖化酶,全名葡萄糖淀粉酶,是一种外切酶,它可以将淀粉、糊精、糖原等物质转化为葡萄糖[1]。糖化酶具有很重要的商业价值,已经在食品、医学、酿造等领域得到了广泛应用[2-5]。
糖化酶生产菌可以从细菌和酵母属中分离得到[6-8],但是目前工业上生产的糖化酶制剂大多来自曲霉和根霉[9-11],其中黑曲霉(Aspergillus niger)被广泛应用于糖化酶发酵生产[12-14]。黑曲霉在自然界中广泛分布,作为一种非常重要的发酵工业菌种,可用于大规模的酶制剂工业化生产。黑曲霉在糖化酶大规模生产上优势明显,其变异小,稳定性高,副产物易去除[15-16]。随着我国淀粉糖行业的快速发展,糖化酶的需求量与日俱增。另外,能源和生产原材料价格也在不断增加,因此,提升该产业市场竞争力的关键就是提高糖化酶的生产能力,降低生产成本[17-18]。
糖化酶发酵过程主要是黑曲霉经深层通风发酵培养后菌体代谢产生。在菌体生长、代谢产物积累的过程中,发酵液中溶解氧都需控制在一定范围内,达到产酶转化率的最佳水平,以最低的能源消耗达到最大的产出,即高效生产。众多研究报道显示[19-23],初始培养基的优化、不同发酵容器的优化、分批培养连续培养的应用,以及培养条件如含水率、温度、pH值、溶氧、搅拌的优化等均可以较好地提高糖化酶的生产水平。但在工业生产过程中仍然面临发酵后期酶活性增加缓慢、转化率低的现象,尤其是发酵周期比较长的真菌发酵,在发酵后期菌丝体生长导致发酵液黏度增大一直是发酵行业普遍存在的问题[24-25],生理代谢参数及相关性的分析已经成为进一步优化生产控制工艺、提升发酵水平的关键[26-27],其中二氧化碳释放速率(carbon evolution rate,CER)表示细胞代谢过程中CO2的释放速率,它的水平能够有效地反映细胞生理代谢状态,因此可以作为衡量发酵水平的重要指标[28]。
本研究通过糖化酶发酵过程生理代谢参数的采集系统,利用多参数相关分析,考察了不同补料方式与生理代谢参数的变化,并结合CER进行补料量的相关优化试验,以期提高糖化酶产量。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
糖化酶生产用菌为黑曲霉(Aspergillus niger):天津市经济贸易学校实验室保藏。
1.1.2 培养基
种子培养基:玉米淀粉90 g/L,玉米浆12 g/L,豆饼粉8 g/L。
发酵培养基:玉米淀粉200 g/L,玉米粉50 g/L,豆饼粉 12g/L,玉米浆 18g/L,KH2PO410g/L,(NH4)2SO42 g/L,CaCl20.3 g/L,柠檬酸 0.5 g/L,硫酸钾 5 g/L。
补料培养基:一水葡萄糖500 g/L。
1.2 仪器与设备
FUS-50L(A)搅拌式生物反应器:国强生化装备有限公司;InPro3100i pH值电极、InPro6860i溶氧电极:梅特勒-托利多仪器有限公司;MAX300-LG过程尾气质谱仪:美国艾科特里尔公司。
1.3 方法
1.3.1 检测方法
1.3.1.1 糖化酶酶活性的测定
酶活性使用淀粉葡萄糖苷酶(amyloglucosidase,AGI)表示。1个AGI单位定义为在pH值4.3和温度60℃条件下,每1 min从可溶性淀粉水解生成1 μmol葡萄糖所需的酶的质量。50 mg糖化酶标品对应大约2 500 AGI。糖化酶酶活性测量:230 μL p-硝基苯基-α-D-吡喃葡萄糖苷试剂(37℃预热5 min)与20 μL发酵上清液混合,37℃反应20 min后加入100 μL p-硝基苯基-α-D-吡喃葡萄糖苷试剂,在405nm下测量混合液体吸光度来定量糖化酶。
1.3.1.2 菌体浓度(packed mycelium volume,PMV)的测定
取发酵液10 mL于离心管中,4 000 r/min离心10 min后,沉淀物占10 mL发酵液的体积百分比即为菌体浓度。
1.3.1.3 溶氧(dissolved oxygen,DO)的测定
通过溶氧电极在线监测溶氧情况。
1.3.1.4 CER的测定
通过过程尾气质谱仪在线监测。
1.3.2 发酵方法
种子培养:在无菌条件下,将斜面上的孢子用去离子水洗下,接入5 L发酵罐中,装液量为3 L,培养温度32℃,搅拌转速240 r/min,罐压0.05 MPa,发酵时间48 h,待pH值出现反弹10 h后移种于50 L发酵罐。
分批培养:将制备好的种子培养液在无菌条件下按接种量10%转入50 L发酵罐中,初始发酵体积为25 L,培养温度维持在34℃,搅拌转速为180 r/min,罐压0.1 MPa,发酵过程中通过流加氨水控制pH值为4.7,连续补料发酵180 h。发酵过程中在线监测DO和CER,每隔6 h分别取样检测PMV及酶活性。
1.3.3 停止补料与降低补料对发酵后期产酶的影响
分别按照以下补料方式进行发酵。补料方式1:正常连续补料发酵180 h;补料方式2:在发酵120 h时停止补料,10 h后恢复补料量为130 mL/h发酵至180 h;补料方式3:在发酵120 h时降低补料量到30 mL/h,持续20 h后恢复补料量为130 mL/h发酵至180 h;补料方式4:在发酵120 h时降低补料量到30 mL/h,持续10 h后恢复补料量为130 mL/h发酵至180 h。
1.3.4 结合CER的变化趋势停止与恢复补料对发酵后期产酶的影响
在正常连续补料发酵过程中监测CER变化趋势,当CER开始出现下降趋势并持续36 h后停止补料,直至CER上升为峰值时恢复补料量为130 mL/h发酵至180 h。为保证试验结果的稳定,进行3次发酵。
2 结果与分析
2.1 停止补料与降低补料对发酵后期产酶的影响
不同补料方式下DO、CER、PMV及酶活性变化如图1所示。
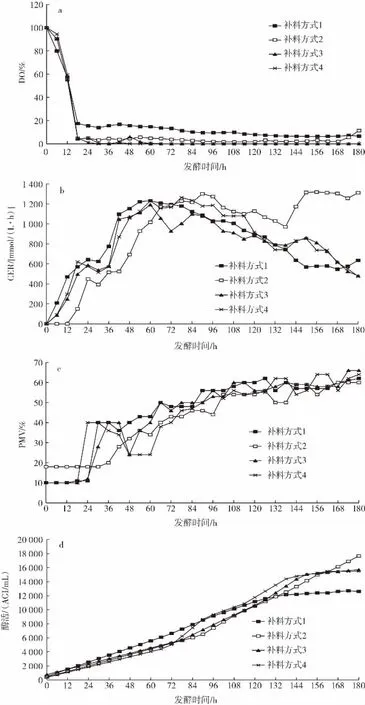
图1 不同补料方式的DO、CER、PMV及酶活性变化曲线Fig.1 DO,CER,PMV and enzyme activity curves of different dosing mode
由图1a可以看出补料方式2发酵168 h后DO开始反弹,而其他补料方式DO并未出现反弹。由图1b可以看出,除了补料方式1,其余补料方式的CER均在发酵至138 h时出现反弹,其中,补料方式2发酵后期的CER值明显高于其他补料方式。由图1c可知,对比PMV变化,补料方式2发酵后期PMV略低于其他补料方式。由图1d可以看到补料方式2、3、4酶活性在发酵后期均高于补料方式1,其中补料方式2的酶活性明显高于其他补料方式,且酶活性一直呈上升趋势。
综合以上结果,补料方式2在发酵后期DO、CER出现反弹,且酶活性高,说明停止补料有利于菌丝发生断裂,使发酵液黏度下降,从而增加了发酵罐内氧传递速率,菌体代谢活力上升,有助于酶活性的增加。补料方式2的最终酶活性比正常发酵增加了40%。
2.2 结合CER的变化趋势停止与恢复补料对发酵后期产酶的影响
将3次发酵的DO、CER、PMV及酶活性变化与补料方式2进行对比,结果见图2。
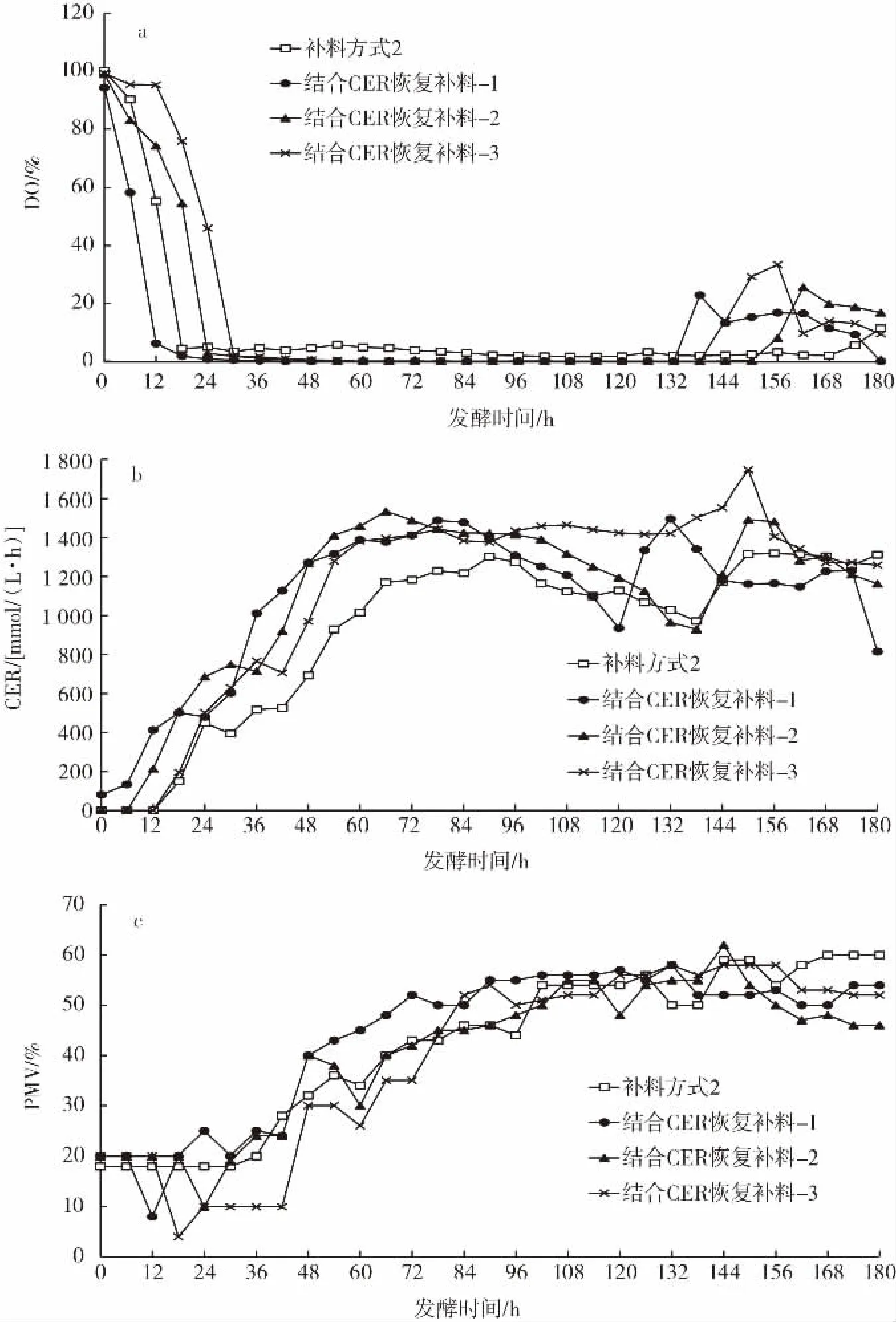
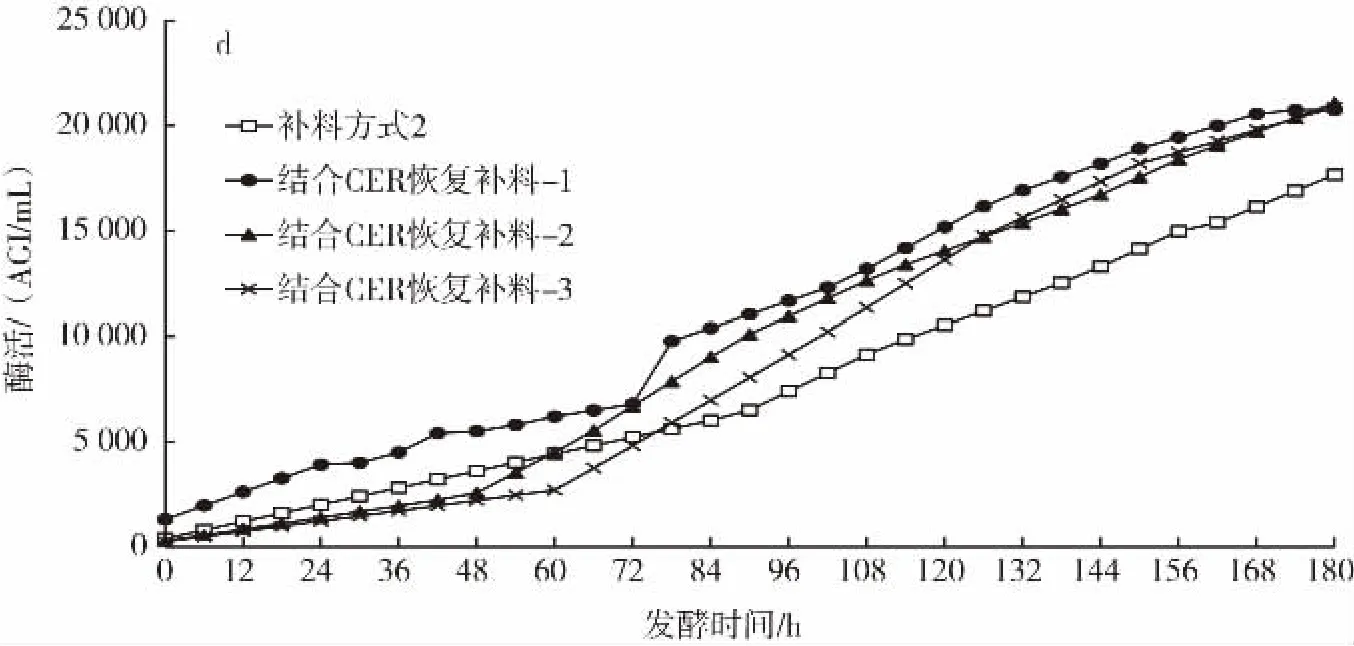
图2 补料方式2与结合CER恢复补料的DO、CER、PMV及酶活性变化曲线Fig.2 DO,CER,PMV and enzyme activity curves by dosing mode 2 and resuming dosing based on CER
由图2a可知,3次发酵试验DO在发酵132 h后都出现反弹,反弹幅度均高于补料方式2。图2b说明停止补料与结合CER恢复补料的CER都会出现反弹。由图2c可知,在发酵156 h后3次发酵试验的PMV均低于补料方式2。3次发酵的酶活性均一直呈上升趋势(图2d),且发酵后期酶活性明显高于补料方式2。
综合以上结果,对比补料方式2,结合CER来进行补料的停止与恢复,在发酵后期DO出现更加明显的反弹,且PMV也明显降低,酶活性更高,说明CER下降一段时间后停止补料可以使菌体将培养基中的碳源得到进一步消耗,这样迫使菌体处于饥饿状态,从而菌丝体的断裂更加充分,发酵液黏度下降,溶氧开始上升。当在CER反弹到峰值时再恢复补料,可以使菌体将恢复的碳源流向产酶代谢途径,有助于酶活性的增加。3次试验最终酶活性平均值达到20 895 AGI/mL,比补料方式2增加了18%。
3 结论
将菌体生理代谢参数CER与补料方式相结合成功应用于黑曲霉糖化酶的发酵优化过程,结果表明,在发酵中后期CER下降36 h时停止补料,一直到CER反弹到峰值恢复补料,能够使菌体断裂更加充分,从而提升了菌体的氧消耗速率,促进糖化酶在发酵后期依然保持较高的合成速率,3次发酵最终糖化酶的平均酶活性达到20 895 AGI/mL,对比优化之前的正常连续补料提高了60%。
改变补料方式只是优化的开始,在发酵前期补料量以及发酵后期如何根据溶氧水平增加补料量等诸多方面优化还需要进一步试验验证。本文结合CER进行补料方式优化取得较好的效果,对结合生理代谢参数优化糖化酶以及其他工业酶类的发酵水平具有借鉴意义,并对生产过程也具有指导作用。
