非酿酒酵母与酿酒酵母混合发酵柿子酒特性的研究
2019-01-02董腾达黄莎莎
荆 雄,杨 辉*,苏 文,董腾达,黄莎莎
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
我国柿子种植面积广、产量高,特别是近年来柿子产量大幅度提高,而柿子鲜食消费市场却相对有限,柿子成熟后一旦不及时采摘加工,很容易软化、腐烂,造成极大经济损失[1]。由于柿子中具有丰富的生物活性物质(如甘露醇、果糖、五环三萜类化合物、维生素和大量的鞣质等),因此可以做成高档调味品、柿子酒和各种保健品等[2-4]。
我国柿子酒的生产工业中多采用商用酵母单菌发酵,这类酵母具备耐高温、耐高酒精的特征,可确保果酒品质[5]。但由于商用酿酒酵母(Saccharomyces cerevisiae)生产的果酒挥发性香气物质含量较少,缺少酯香,导致口感和风味不佳,不能很好地满足市场的需求[6]。随着人们对葡萄酒研究的深入,王志恒等[7]研究发现,在葡萄酒自然酿造过程中存在大量的非酿酒酵母(non-Saccharomyces cerevisiae),这些非酿酒酵母对葡萄酒风味物质的产生具有重要作用。非酿酒酵母是有别于酿酒酵母的一大类酵母,主要包括克勒克酵母属(Kloeckera)、有孢汉逊酵母属(Hanseniaspora)、毕赤酵母属(Pichia)、假丝酵母属(Candida)、德巴利酵母属(Debaryomyces)和伊萨酵母属(Issatchenkia)等[8]。
与酿酒酵母相比,非酿酒酵母能产生更多种类的胞外酶将葡萄酒中的香气前体物质分解从而释放出香气物质[9-11],如能够分泌蛋白酶、果胶酶、纤维素酶等[12]。而水解香气糖苷形成挥发性香气成分的关键酶是β-葡萄糖苷酶[13],β-葡萄糖苷酶具有独特的水解活性,可以从香气前体物质的末端非还原性β-D-糖苷键中释放出非还原性糖基[14],赋予葡萄酒更好的花香、果香味[15]。因此可以将在葡萄酒酿造中发现的非酿酒酵母引用到柿子酒的酿造中,以此提高柿子酒的质量。
目前我国对非酿酒酵母的研究尚处于起步阶段,工业发酵菌株亟待开发。因此本研究选用两种不同类型非酿酒酵母:柠檬形克勒克酵母(Klockera apiculata)和东方伊萨酵母(Issatchenkia orientalis),在对两种非酿酒酵母耐受性研究的基础上,对两种非酿酒酵母与酿酒酵母混合发酵柿子酒的发酵特性进行研究,为非酿酒酵母在柿子酒生产中的应用奠定基础,同时为其他果酒发酵提供参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母(Saccharomycescerevisiae)Z2:本实验室提供,保藏方式为冻干粉;柠檬克勒克酵母(Klockera apiculata)31232、东方伊萨酵母(Issatchenkia orientalis)1344:中国工业微生物菌种保藏中心,提供方式为冻干粉。
1.1.2 试剂
葡萄糖、蛋白胨、酵母浸粉、琼脂粉(纯度≥96%):北京奥博星生物技术有限责任公司;柠檬酸、蔗糖(纯度≥98%):潍坊英轩实业有限公司;硫酸铜、酒石酸钾钠、氢氧化钠、次甲基蓝(纯度≥98%):天津市科密欧化学试剂有限公司;单宁(纯度≥98%):天津市天力化学试剂有限公司。
1.1.3 培养基
种子培养基为酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基:1%酵母膏,2%蛋白胨,2%葡萄糖。
选择培养基为YPD固体(yeast extract peptone agar,YPDA)培养基:在YPD培养基基础上加2%琼脂粉。
发酵培养基为纯柿子汁(经过打浆、酶解、榨汁、调糖调酸得到),调整pH为4.0,将初始可溶性固形物调为20°Bx,还原糖含量为128.86 g/L,总酸含量为8.64 g/L。
上述培养基均在121℃灭菌20 min。
1.2 仪器与设备
PHS-3C型pH计、78-1磁力搅拌器:上海仪电科学器股份有限公司;PL203电子天平:梅特勒-托利多(上海)仪器有限公司;SP-756P紫外可见分光度计:上海光谱仪器有限公司;DSX-280B蒸汽灭菌锅:上海申安医疗器械厂;WMK-08恒温培养箱:山东潍坊医疗器械厂。
1.3 方法
1.3.1 菌种的活化
取三种保藏的酵母冻干粉分别加入含有2%葡萄糖的无菌水中,37℃恒温复水20 min;取2%的菌悬液接种至YPD培养基中28℃培养1 d,稀释涂布于YPDA培养基上28℃培养2d,在固体培养基上挑取菌落特征明显的菌株接种于YPD培养基中,于28℃、150 r/min恒温培养2 d制成种子液,放于冰箱中保藏备用。
1.3.2 两种非酿酒酵母对酒精的耐受性
将1.3.1活化好的两种非酿酒酵母种子液分别按2%接种量接种于酒精度为0、2%vol、4%vol、6%vol、8%vol、10%vol的YPD培养基中,28℃培养24h,使用紫外可见分光光度计测定酵母菌液在波长630 nm处的OD630nm值。
1.3.3 两种非酿酒酵母对单宁的耐受性
将1.3.1活化好的两种非酿酒酵母分别按2%接种量接种于0、0.1 g/L、0.2 g/L、0.3 g/L、0.4 g/L、0.5 g/L不同单宁含量的YPD培养基中,28℃培养24 h,通过血球计数板对酵母数量进行计数。
1.3.4 两种非酿酒酵母对SO2的耐受性
将1.3.1活化好的两种非酿酒酵母种子液分别按2%接种量接种于SO2质量浓度分别为50mg/L、100mg/L、150mg/L、200 mg/L、250 mg/L的YPD培养基中培养24 h之后,使用紫外可见分光光度计测定酵母菌液在波长630 nm处的OD630nm值。
1.3.5 产β-葡萄糖苷酶能力试验
将3种酵母分别梯度稀释后涂布于以纤维二糖为唯一碳源的固体培养基上,28℃培养2 d后观察酵母生长情况。
1.3.6 发酵性能试验
将酿酒酵母和两株非酿酒酵母分别单独接种于柿子汁中,于25℃静置培养7 d进行单菌发酵试验;同时以相同发酵条件将两株非酿酒酵母分别与酿酒酵母按照1∶1混合接种于柿子汁中进行混菌发酵试验(其中混1表示柠檬形克勒克酵母与酿酒酵母,混2表示东方伊萨酵母与酿酒酵母);每隔24 h取样,测定单菌、混菌发酵过程培养基中还原糖、总酸、pH、酒精度等变化情况。
1.3.7 分析检测
(1)发酵过程中理化指标的测定[16]:还原糖采用斐林试剂法测定;总酸采用电位滴定法测定;酒精含量采用密度瓶法。
(2)酵母发酵性能[17]:采用CO2失重法。每隔24h称质量一次,直至发酵结束。
(3)酵母计数[18]:采用改良的麦芽糖琼脂培养基:添加40 mg/L的溴酚蓝,pH4.6。在该培养基上柠檬形克勒克酵母的菌落泛蓝,东方伊萨酵母菌落呈蓝色,且菌落较大,酿酒酵母则是白色微泛黄菌落,根据菌落形态特征的不同进行酵母计数。
2 结果与分析
2.1 两种非酿酒酵母对酒精的耐受性
两种非酿酒酵母对酒精的耐受性结果见图1。由图1可知,当酒精度>4%vol之后,柠檬形克勒克酵母生长严重受到抑制,而对东方伊萨酵母生长几乎没有影响;当酒精度>8%vol之后,东方伊萨酵母生长开始受到抑制,而柠檬形克勒克酵母几乎不能生长。由此可以得出,东方伊萨酵母相比于柠檬形克勒克酵母对酒精耐受性更好。

图1 非酿酒酵母对酒精的耐受性Fig.1 Tolerance of non-Saccharomycesto ethanol
2.2 两种非酿酒酵母对单宁的耐受性
由于柿子中单宁含量较高,单宁与蛋白质可发生沉淀反应,因而过高的单宁含量会对酵母的生长起到抑制作用。经测定新鲜柿子经过脱涩、酶解、榨汁处理后柿子汁中单宁含量在0.2~0.4g/L之间,两种酵母对单宁的耐受性结果见图2。由图2可知,两种非酿酒酵母在单宁添加量为0.1~0.5g/L时,酵母数量都有略微的下降,但菌体数量都能维持在108CFU/mL以上。因此,两株非酿酒酵母在柿子汁中仍可以保持较高数量生长。

图2 非酿酒酵母对单宁的耐受性Fig.2 Tolerance of non-Saccharomycesto tannin
2.3 两种非酿酒酵母对SO2的耐受性

图3 非酿酒酵母对SO2的耐受性Fig.3 Tolerance of non-Saccharomycesto SO2
在果酒的酿造过程中,需要加入少量的SO2来防止杂菌的污染,同时还能够起到抗氧化及护色的作用[19]。SO2质量浓度对两种酵母生长的影响结果见图3。从图3可知,两种非酿酒酵母生长量随着SO2质量浓度的增加都有所降低,但降低幅度都较小;在SO2质量浓度<100 mg/L之前,酵母生长良好,有轻微抑制作用。
2.4 产β-葡萄糖苷酶能力试验
图4为三种酵母经过梯度稀释涂布后在纤维二糖固体培养基上培养2 d的生长情况,从图中可以看出柠檬形克勒克酵母数量较多,能够很好的利用纤维二糖进行生长,其次为东方伊萨酵母,酿酒酵母培养2 d后只有两个酵母生长出来,并且酵母形态偏小,生长速度缓慢。从三种酵母在纤维二糖培养基上的生长情况可以得出,柠檬形克勒克酵母产β-葡萄糖苷酶能力最强,其次为东方伊萨酵母,酿酒酵母最弱。

图4 酵母菌产β-葡萄糖苷酶能力Fig.4 The β-glucosidase producing ability of yeasts
2.5 发酵性能试验
2.5.1 发酵过程中还原糖和酒精度变化
两种酵母在发酵过程中还原糖和酒精度变化结果见图5。
由图5(A)可知,不同发酵方式下发酵液中还原糖含量的变化,无论是酿酒酵母单菌发酵还是与非酿酒酵母混合菌发酵,在发酵48 h后发酵液中还原糖消耗殆尽,而两种非酿酒酵母在发酵结束后发酵液中还原糖含量都保持较高水平,柠檬形克勒克酵母残糖量最高。由图5(B)可知,不同发酵方式下发酵液中酒精度的变化,其中发酵结束后酿酒酵母单菌发酵酒精度最高达到11%vol,柠檬形克勒克酵母和东方伊萨酵母产酒精能力较弱,分别为3.05%vol和4.51%vol,与图5(A)中对还原糖的利用结果相一致。单纯酿酒酵母、非酿酒和酿酒酵母混合菌种发酵中由于有酿酒酵母的存在可使还原糖降到很低,所得酒的酒精度高于非酿酒酵母发酵的酒精度。混合酵母发酵将非酿酒酵母増香提升酒的品质与酿酒酵母的高效率发酵结合起来,可酿造出酒度高香气丰富的高品质发酵酒。

图5 发酵过程中还原糖含量(A)和酒精度(B)变化Fig.5 Changes of reducing sugar(A)and alcohol content(B)during fermentation process
2.5.2 发酵过程中pH和总酸变化

图6 发酵过程中pH(A)和总酸含量(B)变化Fig.6 Changes of pH(A)and total acid content(B)during fermentation process
发酵醪液的pH或酸度是影响酵母发酵活力的重要因素之一,发酵过程中pH的变化对酵母活力有一定的影响,发酵过程中pH变化如图6(A)所示,在发酵起始阶段,由于释放出来的二氧化碳较少,可能有部分二氧化碳溶解于醪液中,同时发酵初期酵母形成乙酸等酸性物质,导致pH下降,随着发酵的进行,发酵速率加快,酒精度不断上升,酿酒酵母单菌和混菌发酵液pH逐渐上升,直至最后发酵趋于稳定,其pH也趋于稳定。由图6(B)可知,在发酵前2 d总酸含量均呈现上升趋势,与图6A中pH变化相一致;之后在酒精发酵过程中酵母能够产酸同时也具备分解有机酸的能力,使得总酸含量出现上下波动的趋势,直至发酵结束酿酒酵母发酵柿子酒醪液中总酸含量最低,说明酿酒酵母分解有机酸能力较非酿酒酵母强。
2.5.3 发酵过程中酵母数量的变化
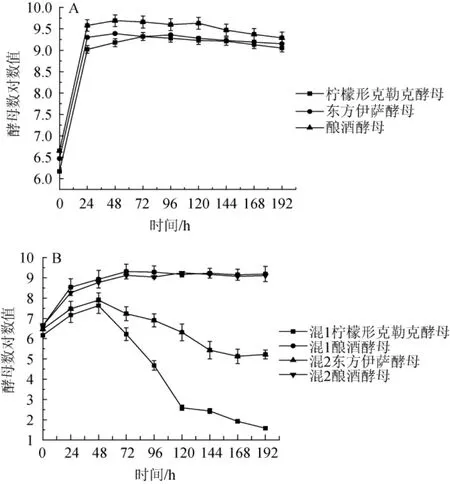
图7 单菌发酵(A)及混合菌发酵(B)过程中酵母数量的变化Fig.7 Changes of yeast number during single strain fermentation(A)and mixed fermentation(B)
由图7(A)可知,三种酵母单菌发酵过程中,在发酵24 h内酵母数量均呈指数倍增长,其中酿酒酵母发酵性能最好,酵母数量最高;之后随着发酵的进行,酵母数量都能保持在一定水平。由图7(B)可知,在混菌发酵中,发酵初期由于非酿酒酵母与酿酒酵母竞争利用营养物质,使得酵母数量都低于酵母单菌发酵;发酵48 h后混1中柠檬形克勒克酵母数量开始急剧下降,直到发酵结束酵母基本上全部衰亡;混2中东方伊萨酵母数量也出现下降,但到发酵结束仍有一定数量东方伊萨酵母存在,这是由于随着发酵的进行,发酵液中酒精浓度逐渐升高,而东方伊萨酵母酒精耐受性较柠檬形克勒克酵母好,所以酵母存活数量多。
2.5.4 酵母发酵性能的测定
酵母发酵会产生大量的二氧化碳,通过对发酵过程中二氧化碳释放量的测定来确定酵母的发酵性能,结果见图8。由图8可知,酿酒酵母单菌发酵性能最好,略高于两种混菌发酵方式,在发酵前5 d可以观察到瓶中有大量气泡产生,二氧化碳释放量达到106.55 g/L;两种非酿酒酵母发酵性能较差,产生气泡较少,其中柠檬形克勒克酵母单菌发酵性能最差,直致发酵结束二氧化碳释放量才达到57.96g/L。
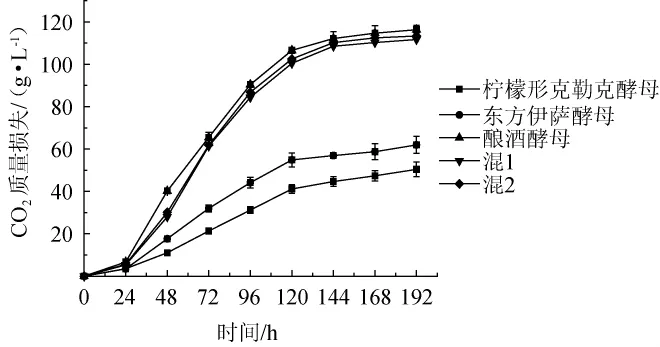
图8 酵母发酵曲线Fig.8 Fermentation curves of yeasts
3 结论
通过对两种非酿酒酵母耐受性、产酶和发酵特性的研究,发现东方伊萨酵母的耐受性优于柠檬形克勒克酵母,产β-葡萄糖苷酶能力较柠檬形克勒克酵母差;三种酵母进行单菌发酵,酿酒酵母发酵性能最好,产酒精能力强;两种非酿酒酵母均不能单独完成发酵,在混合发酵前期与酿酒酵母具有相互竞争作用,但之后非酿酒酵母渐渐衰亡,对酿酒酵母的发酵的影响减弱,但对最终发酵酒精度几乎没有影响。
采用不同的接种方式将非酿酒酵母引入酒精发酵过程,在发酵结束后得到了不同风味的果酒,其中有克勒克酵母参与发酵的柿子酒酒体具有较浓的果香味,香味物质比较复杂,对此,后期研究可通过对发酵液中风味物质的种类和含量进行分析,以便了解非酿酒酵母对果酒増香和品质提升的深层次原因。
