大鼠亚急性酒精性肝损伤模型的建立*
2018-12-29柴玮杰孙建飞王明秋高珉之
柴玮杰 孙建飞 王明秋 高珉之 孟 琳
(黑龙江省疾病预防控制中心,哈尔滨 150030)
肝脏是人类基本代谢和酒精代谢的主要器官,超过95%的酒精是在肝脏中完成代谢的。酒精性肝病是慢性酒精中毒最常见和最严重的并发症, 而对酒精性肝病发病机制、病理学改变、预防和治疗酒精性肝病的有效药物筛选及其作用机制等相关研究则需要通过动物实验来实现,所以建立一个与人类酒精性肝病相似的动物病理实验模型非常必要。
1 材料与方法
1.1 动物来源
SPF级雌性Wistar大鼠,体质量150~180 g,由北京维通利华实验动物技术有限公司提供(许可证号:SCXK(京)2012-0001)。
1.2 饲养环境
屏障环境,许可证号:SYXK(黑)2011-014,温度(23±2)℃,湿度(55±10)%。光照周期为12 h:12 h(光照起止时间为6:00-18:00)。饲料由北京科澳协力饲料有限公司提供,许可证号SCXK(京)2014-0010。水和饲料自由饮食。
1.3 主要实验仪器和试剂
1.3.1主要实验仪器:动物天平、分析天平、日立7080全自动生化分析仪、722型分光光度计、恒温水浴锅、离心机、组织匀浆器、病理制片仪器(所有计量仪器经黑龙江省计量检定测试所检测合格)。
1.3.2主要试剂:乙醇脱氢酶(ADH)测试盒、丙二醛(MDA)测试盒、还原型谷胱甘肽(GSH)测试盒、超氧化物歧化酶(SOD)测试盒由南京建成生物工程研究所提供,血清生化分析试剂盒由中生北控生物科技股份有限公司提供。甲醛,伊红,戊巴比妥钠。
1.4 方法
SPF级雌性Wistar大鼠30只,体质量150~180 g,随机分为3组,每组10只,分别为15%酒精含量组、30%酒精含量组和空白对照组(蒸馏水),试验周期为8周。各组动物均采用经口灌胃方法,以15 mL/kg·BW连续灌胃8周。实验结束时,动物禁食不禁水16 h,从大鼠眼眶静脉丛采血,测定血清中ADH、ALT、AST;并取肝脏,测定肝脏组织MDA、SOD、GSH、TG及肝脏组织病理学损伤。
1.5 统计方法
应用Stata8.0统计软件对各试验数据结果进行统计分析。
2 结果
2.1 日常观察结果
空白对照组大鼠毛发亮泽,动作灵活,饮食和大便正常,无死亡;模型组大鼠在灌胃初期均有精神萎靡,呆滞等现象,一般经过4 h后开始苏醒,16 h后完全清醒,并变现为毛发光泽性差。
2.2 酒精性肝损伤大鼠肝组织中MDA、GSH、TG含量及SOD的活力
由表1可见,MDA 30%酒精组与空白对照组比较有显著性差异(P<0.05);GSH 30%酒精组、15%酒精组与空白对照组比较有显著性差异(P<0.01,P<0.01);SOD 30%酒精组、15%酒精组与空白对照组比较有显著性差异(P<0.01,P<0.01);TG 30%酒精组与空白对照组比较有显著性差异(P<0.01)。
2.3 酒精性肝损伤大鼠血清中ADH、ALT、AST含量
由表2可见,ADH 30%酒精组、15%酒精组与空白对照组比较有显著性差异(P<0.01,P<0.05); 30%酒精组大鼠血清ALT显著升高(P<0.01);各组血清AST无显著变化(P>0.05)。

表1 酒精性肝损伤对大鼠肝组织中MDA、GSH、SOD、TG的影响
注:*与空白对照组比较,有显著性差异P<0.05,**与空白对照组比较,有显著性差异P<0.01 Note:*P<0.05 compared with control group,**P<0.01 compared with control group

表2 酒精性肝损伤大鼠血清中ADH、ALT、AST的含量
注:*表示试验组与空白对照组比较P<0.05,**表示试验组与空白对照组比较P<0.01 Note:*P<0.05 compared with control group,**P<0.01 compared with control group
2.4 对大鼠肝组织病理的影响
模型组大鼠血脂代谢紊乱、肝内脂肪蓄积,病理组织学检查可见弥漫性的肝细胞脂肪变性,细胞内可见大小不等的脂肪滴(见图1、图3),空白对照组肝细胞(见图2、图4)。由表3可见:15%酒精组、30%酒精组肝组织脂肪变性程度与空白对照组比较,有显著性差异(P<0.01,P<0.01)。
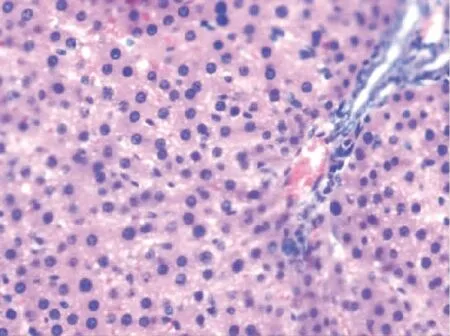
图1 肝细胞脂肪变性(HE ×200)

图2 空白对照组肝细胞(HE ×200)
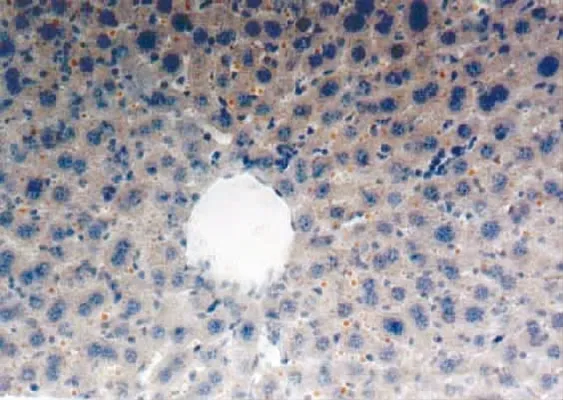
图3 肝细胞脂肪变性(苏丹Ⅲ ×200)
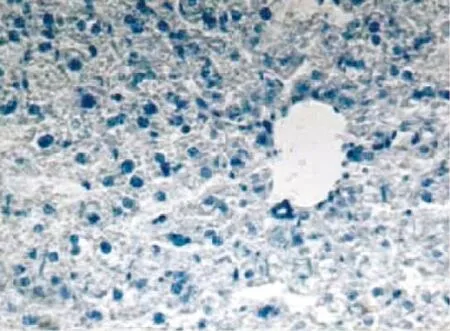
图4 空白对照组肝细胞(苏丹Ⅲ ×200)

表3 酒精性肝损伤大鼠肝组织的病理变化
注:**表示试验组与空白对照组比较P<0.01 Note:**P<0.01 compared with control group
3 讨论
酒精是导致人类肝损伤的重要原因,必须建立动物模型来研究酒精性肝损伤的发病机制,以寻求防治措施。酒精灌胃模型在国内广泛使用,张旭强等[1]先用40%的白酒灌胃1周后,每周提高5%酒精浓度灌胃,第4周后以56度白酒灌胃。前4周灌酒的剂量为1.0 mL/100 g体质量,后4周灌酒计量为1.2 mL /100 g,每天灌胃1次,造模12周。结果显示模型组大鼠血清中ALT、AST水平明显升高与正常组比较有显著性差异。周宁等[2]按大鼠体质量灌胃56度的白酒7 g/kg,每日1次,实验周期24周。结果显示模型组大鼠肝脏病理改变为脂肪肝和肝细胞炎症同时存在,随着造模时间的延长肝脏病变加深。国内有科学工作者采用以下方法对大鼠进行酒精灌胃饲养:即随着饲养时间的延长而不断加大酒精剂量,具体方法是:1~4周的酒精饲养剂量为5 g/kg·d-1;5~8周剂量为7 g/kg·d-1;9~12周剂量为9 g/kg·d-1;13~24周剂量为9.5 g/kg·d-1[3]。通过这种递增式的高浓度长时间酒精灌胃,比较容易诱导急性肝损伤,同时可以诱导较为严重的酒精性肝纤维化[4]。我们在预实验中曾设45%酒精对照组,但4周时死亡一半,所以正式试验我们取消这一剂量组。本实验选用SPF级雌性Wistar大鼠,模型组分别以酒精含量为15%、30%的普通白酒,对照组给予蒸馏水,以15 mL/kg·BW经口灌胃方式给予,于实验第8周将模型组与正常组比较,结果显示,酒精浓度15%损伤不明显, 30%造模结果比较理想。模型组肝脏组织MDA、TG含量显著升高(P<0.05,P<0.01),SOD、GSH含量显著性降低(P<0.01)。模型组大鼠血脂代谢紊乱、肝内脂肪蓄积,血清ALT、ADH指标明显升高,模型组与正常组比较相关指标均有显著性差异;从肝脏病变得分来看,模型组病变总分值明显增加且具有统计学意义,酒精性肝损伤模型是以肝组织病理改变为主要特征,如肝细胞空泡变性[5],我们的结果也如此。由此可见,大鼠经口灌胃给予30%的普通白酒8周,可致肝损伤,结果可重复,成功建立大鼠亚急性酒精性肝损伤的动物模型。
性别的差异也是导致酒精性肝病的重要因素,与男性相比,女性对酒精所诱发的肝脏毒性效应更加敏感。临床上常用血清学指标反映肝细胞损伤程度,ALT, AST,均为临床上最常使用的判断肝功能的血清学指标[6-8]。其中ALT只存在于肝细胞质中,而AST在肝细胞质内只占20%,其余80%存在于线粒体中。当肝细胞变性、细胞膜通透性增加时,从细胞内逸出的主要是ALT,而当肝细胞严重病变、坏死时,线粒体内AST渗漏入血。本次造模采用低度酒,给予8周,结果显示,模型组大鼠血清ALT活性均较空白对照组明显增高,表明长期过量饮酒己对大鼠肝脏细胞结构和功能构成损伤,结果与空白对照组比较差异显著,但还没有造成特别严重损害。研究认为乙醇脱氢酶在酒精性肝病发生和发展中起着不可替代的作用。酒精在肝细胞中有3种主要的代谢途径,依次为ADH途径、MEOS、过氧化物酶途径。乙醇脱氢酶(ADH)是乙醇在体内代谢的重要酶类之一,体内乙醇脱氢酶主要在肝脏生成,所以肝脏疾患与乙醇脱氢酶活性相关。测定乙醇脱氢酶活性可以反映肝脏受损情况。与空白对照组比较,模型组大鼠血清ADH活性明显增强(P< 0.05),表明长期过量饮酒可对大鼠肝脏造成严重损伤;提示持续摄入乙醇可诱导肝脏ADH活性增高,乙醛生成量增加,加重肝脏损伤;证实亚急性酒精中毒大鼠肝脏损伤模型建立成功。
为进一步研究慢性酒精中毒引起大鼠肝损伤机理,本项研究从抗氧化角度,选择MDA、SOD和GSH作为效果观察指标。谷胱甘肽(GSH)是一种低分子清除剂,缺乏或耗竭GSH会促使许多化学物质或环境因素产生中毒作用或加重其中毒作用,这可能与增加氧化损伤有关,因而GSH量的多少是衡量机体抗氧化能力大小的重要因素。乙醇代谢产物乙醛也可通过黄嘌呤氧化酶系统产生氧自由基,其本身还能与GSH的巯基及抗氧化蛋白酶结合,肝脏细胞内GSH含量减少或消耗,抗氧化酶活性下降,肝脏内源性抗氧化能力减弱[9]。测试丙二醛(MDA)的量常常可反应机体内脂质过氧化的程度,间接地反应出细胞损伤的程度。 MDA是自由基损伤不饱和脂肪酸生成的脂类过氧化分解产物,其含量的升高也可以间接证明自由基水平升高及反映机体受活性氧损伤的程度;超氧化物歧化酶(SOD)对机体的氧化与抗氧化平衡起着至关重要的作用,此酶能清除超氧阴离子自由基(O2·-)保护细胞免受损伤。SOD是一种存在于细胞液中的抗氧化酶,可清除超氧阴离子自由基(O2·-),保护组织细胞免受超氧阴离子的损伤,在平衡机体的氧化与抗氧化关系中起至关重要的作用,SOD活性的高低可间接反映机体抗氧化能力的强弱;此外,长期过量摄入酒精会使自由基生成增加,进一步促进脂质过氧化反应,使血清转氨酶升高、终产物MDA生成增加,消耗GSH,生成大量过氧化脂质,抑制抗氧化系统的保护作用,使体内氧化-抗氧化机制失衡,引起肝脏损伤。
本项研究结果显示,模型组大鼠的肝组织SOD活性及GSH含量较正常组明显降低,而MDA含量则明显增高。提示持续过量的酒精在大鼠肝脏代谢过程中不断产生的自由基己经造成GSH耗竭,SOD酶活性由代偿性增加至失代偿下降及抗氧化酶的合成减少[10]。证实亚急性酒精中毒大鼠体内氧化应激作用增强,抗氧化能力减弱是导致肝脏损伤的主要原因。此结果与乙醇致肝脏损伤发生机理的相关研究报道一致。
