食源性细菌关键小分子信号通路研究进展
2018-12-29王飞飞傅玲琳鲍星月刘长军张晓双王彦波
王飞飞,傅玲琳,鲍星月,刘长军,张晓双,王彦波,*
(1.浙江工商大学食品与生物工程学院,浙江食品质量安全工程研究院,浙江 杭州 310018;2.象山县水产技术推广站,浙江 象山 315700)
研究表明细菌是引起食品腐败变质的重要原因,据统计全球约1/4的食品损失是由细菌等微生物单独活动引起的[1],其导致了巨大的经济损失和严重的公共卫生问题。自20世纪30年代以来,研究人员逐渐发现大多食源性致病菌能形成生物被膜,可以存在于食品加工厂包括塑料、玻璃、金属和木材等各种表面;也可以在食品运输和贮藏过程中形成,黏附在固体表面[2]。细菌在形成生物被膜后对化学杀菌剂和环境变化的敏感程度显著降低,耐热性也相应增加,可引起显著的食品安全问题,最终导致严重的健康问题和经济损失[3]。
研究表明细菌有两种关键的小分子信号通路,包括群体感应(quorum sensing,QS)系统和环二鸟苷酸(cyclic di-guanosine monophosphate,c-di-GMP)系统,其在多种细菌的一系列生理功能中都起着重要调控作用,包括胞外酶分泌、毒力调节、生物被膜形成和细胞运动性等[4]。此外,近年来越来越多的研究报道了QS对食品腐败的调控作用。QS通过自诱导物(autoinducers,AIs)的分泌、释放、感应来调控细胞密度依赖的基因表达,使细胞的基因表达从低细胞密度的个体生活方式转换为协同的高细胞密度状态[5]。c-di-GMP系统可以将包括分子氧、氨基酸、电子、光子等环境刺激转化为c-di-GMP信号[6],并由其效应分子核糖开关或/和受体蛋白介导调控基因表达完成信号转导[7]。食源性细菌通过胞外AIs和胞内c-di-GMP这两大类小分子信号来调控其生存状态,从而影响食品的品质和安全。目前,有关QS和c-di-GMP信号通路的研究主要集中在医药和生物防治领域,在食品领域仍待进一步探究,鉴于此,本文综述食源性细菌关键小分子信号通路研究进展,旨在提供保障食品品质和安全的控制靶点。
1 食源性细菌关键小分子信号通路概述
1.1 细菌QS概述
研究发现,细菌会通过细胞间的相互交流控制一系列的生命活动。细菌在生长过程中通过QS来调控相关基因的表达以促使自身更好地适应外界环境。QS依赖于被称为AIs的信号分子的产生、分泌及应答,信号分子随着细菌的生长在一定基础水平上继续产生和分泌,从而使环境介质中信号分子浓度达到一个阈值水平(即群体水平),并与细胞膜上或胞内的受体结合进而调控QS依赖的目的基因表达来诱导相应表型[8],这种细胞间的相互沟通方式被称为QS。目前,可将已经鉴定到的信号分子归为4大类:一是酰基高丝氨酸内酯(acylhomoserine lactone,AHL),其是一种脂肪酸的衍生物,被统一称为AI-1,产生于革兰氏阴性菌中,主要参与种内信号交流;二是呋喃硼酸二酯,产生于S-腺苷高半胱氨酸到同型半胱氨酸的循环过程中,被统称为AI-2,可同时由革兰氏阴性菌和阳性菌产生,并参与种内和种间的信号传递;三是AI-3,首次在肠出血性大肠埃希菌中发现,参与调控毒性因子的产生;四是自诱导多肽(autoinducing peptides,AIPs),存在于由革兰氏阳性菌中[9]。细菌大多数QS调节的生理过程都是为了确保在一定环境下更高的存活率[10]。
大多数细菌利用两种机制来检测AIs并作出响应,从而调控靶向基因的表达。第一种机制以依赖AHL的QS系统为代表,存在于革兰氏阴性菌中,AHL由LuxI型AHL合成酶产生,其受体是LuxR家族转录因子。LuxR-AHL复合物是一个二聚物,与受QS调控的启动子保守回文序列结合,包括luxI自身的启动子,激活AHL的产生(自诱导)以及其他靶基因的表达。在另一种机制中,信号分子则由膜双组分应答调节系统检测到,同时存在于革兰氏阴/阳性菌中[11],如葡萄球菌属(Staphylococcus)产生的信号多肽AIP。在该系统中,信号分子由膜上的感应器检测并将信号转导给胞内的反应调节子,通过调节性RNAs和转录因子来调控靶基因表达[12]。哈氏弧菌(Vibrio harveyi)的QS系统却同时具备革兰氏阴性菌和阳性菌的特征,既可以像革兰氏阴性菌那样产生并应答高丝氨酸内酯,也可以像革兰氏阳性菌那样通过膜结合的组氨酸激酶来实现信号转导[11]。
1.2 细菌c-di-GMP概述
细菌c-di-GMP最初作为木醋杆菌(Gluconacetobacter xylinum)中纤维素合酶的变构激活剂而被发现[13]。c-di-GMP由两个三磷酸鸟苷分子在二鸟苷酸环化酶(diguanylate cyclase,DGC)作用下合成,DGC包含由大约170 个氨基酸组成的GGDEF结构域[14]。相反地,c-di-GMP被特异性磷酸二酯酶(phosphodiesterase,PDE)降解,PDE包含由大约250 个氨基酸组成的EAL或HD-GYP结构域[15]。与QS机制不同的是,c-di-GMP有着多重信号通路,很多细菌都能编码大量合成和降解c-di-GMP的蛋白,比如大肠杆菌K-12(Escherichia coli K-12)能编码12 个含有GGDEF结构域的蛋白,10 个含有EAL结构域的蛋白,以及7 个同时含有这两个结构域的蛋白[16]。其次,在细菌基因组中编码GGDEF和EAL结构域蛋白的数量是高度可变的,从不编码到编码100多个蛋白不等。虽然这些结构域都是保守的,每个蛋白都有其独特的N-末端感知域用来接收外界不同信号[17]。
目前已确认c-di-GMP在生物体内主要通过效应蛋白和mRNA核糖开关发挥作用。效应蛋白包括含PilZ结构域的蛋白,含有退化的GGDEF和EAL结构域蛋白以及转录调控因子[18]。mRNA核糖开关指mRNA 5’非编码区的特定保守序列折叠成一定的构象,能专一性地与c-di-GMP结合并影响蛋白质翻译。在G. xylinum中发现c-di-GMP能激活BcsA-BcsB纤维素合酶复合体从而增加胞外多糖基质的合成,经结构分析发现c-di-GMP能与BcsA蛋白C末端的PilZ结构域结合,这也是第一个被实验证实的c-di-GMP受体蛋白。含PilZ结构域的蛋白分布非常广泛,例如E. coli中调节细菌运动能力的YcgR和铜绿假单胞菌(Pseudomonas aeruginosa)中调节胞外藻酸盐合成的AlgA。退化的GGDEF和EAL结构域蛋白指含有与GGDEF、EAL或HD-GYP类似的结构域,且不具有合成或降解c-di-GMP活性的蛋白,P. aeruginosa中发现的调控Pel多糖合成的内膜蛋白PelD和荧光假单胞菌(Pseudomonas fluorescens)中发现的调控生物被膜中胞外蛋白合成与分泌的LapD都属于这类蛋白[7]。P. aeruginosa中的FleQ[19]和霍乱弧菌(Vibrio cholerae)中的FlrA[20]都是增强子结合蛋白,属于c-di-GMP转录因子类型的效应蛋白。c-di-GMP是重要的细菌第二信使,被认为是各种生物体中形成和维持生物被膜的调节中心,控制着细胞在可运动的单细胞状态与黏附的多细胞状态之间的转换[17]。
2 食源性细菌关键小分子信号通路对食品腐败的调控
近年来,关于QS对食品腐败调控方面的研究越来越多,目前已在各类食品中检测到QS信号分子,包括牛奶和乳制品、肉和肉制品、海鲜和水产品、水果和蔬菜等。此外,QS对食品腐败的调控也在一些研究中得到验证。而细菌胞内小分子信号c-di-GMP对食源性细菌腐败特性的调控及其机制还鲜有研究。以下将围绕QS与食品腐败展开讨论。
牛奶中腐败菌Pseudomonas spp.、Serratia spp.、肠杆菌属(Enterobacter spp.)和Hafnia alvei的致腐能力与QS有关[21]。从包装鳕鱼片中检出的N-(3-羟基)-L-高丝氨酸内酯(N-(3-hydroxyoctanoyl)-L-homoserine lactone,3-OH-C8-HSL)能够调节明亮发光杆菌(Photobacterium phosphoreum)和气单胞菌属(Aeromonas spp.)的几丁质酶活性,表明AHL型QS系统可能在甲壳类动物的腐败中发挥作用[22]。从熏制鲑鱼里分离出来的变形斑沙雷氏菌(Serratia proteamaculans)B5a菌株,其胞外酶活性受AHL信号分子调节[23]。同样地,N-丁酰基-L-高丝氨酸内酯(N-butanoyl-L-homoserine lactone,C4-HSL)能增加嗜冷假单胞菌(Pseudomonas psychrophila)PSPF19菌株胞外酶的产量并提高其在冷藏淡水鱼中的致腐能力[24]。另外,豆芽的细菌性腐败也受QS系统影响[25]。从生鲜蔬菜加工线分离的朴立茅次沙雷菌(Serratia plymouthica)RVH1菌株中的LuxI的同系物SplI,负责调控C4-HSL、N-己酰-L-高丝氨酸内酯(N-hexanoyl-L-homoserine lactone,C6-HSL)和N-(3-O-己酰基)-L-高丝氨酸内酯(N-(3-oxohexanoyl)-L-homoserine lactone,3-oxo-C6-HSL)的产生。S. plymouthica胞外几丁质酶、核酸酶以及蛋白酶的产生与SplI型的QS系统有关[26]。在S. plymouthica RVH1菌株的SplI突变体中,这些胞外酶的产量减少,只有通过添加C6-HSL或3-oxo-C6-HSL才能恢复[27]。在与黄瓜腐病相关的黏质沙雷菌(Serratia marcescens)MG1菌株和沙雷氏菌(Serratia sp.)ATCC 39006菌株中,其与腐败有关的胞外酶的分泌分别受SwrI/SwrR QS系统及其同源物质C4-HSL、SmaI/SmaR QS系统及其同源物质C4-HSL和C6-HSL的调节[26,28-29]。最近,一系列环二肽分子(diketopiperazines,DKPs)在多种革兰氏阴性菌中被检出,且被报道具有调控AHL型QS能力[30]。研究发现DKPs能促进腐败希瓦氏菌(Shewanella putrefaciens)和/或波罗地海希瓦氏菌(Shewanella baltica)生物被膜的形成[31-32]、氧化三甲胺还原酶(trimethylamine N-oxide reductase A,torA)和鸟氨酸脱羧酶(ornithine decarboxylase,ODC)的基因表达[32],以及挥发性盐基氮、三甲胺、腐胺和胞外蛋白酶的产生[31-33]。因此,DKPs被认为是新型QS信号分子[34]。本课题组研究发现,S. baltica中DKPs能与LuxR型受体直接结合从而调控氧化三甲胺还原酶调节蛋白TorS,诱导型鸟氨酸脱羧酶SpeF和鞭毛马达蛋白PomA的表达,进而影响三甲胺、腐胺和生物被膜的形成。上述研究初步确认了QS系统对食品腐败菌致腐能力的调控作用,但QS调控腐败菌致腐能力以及生物被膜形成能力的分子机制仍有待进一步研究。
3 食源性细菌关键小分子信号通路对生物被膜的调控
由食源性疾病引发的食品问题已成为我国目前主要的食品安全问题,其中,微生物是主要食源性疾病病原。食源性致病菌形成复杂和多层结构的生物被膜有助于细菌群落在静止和安全的环境中生存而不容易被彻底清除,从而使其得到扩散蔓延,影响食品安全。
3.1 细菌QS与生物被膜形成
研究表明无法合成N-(3-O-十二酰基)-L-高丝氨酸内酯(N-(3-oxododecanoyl)-L-homoserine lactone,3-oxo-C12-HSL)的P. aeruginosa lasI突变株只能形成平坦、未分化的生物被膜,并且对十二烷基硫酸钠的分散作用更敏感[35],该研究首次将QS与生物被膜形成联系起来。目前普遍认为QS在食源性细菌生物被膜形成中起着重要作用。
Cloak等在从牛奶和鸡汤中分离出来的空肠弯曲杆菌(Campylobacter jejuni)中检出了AI-2,并在其基因组中找到了编码AI-2合成酶的基因luxS[36]。研究发现C. jejuni的luxS突变株与野生株相比生物被膜形成减少,添加野生株的无菌24 h培养上清液促进了生物被膜的形成[37]。嗜水气单胞菌(Aeromonas hydrophila)AHL合成酶ahyI突变株由于不能合成C4-HSL,不能形成成熟的生物被膜。此外,在A. hydrophila中发现了一个LuxR型受体能与AHL结合从而调控ahyR突变株生物被膜的形成,这说明QS能调控A. hydrophila的生物被膜形成[38]。蜡样芽孢杆菌(Bacillus cereus)QS系统包括LuxR型受体PlcR和LuxS/AI-2系统,plcR突变株形成的生物被膜比野生株多约4 倍[39]。外源添加AI-2降低了B. cereus野生株生物被膜的形成,添加AI-2到B. cereus已形成的生物被膜中导致被膜分散[40]。因此,PapR和AI-2对B. cereus生物被膜的形成具有负调控作用。单增李斯特菌(Listeria monocytogenes)具有LuxS/AI-2系统,其luxS突变株形成的生物被膜比野生株厚4 倍,故AI-2对L. monocytogenes生物被膜形成具有负调控作用[41]。E. coli QS系统包括LuxS/AI-2系统和LuxR型受体SdiA,外源添加AI-2增加了E. coli K-12野生株的生物被膜形成[42],SdiA突变株的生物被膜形成比野生株增加好几倍,外源添加的AHL通过与SdiA受体结合从而抑制生物被膜形成[43]。鼠伤寒沙门氏菌(Salmonella enterica serovar Typhimurium)也有LuxS/AI-2系统,luxS突变株不能形成成熟的生物被膜,当进行luxS基因回补时其生物被膜得以恢复[44]。V. cholerae在高细胞密度时的生物被膜形成主要受LuxR型转录因子HapR调控,hapR突变株生物被膜形成增加[45]。创伤弧菌(Vibrio vulnificus)luxR型基因smcR突变株的生物被膜形成比野生株增加了大约5 倍[46]。P. aeruginosa有2 套LuxR/LuxI系统,即LasR/LasI和RhlR/RhlI,lasI和rhlI突变株形成的生物被膜较野生株显著减少[47],lasI和rhlI突变株中控制基质胞外多糖合成的pel操纵子的转录受到了抑制[48]。此外,6-姜酚可以通过与P. aeruginosa中的3-oxo-C12-HSL竞争结合LasR受体从而减少生物被膜的形成[49]。以上研究均在一定程度上说明了QS对细菌生物被膜形成的调控作用,包括正调控和负调控。但是有关QS对食品腐败菌生物被膜形成的调控研究仍停留在表型,需要进一步挖掘其调控分子机制,为消除腐败菌生物被膜和开发新型食品保鲜剂提供新思路。
3.2 细菌c-di-GMP与生物被膜形成
细菌c-di-GMP在生物被膜形成中的作用首次在2002年由2 个团队分别提出,Boles[50]和D’Argenio[51]等分别在副溶血性弧菌(Vibrio parahaemolyticus)和P. aeruginosa中通过突变或/和过表达技术发现了影响生物被膜形成的GGDEF和EAL结构域蛋白。目前,胞内c-di-GMP浓度与生物被膜形成和细胞运动性之间的相关性已在多种细菌中被证明,如E. coli、P. aeruginosa、V. cholerae、A. hydrophila等,这些细菌也是食品中常见的致病菌,极易造成食品污染并给消费者带来不同程度的危害。细菌c-di-GMP普遍抑制细菌运动性并刺激生物被膜形成,刺激细菌黏附素和细胞外基质组分的合成,此外,参与某些致病菌急性感染的毒力基因表达被c-di-GMP下调,而慢性感染通常与高c-di-GMP水平和生物被膜形成相关[52]。本文围绕拥有典型c-di-GMP通路的E. coli、P. aeruginosa和V. cholerae展开讨论。
3.2.1 E. coli生物被膜形成机制
YhjH是E. coli的一个具有高效PDE活性的蛋白,与DGC活性蛋白YegE和YedQ共同控制E. coli整体c-di-GMP水平,主要负责调控细胞运动性[53]。在生长对数期,YhjH通过保持低水平的c-di-GMP来维持鞭毛运动性,进入稳定期后,由于YhjH的表达下调,c-di-GMP水平增加[54],使得c-di-GMP效应蛋白YcgR活化并与鞭毛马达相互作用抑制其活性[53,55]。因此,在生长的大肠杆菌细胞中,YhjH通过保持细胞c-di-GMP的浓度低于能够激活YcgR的阈值水平而在维持细胞运动性方面起着核心作用。另一个c-di-GMP调节体系由DGC活性蛋白YdaM和PDE活性蛋白YciR组成,ydaM和yciR基因缺失株严重影响csgD转录,即影响关键生物被膜形成调节因子的表达,从而影响卷曲菌毛合成而不影响细胞运动性,这与yegE和yhjH基因缺失株的表型相反[54]。研究表明,YegE/YhjH和YdaM/YciR以级联的方式运作共同决定c-di-GMP水平,YciR作为具有双功能的触发酶,其降解c-di-GMP的酶活性功能与通过互作直接抑制YdaM功能相互干涉。因此,当胞内c-di-GMP水平较高时,YciR显示PDE活性从而减轻对YdaM的抑制作用,使其能发挥DGC活性产生c-di-GMP,同时YdaM作为双功能蛋白通过与转录因子MlrA直接互作,从而促使csgD转录,影响生物被膜形成[56]。
3.2.2 P. aeruginosa生物被膜形成机制
在P. aeruginosa中,至少有5 个DGC活性蛋白可以调控细胞从可运动状态到生物被膜形成,分别为WspR、SadC、RoeA、SiaD和YfiN。相反,DGC活性蛋白GcbA和NicD以及PDE活性蛋白DipA、RbdA和NbdA与生物被膜分散有关[57]。关于DGC活性蛋白的第一个生化特征研究源自于GGDEF蛋白WspR,WspR通过调节胞外多糖的合成来控制生物被膜形成。WspR发挥作用经历3 个过程:首先,当感应到表面黏附生长时,Wsp信号转导复合物使WspR磷酸化并触发c-di-GMP的合成[58];接着,WspR磷酸化触发亚细胞WspR寡聚成簇,进一步增加了DGC的活性[59];最后,WspR的活性受到c-di-GMP的反馈抑制。除了WspR,另外一个DGC活性蛋白YfiN作为膜锚定蛋白也能促进胞外多糖pel和psl操纵子的表达[60]。在P. aeruginosa中,很多转录因子被确认为c-di-GMP受体,即能检测细胞内c-di-GMP水平,并将此信息转化,使特定细胞应答/信号转导途径激活。当胞内c-di-GMP水平较低时,FleQ作为增强子结合蛋白是鞭毛基因表达的主要激活因子[19],当c-di-GMP水平上升时,c-di-GMP与FleQ的结合将其作为参与产生胞外多糖和黏附素的pel、psl和cdr基因的阻遏物转化为激活剂,从而促进生物被膜的形成[61]。另一个响应c-di-GMP的转录因子是BrlR,BrlR可以通过上调编码多药外排泵基因的表达从而增加生物膜细胞对抗菌剂的抗性[62]。此外,BrlR对c-di-GMP的结合亲和力比FleQ要强,与FleQ相比,BrlR在较低的c-di-GMP水平和生物被膜发育过程的较早阶段发挥作用[63]。
3.2.3 V. cholerae生物被膜形成机制
在V. cholerae中,c-di-GMP主要通过抑制细胞运动并促进生物被膜基质产生来控制生物被膜的形成,总的来说,c-di-GMP随着细胞密度增加而减少。系统研究表明,缺失DGC活性蛋白CdgD(VCA0697)、CdgH(VC1067)、CdgK(VC1104)或CdgL(VC2285)可以增强其运动性[64];相反,缺失PDE活性蛋白RocS(VC0653)或CdgJ(VC0137)抑制其运动性[64-65];而缺失DGC活性蛋白CdgA(VCA0074)、CdgH、CdgK、CdgL、CdgM(VC1376)和VpvC以及PDE活性蛋白RocS、CdpA(VC0130)、CdgJ、MbaA(VC0703)、CdgC(VCA0785)和VC1851的突变株通过影响多聚糖基因vps的表达来调节生物被膜的形成[66-67]。c-di-GMP在转录水平上调控鞭毛相关基因,FlrA作为P. aeruginosa中FleQ的同源蛋白,是V. cholerae决定细胞运动性的鞭毛生物合成操纵子flrBC的转录因子,当其与c-di-GMP结合后其活性受损,从而使细胞运动性减弱[20]。另外,MshA亚基聚合形成的菌毛控制V. cholerae的表面附着能力,亚基聚合需要由ATP酶MshE提供能量,而MshE的激活需要c-di-GMP的结合,mshE或mshA基因缺失会使细菌丧失初始表面附着能力,表明c-di-GMP介导的MshA菌毛的合成是生物被膜形成的关键早期步骤[68-70]。c-di-GMP还可以通过与VpsR(VC0665)和VpsT(VCA0952)结合在转录水平上激活VPS的生物合成以及其他生物被膜基质蛋白的表达[71]。
4 细菌QS与c-di-GMP调控网络
细菌QS和c-di-GMP信号通路在细菌中具有广泛的保守性,而且在生物被膜形成、毒力因子合成以及其他相关生理过程中都发挥着关键作用,这暗示着这两条信号通路之间存在某种联系。V. cholerae作为一种食源性细菌,是研究QS和c-di-GMP的典型菌株,目前对V. cholerae中QS和c-di-GMP通路之间的调控网络研究也比较透彻,鉴于此,本文以V. cholerae为代表讨论QS和c-di-GMP通路之间的调控关系。
在V. cholerae中,QS对c-di-GMP的调控体现在多个水平。具有QS调节活性的同源(quorum regulatory,Qrr)sRNA可以直接促进编码DGC活性蛋白VCA0939的mRNA翻译,而不依赖于中心调节子HapR。Qrr sRNA对VCA0939的诱导作用与低细胞密度下更高的c-di-GMP水平相符,但VCA0939缺失株的生物被膜形成情况较野生株无明显变化,因为仅一个DGC活性蛋白的缺失并不能对一个复杂的c-di-GMP信号通路造成很大的影响[72],对于VCA0939的活性还有待进一步研究。Qrr sRNA的下游分子也能影响c-di-GMP的产生,高细胞密度时HapR的表达控制着14个GGDEF结构域蛋白/EAL结构域蛋白和4个HD-GYP结构域蛋白的转录,最终导致细胞c-di-GMP水平下降,从而使vps表达下降[73-74]。相反,hapR基因突变导致c-di-GMP水平上升,使菌落形态发生从光滑到多皱的转变[74]。低细胞密度时AphA也控制着一系列DGC活性蛋白和PDE活性蛋白的表达[75]。除了在多层面上对c-di-GMP产生的直接调控,QS和c-di-GMP信号通路能共同合作控制V. cholerae中2 个关键转录因子AphA和VpsT的表达。c-di-GMP可以通过与受体VpsR结合形成复合物从而激活aphA的转录[76],由于AphA是低细胞密度下QS的主要转录因子,而低细胞密度时c-di-GMP水平较高,因此这条通路具有实际意义。研究发现在aphA的启动子中有HapR和VpsR的重叠结合位点,而且两者的结合是相互排斥的[77],这很好地解释了aphA在低细胞密度时能被c-di-GMP激活,而在高细胞密度时被HapR抑制的情况,从而共同确保AphA在低细胞密度中的表达。与aphA类似,vpsT的表达也同时受HapR和VpsR的调控,在vpsT的启动子中发现了HapR和VpsR的重叠结合位点[74,76]。由此可知,V. cholerae整合QS和c-di-GMP两个信号通路形成调控网络,从而将多个环境信号转化成vpsT和aphA的表达。
除了V. cholerae,QS和c-di-GMP的联系在其他食源性细菌中也有相关阐述。P. aeruginosa中的酪氨酸磷酸酶(protein tyrosine phosphatase,TpbA)可以对GGDEF结构域蛋白TpbB进行去磷酸化,从而抑制其活性,减少生物被膜形成。TpbA受Las-QS系统调控,因此,QS对c-di-GMP的产生具有负调控作用[78]。在A. hydrophila中,过表达DGC活性蛋白对生物被膜形成的诱导依赖于完整的AI-2 QS系统[79],食源性细菌中QS与c-di-GMP这两个关键小分子信号分子之间的调控关系见图1,但是这2 个通路是如何互作从而影响生物表型还有待进一步研究。
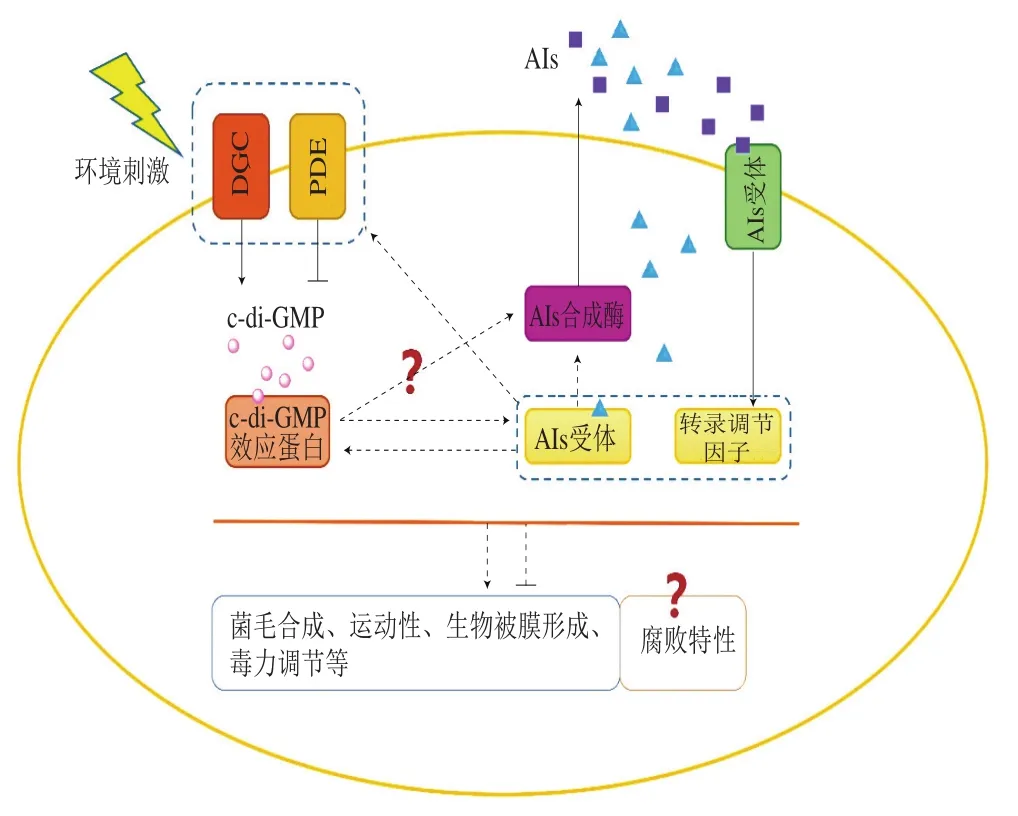
图1 食源性细菌关键小分子信号通路QS与c-di-GMP调控网络Fig.1 Regulatory network between QS and c-di-GMP signaling pathways in foodborne bacteria
5 结 语
细菌活动是引起食品品质变化与安全问题的重要原因。虽然在很多变质的食物(肉、奶、鱼、果蔬等)中检测到了QS信号分子,意味着QS在调控食品变质中发挥一定作用,但它们在食物变质中所起的确切作用目前尚不明确。对于食源性细菌中QS和c-di-GMP系统在食品腐败和生物被膜形成方面的作用及其作用机制仍需进一步研究。有研究表明,早前涉及细菌致病机制的QS系统也可能在食品腐败中发挥作用,这为研究基于QS的食品腐败提供一定的参考。对于c-di-GMP通路,在食源性腐败菌中还鲜有研究,但是在很多食品腐败菌的基因组中同样存在着编码DGC和PDE活性蛋白的基因序列,这意味着食品腐败菌的相关生理特性也可能受c-di-GMP通路调控,甚至QS与c-di-GMP通路形成调控网络共同决定腐败菌的致腐能力及生物被膜形成。了解食物生态系统中的QS和c-di-GMP通路以及两个信号通路之间的调控网络,有助于进行关键基因的靶向控制,即充分利用现有技术不断发现或合成QS及c-di-GMP调控剂,从而高效特异地抑制目标食源性细菌的致腐和致病能力,解决食物品质与安全问题。
