基于不同识别元件的表面等离子体共振技术在食品安全检测中的研究进展
2018-12-29颜朦朦佘永新洪思慧曹晓林王猛强王珊珊郑鹭飞金茂俊刘海金
颜朦朦,佘永新,*,洪思慧,张 超,曹晓林,王猛强,王珊珊,郑鹭飞,金茂俊,邵 华,金 芬,刘海金,王 静,*
(1.中国农业科学院农业质量标准与检测技术研究所,北京 100081;2.西藏自治区农畜产品质量安全检验检测中心,西藏 拉萨 850009)
随着社会的发展、科技的进步,食品安全问题越来越受到重视,其安全因素(农药、兽药、生物毒素、微生物等)[1-2]引发的安全事件屡见不鲜;因此为保证食品安全并满足人们的需求就必须进行监管监测,多种检测方法已得到应用,如气相色谱-质谱联用技术[3-4]、高效液相色谱[5]、液相色谱-质谱联用技术[6]等仪器检测法,这些技术虽然灵敏且精确,但是花费时间长、需要专业的培训以及昂贵的仪器。其中也包括相对简单快捷的检测技术,如免疫学方法(酶联免疫反应分析技术[7]等),但其使用的生物材料都比较昂贵,并且需要繁琐的洗涤步骤,耗费大量试剂,对环境造成污染。因此,一种简单、快速、准确的检测技术需要应用到食品安全检测中。
表面等离子体共振(surface plasmon resonance,SPR)技术是利用金属薄膜光学耦合产生的物理光学现象检测物质的技术,自1902年由Wood发现,至今已有100多年的历史。其具体原理如下:当一束偏振光在一定的角度范围内入射到棱镜端面,在棱镜与金属薄膜(Au或Ag)的界面将产生表面等离子波,当入射光的传播常数与表面等离子波的传播常数相匹配时,引起金属膜内自由电子产生共振,即SPR[8]。分析时,先在传感芯片表面固定一层生物分子识别膜,然后将待测样品流过芯片表面,若样品中有能够与芯片表面的生物分子识别膜相互作用的分子,会引起金属表面折射率变化,最终导致SPR角度的变化,通过检测SPR角度变化,获得被分析物的浓度、亲和力、动力学常数和特异性等信息。SPR技术具有灵敏度高、操作简单、能够实时监测反应的动态过程,只需对样品进行简单的预处理,无需标记,耗样量少,检测时间短等[9-11]优点,已被广泛应用于各个研究领域,如生命科学[12-13]、医药学[14-15]、环境监测[16-17]等,并逐渐应用到食品安全[18-19]检测中。其中SPR传感器中的分子识别元件是其重要组成部分,它决定检测方法的特异性,本文主要从不同种类的识别元件技术简要综述近10 年来SPR传感器技术在食品安全检测中的应用。
1 识别元件
1.1 抗体
利用抗体作为识别分子检测农药是目前世界上应用最广、最普遍的检测方法。随着科技的发展,此识别分子更广泛地应用到农药的检测,并且其检测限不断降低,检测范围不断增大,本文总结了近几年的研究文献(表1),其传统的检测方法主要包括竞争法、直接法及夹心法。
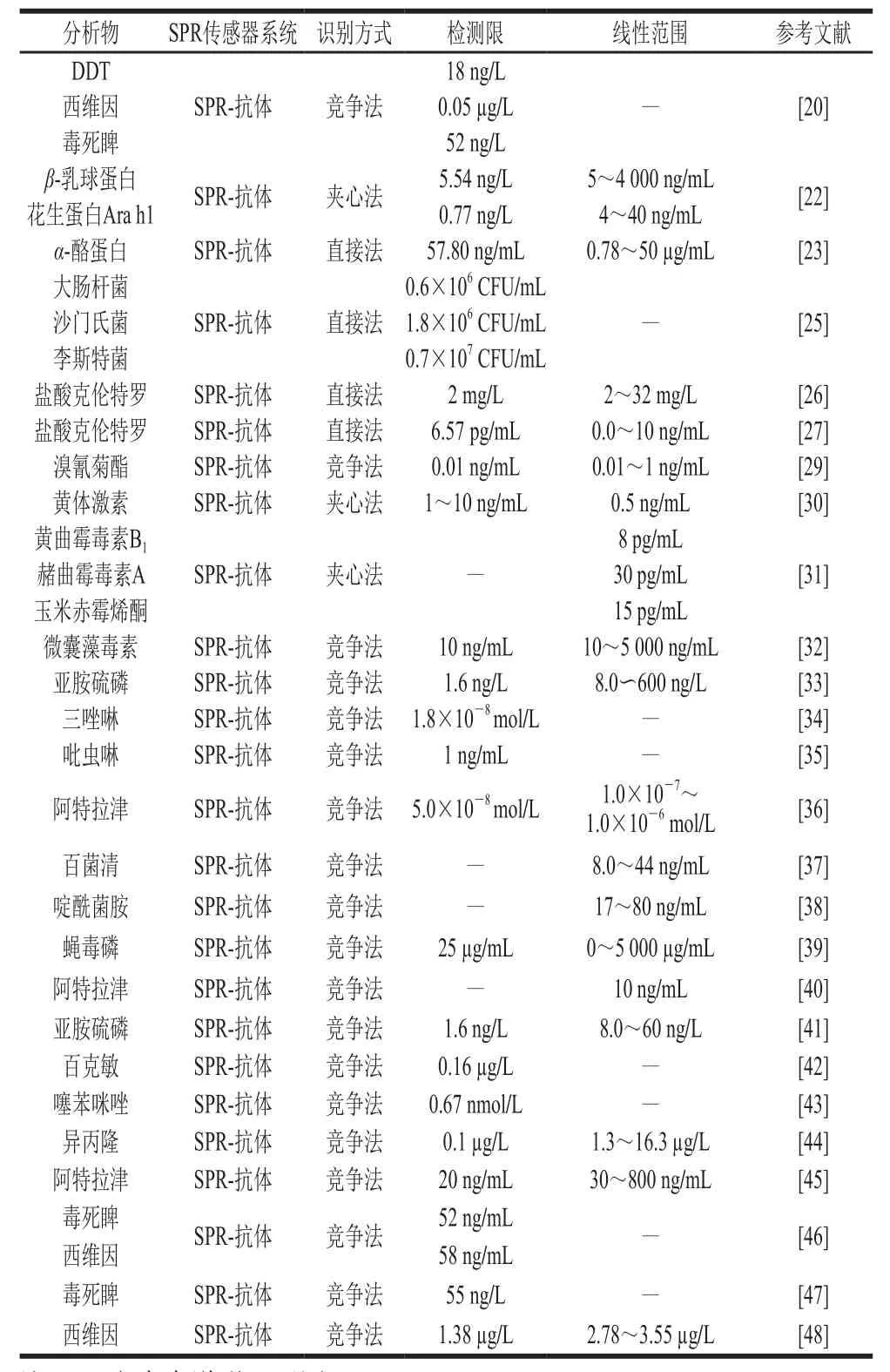
表1 基于抗体识别元件的SPR传感器在农产品检测中的应用Table1 Applications of SPR sensors based on antibody recognition elements in agricultural product detection
竞争法是指先在SPR传感器芯片上固定半抗原-蛋白复合物,然后加入靶标及固定浓度的抗体混合液,竞争法是半抗原与靶标同时竞争抗体的方法,当靶标浓度升高时,金属表面的抗原-抗体浓度就减小,SPR响应信号强度相应减小,靶标浓度与SPR信号强度成反比,是农药检测中最常用的方法(图1)。如2007年Mauriz等[20]利用竞争法同时检测双对氯苯基三氯乙烷(dichlorodiphenyltrichloroethane,DDT)、西维因、毒死睥3 种农药,并且都能达到较低检测限,分别为18 ng/L、0.05 µg/L、52 ng/L。夹心法是将抗体首先固定在芯片表面,然后加入抗原,与抗体结合,然后再加入二抗,以增加SPR的响应信号强度,靶标浓度与SPR信号强度成正比,此方法在农药检测中的应用较少。在2001年Shimomura等[21]利用夹心法进行了阿特拉津的检测,在5 ng/mL的阿特拉津样品中检测到信号放大比率为1.9(图2);类似的,Wu Xuli等[22]通过SPR分别以5.54 ng/mL和0.77 ng/mL的检测限同时检测牛奶和花生中过敏原:β-乳球蛋白及花生蛋白Ara h1。Ashley等[23]采用了由4 个感测阵列组成的SPR传感器芯片,传感器芯片使用EDC/NHS偶联方法固定α-酪蛋白多克隆抗体。首先优化和测定传感器的性能,并在纯缓冲液条件下进行表征,得到作为直接结合测定的检测限为58 ng/mL。通过使用夹心测定形式并用纳米颗粒信号增强,应该可以进一步提高测定灵敏度,但是在此传感器上并没有达到增加灵敏度的效果。传感器表现出对α-酪蛋白的良好选择性,并且获得了足够的回收率。直接检测法主要应用在大分子上,Yakes等[24]在SPR芯片上固定单克隆抗体,其检测通道分为单通道及多通道(可以同时检测96 个样品),并且与成熟的酶联免疫检测方法相比较,3 种方法同时检测贝类组织的多糖酸,多通道原型仪器于2 h内完成,单通道为12 h,酶联免疫吸附测定(enzyme-linked immunosorbent assay,ELISA)为24 h以上,很好地提高了工作效率。类似的,Zhang Xiaoguang等[25]通过直接固定抗体在芯片上实现了对大肠杆菌、沙门氏菌和李斯特菌的同时检测。为了实现现场快速检测,Pan Qi等[26]构建了便携式扫描SPR生物传感器,用于食品的安全检测,并用瘦肉精作为样品,该方法和装置的有效性通过了实验证明。
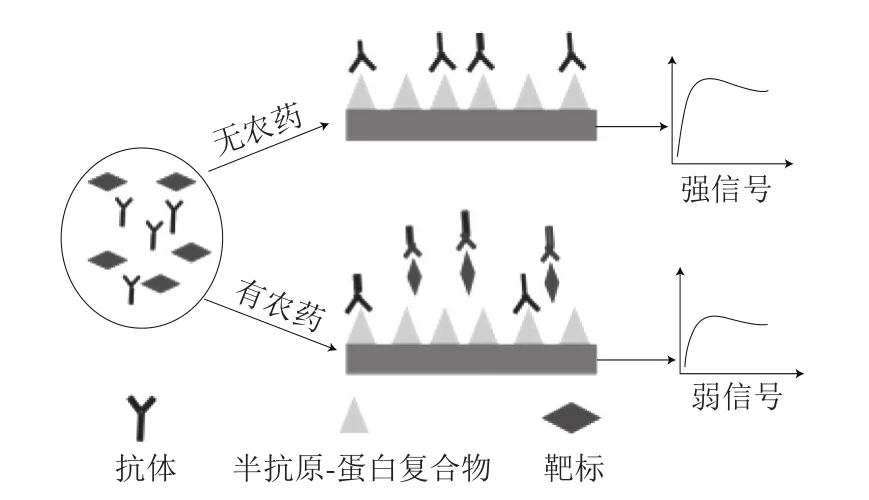
图1 竞争法简易原理图Fig.1 Schematic diagram of the competitive method
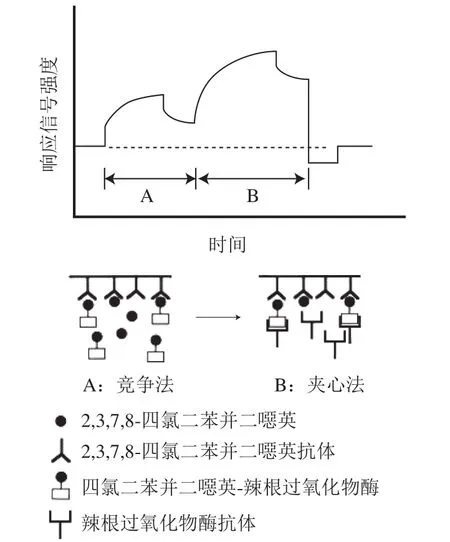
图2 夹心法简易原理图[21]Fig.2 Schematic diagram of the sandwich method[21]
随着纳米材料的发展,其也应用到SPR传感器中,它可以有效地增强SPR响应信号,提高对靶标检测的灵敏度。Yan Fufeng等[27]通过羧基改性石墨烯,实现了盐酸克伦特罗的高灵敏度检测。首先将山羊抗小鼠抗体与1-十八烷硫醇(1-octadecanethiol,OTD)改性的羧基-石墨烯缀合,然后通过自组装沉积在OTD改性的金表面上,原理如图3所示。为了了解这3 种方法的优劣,Charlermroj等[28]以瓜氨酸为模型,并且将羧甲基化传感器芯片C1及羧甲基化葡聚糖芯片CM5进行了比较,结果表明C1BI C5有更好的灵敏度,同时,直接检测法表现出最佳的灵敏度,最后对西瓜进行了实际样品分析,得到较好的回收率。Liu Xia等[29]将Fe3O4磁性纳米粒子固定在芯片表面并且其表面用羧基基团进行修饰,以利于纳米粒子与靶标抗体的结合,然后引入靶标,靶标结合到纳米粒子表面的抗体上,此时由于纳米粒子的存在,SPR信号在同种靶标浓度下的信号将会增强,从而达到提高检测限的目的,利用该技术对溴氰菊酯进行了检测,检测限可以达到0.01 ng/mL。另外此带有抗体的磁性纳米粒子还可以对含有溴氰菊酯复杂的农产品或食品样品进行靶标的纯化与富集,从而提高检测的精确度。2017年,Daems等[30]首次使用自动光纤(fiber optic,FO)-SPR生物传感器,在复杂生物样品中量化小分子(如黄体激素)。其原理如图4所示,从FO-SPR生物传感器(A)开始,通过活化的羧基将孕酮-牛血清白蛋白(P4-bovine serum albumin,P4-BSA)共价固定在具有羧基的金涂层纤维的表面上(B),溶液中的游离P4和FO-SPR传感器上固定的P4-BSA竞争检测抗体(抗P4)。该信号由用山羊抗小鼠抗体功能化的Au纳米颗粒(nanoparticle,NP)增强。此外,开发的生物测定法与商业化ELISA法比较,显示出良好的一致性。利用相同原理,Hu Weihua等[31]实现了对黄曲霉毒素B1、赭曲霉毒素A和玉米赤霉烯酮3 种典型霉菌毒素的高度特异性和灵敏度同时检测,检测限分别为8、30、15 pg/mL。
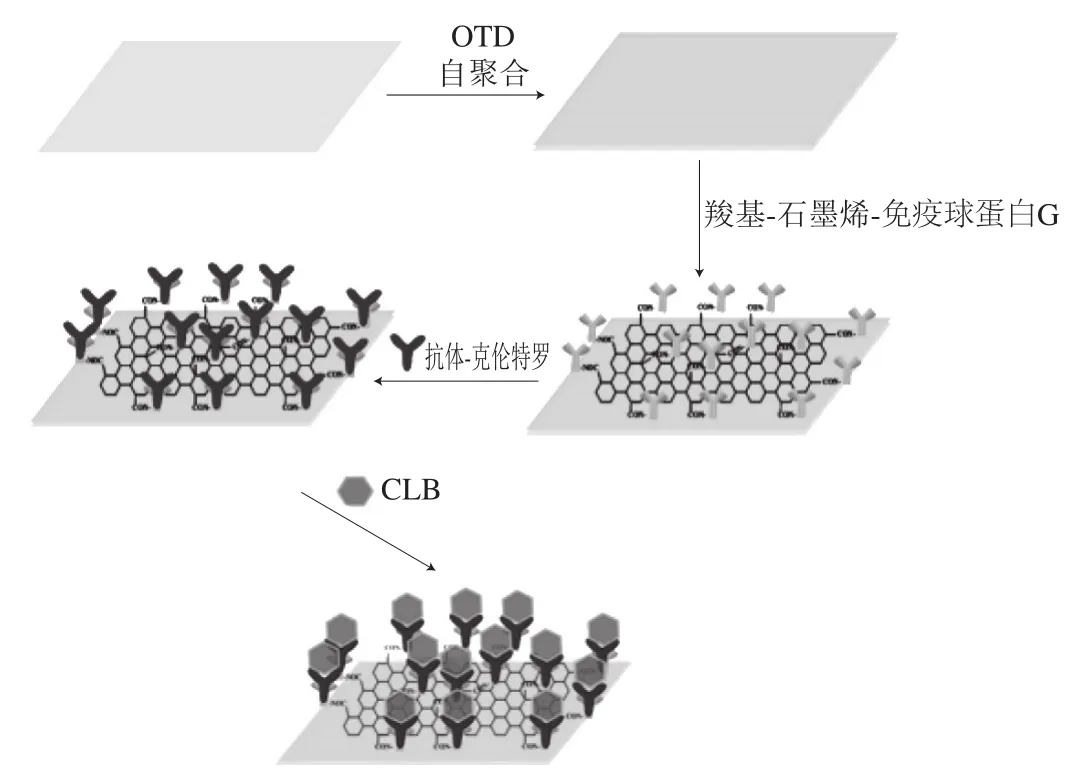
图3 基于功能化石墨烯的SPR芯片简易图[27]Fig.3 Schematic diagram of SPR chip based on functionalized grapheme[27]
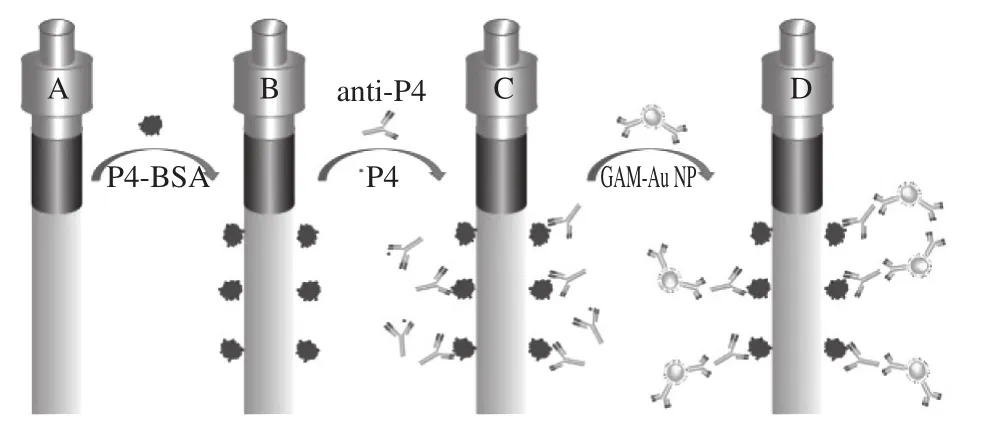
图4 FO-SPR生物测定的概述图[30]Fig.4 Schematic diagram of FO-SPR[30]
1.2 适配体
适配体(aptamer,Apt)是具有30~40 个核碱基的短寡核苷酸(RNA或单链DNA(ssDNA)),不需要动物或细胞培养,具有靶标-寡核苷酸的结合特异性。适配体对其靶标具有高亲和力,其解离常数(Kd)在nmol~pmol范围[49]。此外,通常适配体折叠成独特的三维结构,其允许特异性结合靶向分析物,因此适配体通过互补形式而不是其序列与靶标相互作用。适配体具有许多优点,例如它们具有很好的热稳定性并可重复使用,并且它们可以容易地通过引入功能分子(例如荧光团或酶)和官能团而被修饰[50]。这种化学修饰可以增强目标分析物的稳定性、亲和性、特异性和功能性。此外,其具有优于抗体的多功能性和避免动物在其生产中使用的特点,并且还具有较高的受体表面密度。因此,适配体在生物传感器中作为识别元件已得到广泛的应用。使用者可以结合各种目标分析物,如毒素[51]、抗生素[52]和生物标志物[53]等,近年来基于适配体的SPR传感器在食品安全检测中也逐渐被应用(表2)。2015年,Zhu Zhiling等[54]报道了基于适配体的SPR传感器,将其用于赭曲霉毒素A的快速、准确、高灵敏度检测,将链霉亲和素作为交联剂固定在传感器芯片的表面上,并通过链霉亲和素-生物素相互作用捕获生物素适配体,然后适配体捕获靶标分子,从而达到检测的目的,该传感器的检测范围为0.094~100.000 ng/mL,检测限为0.005 ng/mL,通过简单的液-液萃取样品前处理方式检测葡萄酒和花生油中的赭曲霉毒素A,添加回收率为86.9%~116.5%,变异系数为0.2%~6.9%。同理,Janardhanan等[55]用RNA适配体进行肉毒杆菌神经毒素的检测,使用解毒重组型A型肉毒杆菌神经毒素作为替代物,用适配体传感器在90 min内检测活性毒素,磷酸盐缓冲液、胡萝卜汁和无脂牛奶中的检测限分别为5.8、20.3 ng/mL和23.4 ng/mL,5 倍稀释的人血清中的检测限为22.5 ng/mL。为了提高检测灵敏度,Lei Pinhua等[56]将改进的不对称聚合酶链反应(polymerase chain reaction,PCR)技术整合到SPR传感器芯片的表面中,其原理如图5所示,首先用硫醇化探针对传感器的金膜进行修饰,然后诱导靶序列和信号放大单元的链霉亲和素适配体形成夹层结构,如果添加沙门氏菌,则SA适配体与SA形成复合物,然后通过PCR技术实现信号放大,从而达到提高检测灵敏度的目的。与以上原理不同的是,Tran等[57]利用胶体金颗粒实现信号放大(图6),首先将所选择的适配体固定在芯片上。然后,将FO-SPR传感器浸入具有多克隆二抗的缓冲液中,形成三明治夹心结构。在这些抗体与花生过敏原Ara h1蛋白结合后,将FO-SPR探针浸入含有被蛋白A修饰的Au NPs的溶液中,蛋白A是对抗体的FC部分具有高亲和力,在该测定中应用Au NPs以进一步增强信号。

表2 基于适配体识别元件的SPR传感器在农产品检测中的应用Table2 Applications of SPR sensors based on aptamer recognition elements in agricultural product detection
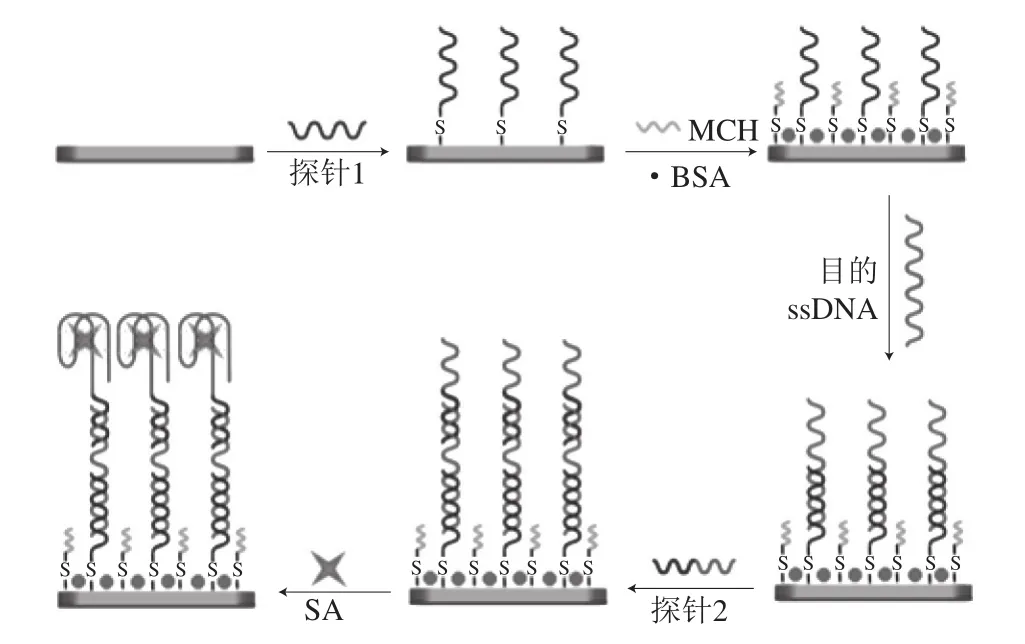
图5 基于PCR信号放大的SPR原理示意图[56]Fig.5 Schematic diagram of signal amplification of SPR based on PCR[56]
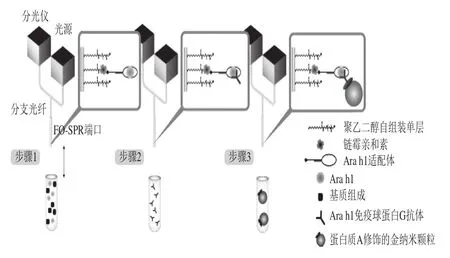
图6 基于AuNPs信号放大的SPR原理示意图[57]Fig.6 Schematic diagram of signal amplification of SPR based on AuNPs[57]
1.3 分子印迹聚合物
分子印迹聚合物(molecular imprinting polymer,MIP)是以目标分子为模板分子(原子、离子、分子、复合物、大分子以及微生物等),将具有结构上互补的功能化聚合物单体通过某种作用力(非共价作用、电子或离子作用、共价作用以及金属配位作用等)与模板分子结合,并加入交联剂进行聚合反应,反应完成后将模板分子洗脱出来,形成的一种具有固定空穴大小、形状及有确定排列功能团的交联高聚物(图7)[58]。分子印迹聚合物是通过体外化学合成的,具有结构可预测性、高度的专一性、较好的稳定性及可重复性[59-60]。分子印迹聚合物已广泛应用于固相萃取技术、色谱技术及传感器检测技术。在检测技术方面,可用于多种领域靶标分子的检测[61-63],如医药、临床诊断、食品安全与环境监测领域。关于分子印迹聚合物在SPR检测方法中作为识别分子对农药检测的研究已经逐步发展,由于分子印迹聚合物的高度专一性及SPR技术的快速反应性、高度敏感性及无需标记性,得到不错的研究成果,如表3所示。2016年Shrivastav等[64]报道了一种基于光纤维及生物分子印迹聚合物的SPR生物传感器,并成功应用于丙溴磷的检测,其检测限(limit of detection,LOD)可达到2.5×10-6µg/L,检测范围为10-4~10-1µg/L,其原理是:首先将银镀在多模光纤上,然后在银膜表层涂上针对丙溴磷的分子印迹聚合物,当丙溴磷引入时,可与分子印迹聚合物结合,并改变其折射率,SPR可以快速准确地捕捉到这种变化,随着靶标浓度的不同,其折射率变化不同,从而达到不同浓度靶标物质的检测(图8)。利用相同原理,Atar[65]及Shaikh[66]等分别选用不同的单体及交联剂对柠檬酸及双酚A进行了检测。用分子印迹聚合物作为识别元件还可以实现多个靶标同时检测,如2017年Saylan等[67]首先将N-甲基丙烯酰基-1-苯丙氨酸甲酯单体与氰嗪、西马嗪、及莠去津进行化学反应,然后再加入单体(1-乙烯基咪唑)、交联剂(乙二醇二甲基醚)进行2 h预聚合,最后加入N,N’-偶氮二异丁腈引发剂在SPR芯片上进行印迹聚合物的合成,此聚合物可以同时识别这3 种农药,并且经检测得到较低的检测限,分别为0.095、0.031、0.091 nmol/L。为了增强信号,Shrivastav等[68]将10~30 nm的银纳米颗粒引入印迹膜中,其灵敏度比未添加银纳米颗粒的传感器提高了2 倍。不同的是Verma等[69]首先在光纤维的表面涂抹一层银金属膜,然后在其表层制备四环素的分子印迹膜,从而得到高选择性的光纤传感器。Kara等[70]用微乳液两相聚合方法制得氯霉素分子印迹膜,通过SPR对其检测,检测限低至40 ng/kg。
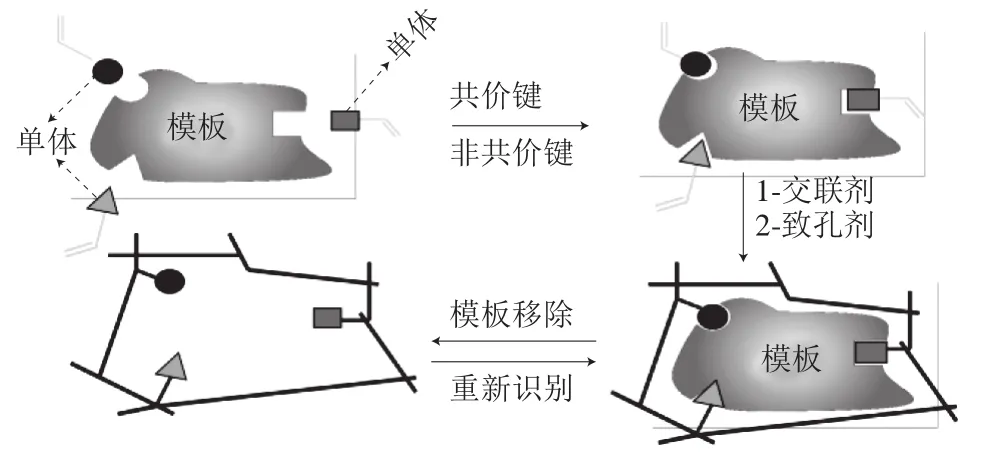
图7 分子印迹聚合物制备过程简易原理图[58]Fig.7 Schematic diagram of MIP preparation process[58]

图8 基于MIP的SPR装置示意图[64]Fig.8 Schematic diagram of SPR device based on MIP[64]

表3 基于分子印迹聚合物识别元件的SPR传感器在食品检测中的应用Table3 Application of SPR sensors based on MIP recognition elements in agricultural product detection
1.4 蛋白质
凝集素是动植物蛋白质或糖蛋白,其可以选择性地结合细菌细胞表面主要结构成分的多糖结构,Wang Yixian等[77]用凝集素作为SPR的识别元件对大肠杆菌的进行了检测,通过自组装单层将凝集素固定在SPR芯片上,在缓冲溶液中捕获大肠杆菌O157:H7,原理如图9所示,并从5 种不同植物中筛选对大肠杆菌选择性较高的凝集素,成功用于黄瓜和碎牛肉样品中细菌的检测。与上述不同的是,Olguín等[78]利用Toll样受体5可以特异性识别鞭毛蛋白(细菌鞭毛的结构蛋白)的特性来检测大肠杆菌及鼠伤寒沙门氏菌,这项研究证明了蛋白脂质体作为识别元件用于快速检测鞭毛细菌的实际可能性,这可以帮助人类避免食用被污染的食物,从而防止肠道感染。用蛋白质作为识别元件还可以来检测重金属,如Raz等[79]用金属硫蛋白来检测银离子,取得不错的结果。
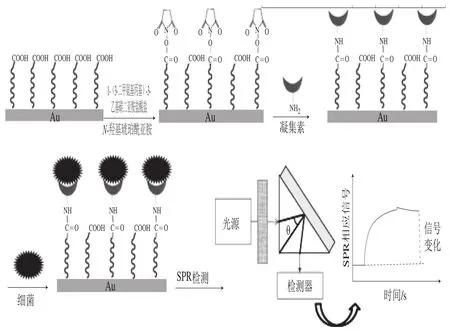
图9 用于大肠杆菌O157:H7检测的凝集素-SPR传感器原理图[77]Fig.9 Lectin-SPR sensors for the detection of Escherichia coli O157:H7[77]
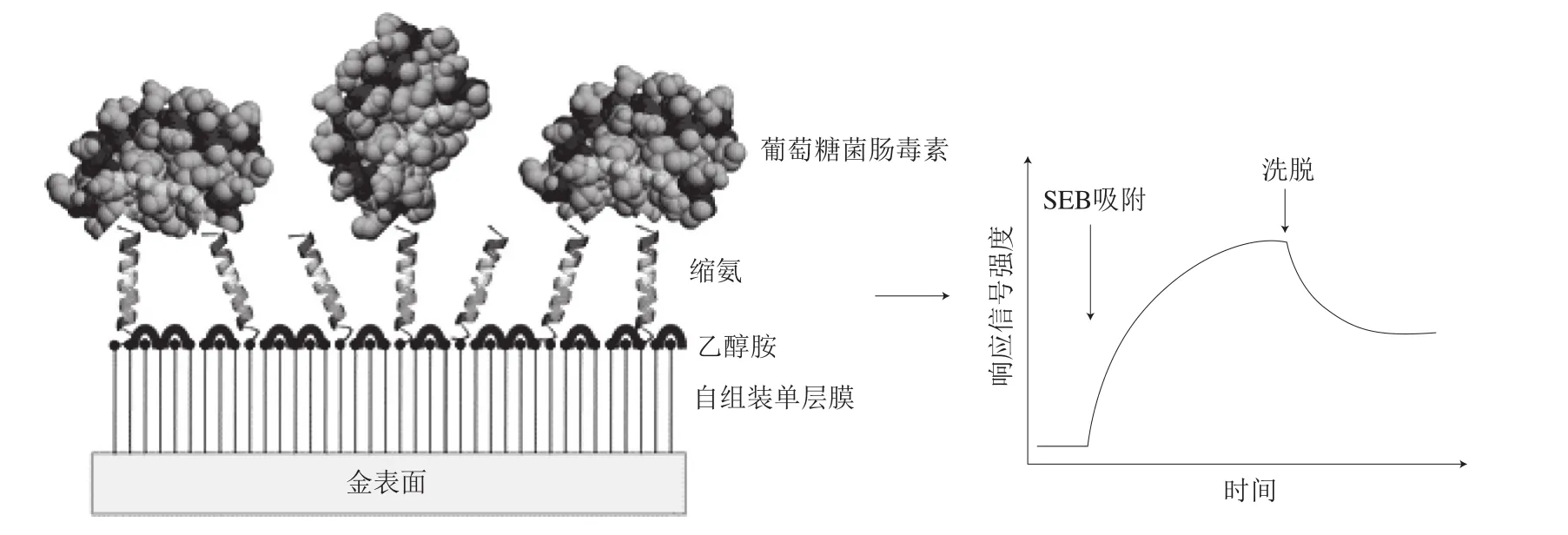
图10 用于检测SEB的基于肽的SPR传感器示意图[81]Fig.10 A peptide-based SPR sensor for the detection of SEB[81]
1.5 肽
肽作为大分子的一类也可以用来作为SPR的识别元件,如Ding Xiaokang等[80]在2012年通过噬菌体展示技术文库筛选出两段寡肽片段,分别与噻虫啉及吡虫啉具有亲和性,于是将寡肽作为识别分子应用到SPR技术中,对噻虫啉及吡虫啉进行检测,检测限可分别达到1.2 µmol/L和0.9 µmol/L,虽然检测灵敏度较低,但是为农药检测的分子识别选择提供了新的思路。2014年,Dudak等[81]用从噬菌体展示文库中得到的24-mer肽来识别检测葡萄球菌肠毒素B,并成功在牛奶样品中进行了测试,进一步证明了肽作为SPR识别元件的可能性(图10)。
1.6 酶
有机磷与氨基甲酸酯类农药是乙酰胆碱酯酶(acetyl cholinesterase,AChE)的抑制剂,此两类农药可以与AChE上的活性位点丝氨酸残基形成共价键结合,从而抑制AChE的活性,因此可以将AChE作为SPR传感器上的识别分子进行农药的检测,近年来在这方面的研究并不多(表4),可能是由于其较低的专一性所致。Kumar等[82]利用此原理同时检测了马拉硫磷及敌百虫,此研究的特殊之处是引入了纳米银离子并且将其固定在玻璃板上,解决了胶体银影响纳米粒子在水相中聚集及污染水源的问题,而且有效提高了传感器的检测灵敏度,达到0.455 nmol/L和5.46 nmol/L。Lin等[83]在检测对氧磷时也引入了金属纳米粒子来提高灵敏度,达到0.234 ng/mL。

表4 基于乙酰胆碱酯酶识别元件的SPR传感器在食品检测中的应用Table4 Applications of SPR Sensors based on acetyl cholinesterase recognition elements in agricultural product detection
2 结 语
SPR传感器应用于食品安全检测已取得了较好的进展,为了增加其应用,还应做到以下几点:1)增加与纳米技术的联用,提高对小分子物质的检测灵敏度;2)发展有效的可再生SPR芯片,降低实验成本;3)开发多通道、多组分识别SPR传感器,如与微流控技术相结合,实现高通量复合检测;4)降低仪器成本,使仪器便携化、小型化。
