外源乙烯对采后杏鲍菇内源乙烯释放和衰老进程的影响
2018-12-29黎春红张雷刚罗淑芬周宏胜胡花丽李鹏霞
黎春红,张雷刚,罗淑芬,周宏胜,胡花丽,李鹏霞,3,*
(1.沈阳农业大学食品学院,辽宁 沈阳 110866;2.江苏省农业科学院农产品加工研究所,江苏 南京 210014;3.江苏省高效园艺作物遗传改良重点实验室,江苏 南京 210014)
杏鲍菇(Pleurotus eryngii)又名刺芹侧耳,其菌肉肥厚、味道鲜美、氨基酸种类齐全[1],是一种理想的保健食品[2],经常食用具有预防心血管疾病、抗氧化[3]、增强机体免疫力[4]等功效。近年来,随着市场需求的不断增加,工厂化栽培技术的逐步推广,杏鲍菇产量大幅增加[5]。但由于杏鲍菇含水量高,采后生理代谢旺盛,因此其在常温下不耐贮藏,易出现失水软化、组织褐变、变黏发臭、细菌或病毒感染而腐烂、自溶等品质衰败现象[6],从而丧失营养价值和商品性,给杏鲍菇产业带来了较大的经济损失。杏鲍菇采后品质的下降受到多方面因素的影响,而采后继续发育及衰老是导致其采后品质降低的重要因素[7]。
乙烯是五大类植物激素之一,在果蔬成熟衰老过程中发挥重要作用。乙烯作为成熟衰老的关键调控因子,不仅在桃[8]、苹果[9]、猕猴桃[10]等呼吸跃变型果实的成熟衰老中起核心调控作用,而且直接调控诸多高经济价值的非跃变型果蔬的品质变化过程[11]。人为促进或抑制采后果蔬内源乙烯的生成,可加速或延缓果蔬后熟进程,且在食用菌中可能也发挥着类似于果蔬中的调控作用[12]。王秀艳等[13]研究发现在鸡腿菇液体培养中施用乙烯利,能有效地促进鸡腿菇菌丝的生长,显著提高菌丝体干质量;孟德梅[14]在研究双孢菇时,同样发现乙烯利能显著加剧其开伞程度并诱导乙烯释放量的增加,加速双孢菇采后衰老进程;陈彦等[15]研究指出,凤尾菇乙烯释放量与其褐变度呈正相关,且释放的乙烯能加速菇体的腐败衰老。目前已发现多种细菌和真菌均能够产生乙烯,其合成途径与高等植物不同,不是由甲硫氨酸经1-氨基环丙烷1-羧酸途径产生,而是由甲硫氨酸经2-酮-4甲基硫代丁酸途径或由谷氨酸经酮戊二酸途径产生[16]。但杏鲍菇子实体中的乙烯释放规律及其对乙烯的敏感性至今鲜见系统的研究报道。因此,本实验以杏鲍菇为试材,采用外源乙烯气体处理的方法,通过检测子实体采后贮藏期间乙烯释放量及贮藏品质,探讨杏鲍菇子实体对乙烯的敏感性,不仅能深入了解杏鲍菇的成熟衰老机理,为调控杏鲍菇采后品质提供理论依据,还可用于指导生产实践,具有一定的应用价值。
1 材料与方法
1.1 材料与试剂
新鲜杏鲍菇采自江苏省兴化食用菌公司。采后2 h内运回实验室,挑选大小均匀、菇体完整者作为实验材料。
磷酸氢二钠、磷酸二氢钠、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、聚乙二醇辛基苯基醚(polyethylene glycol octylphenol ether,Triton X-100)、聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVP)、邻苯二酚、硼酸、硼砂、盐酸、无水乙醇、甲醇、浓硫酸、蒽酮、乙酸乙酯、过氧化氢 国药集团化学试剂有限公司;愈创木酚、甲硫氨酸、氮蓝四唑、核黄素、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、L-苯丙氨酸、抗坏血酸(ascorbic acid,ASA)、蔗糖、考马斯亮蓝G-250、牛血清白蛋白 北京索莱宝科技有限公司。
1.2 仪器与设备
M603Di型电子天平 意大利Bel公司;PHSJ-3F型pH计 上海雷磁新泾仪器有限公司;3K15型高速台式冷冻离心机 德国Sigma公司;HH-S系列数显恒温水浴锅 常州万达升实验仪器有限公司;ZQTY-70型振荡培养箱 上海知楚仪器有限公司;Technologies 7280A气相色谱仪 美国Agilent公司;PD-501型便携式多功能测量仪 瑞士Mettler Toledo公司;Epoch酶标仪 美国BioTek公司。
1.3 方法
1.3.1 原料处理
将供试杏鲍菇子实体密闭于21 L乐扣箱,每箱20 个杏鲍菇,共分为5 组处理,每个处理设置3 组重复,向乐扣箱内注入折算好体积的纯乙烯气体,第1、2、3、4组加入的乙烯剂量分别为1、10、100、1 000 μL/L,第5组为空气对照(CK),密闭时间均为12 h,然后取出在空气中通风2 h,最后分别置于带孔的21 L乐扣箱,于(20±1)℃、相对湿度70%~80%的环境中贮藏,每隔12 h测定各处理组子实体的乙烯释放量。至贮藏结束从各处理随机取10 个杏鲍菇,分别保留菇柄及菇伞部位,用于各项指标的测定,其中相对电导率采用同期鲜样进行测定。
1.3.2 指标测定
1.3.2.1 乙烯释放量的测定
从各处理随机取10 个杏鲍菇子实体密闭于4.5 L乐扣盒1 h后取气,用气相色谱仪检测乙烯释放量。色谱条件:Porapak Q 80/100 SS色谱填充柱,氢火焰离子化检测器,柱温、进样口和检测室温度分别为70、120、150 ℃,N2压力0.5 MPa,H2压力0.3 MPa,空气压力0.5 MPa,以外标法定量,单位为μL/(kg·h),每个样品重复测定3 次。
1.3.2.2 褐变度及PPO、PAL活力的测定
褐变度的测定参考Jiang Juan等[17]的方法。
多酚氧化酶(polyphenol oxidase,PPO)活力的测定参考Mohamed等[18]的方法,略有改动。称取3 g样品研磨后加入6 mL 50 mmol/L磷酸盐缓冲液(pH 7.8,含0.1 mmol/L EDTA、体积分数0.3% Triton X-100和4% PVP),匀浆,4 ℃ 10 000 r/min离心20 min,得到的上清液即为酶提取液。3 mL 0.1 mol/L邻苯二酚溶液于30 ℃水浴保温后,迅速加入酶提取液300 µL,保证反应温度为30 ℃,5 s后于398 nm波长处测定吸光度,以1 min内吸光度上升0.01为1 个PPO活力单位。
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活力测定参考Chen Yu等[19]的方法,略有改动。称取2 g样品研磨后加入5 mL 10 mmol/L硼酸缓冲液(pH 8.8,含0.1 mmol/L EDTA、体积分数0.3% Triton X-100和体积分数4% PVP),匀浆,4 ℃ 10 000 r/min离心20 min,得到的上清液即为酶提取液。反应体系包括1 mL 0.02 mol/L L-苯丙氨酸、2 mL 0.1 mol/L硼酸缓冲液(pH 8.8)、1 mL稀释10 倍的酶提取液,摇匀后于30 ℃水浴保温反应60 min,加入0.2 mL 6 mol/L HCl溶液终止反应,于290 nm波长处测定吸光度,以每小时吸光度增加0.01为1 个PAL活力单位。
1.3.2.3 相对电导率、MDA含量的测定
相对电导率的测定参考Jiang Juan等[17]的方法。
丙二醛(malondialdehyde,MDA)含量的测定参考刘红艳等[20]的方法。
1.3.2.4 抗氧化酶活力的测定
抗氧化酶活力的测定参考Mohamed等[18]的方法。测定体系中酶提取液同1.3.2.2节中PPO活力测定的酶提取液。
抗坏血酸过氧化物酶(ascorbate peroxidase,APX)活力的测定体系含有2 mL 50 mmol/L磷酸盐缓冲液(pH 7.0)、1 mL 2 mmol/L H2O2、0.6 mL 0.5 mmol/L ASA、100 µL酶提取液,于290 nm波长处测定吸光度,以1 min内吸光度减少0.01为1 个APX活力单位。
过氧化氢酶(catalase,CAT)活力的测定:取300 µL酶提取液和2 mL 0.05 mol/L磷酸盐缓冲液(pH 7.0)于25 ℃水浴下预热5 min,加入1 mL、体积分数0.2% H2O2溶液,立即于240 nm波长处测定吸光度,以1 min内吸光度减少0.01为1 个CAT活力单位。
过氧化物酶(peroxidase,POD)活力的测定:将200 µL酶提取液加入2 mL 0.05 mol/L愈创木酚中,30 ℃水浴中平衡5 min,然后加入1 mL、体积分数0.2% H2O2溶液,混匀,1 min后于470 nm波长处测定吸光度,以1 min内吸光度减少0.01为1 个POD活力单位。
超氧化物歧化酶(superoxide dismutase,SOD)活力的测定体系含有130 mmol/L甲硫氨酸、750 µmol/L氮蓝四唑、20 µmol/L核黄素、100 µmol/L EDTA、酶提取液100 µL。混匀后,将对照管完全遮光,与样品管同时置于光照培养箱内反应20 min。反应结束后,用黑布罩盖上试管终止反应。以遮光的对照管作为空白调零,于560 nm波长处测定吸光度,以1 min内吸光度减少0.01个单位为1 个SOD活力单位。
1.3.2.5 DPPH自由基清除率的测定
DPPH自由基清除率的测定参考刘红艳等[20]的方法。
1.3.2.6 总抗氧化能力的测定
总抗氧化能力的测定参考赵慧芳等[21]的方法,略有改动。称取2 g样品,加入8 mL无水乙醇,研磨匀浆,4 000 r/min离心10 min,分别取上清液50、100、200、400 μL,无水乙醇稀释定容至1 mL,作为反应样液;准确称取25 mg DPPH,用无水乙醇溶解并定容至50 mL,制成质量浓度为0.5 mg/mL的DPPH溶液,定量移取反应样液的各梯度稀释液与一定量的DPPH溶液于96 孔酶标板,测定不同质量浓度样品液的DPPH自由基清除率曲线。利用回归方程求得清除率为50%时所需样品浓度为半数有效浓度(the median effective concentration,EC50),根据式(1)计算此时对应清除的DPPH自由基量,根据式(2)计算总抗氧化能力。

1.3.2.7 总酚、类黄酮含量的测定
总酚、类黄酮含量测定参考曹建康等[22]的方法,并略有改动。称取1 g样品,加入20 mL预冷的体积分数1%盐酸-甲醇溶液,匀浆后于4 ℃ 120 r/min避光提取2 h,于4 ℃ 10 000 r/min离心15 min,收集上清液。以体积分数1%盐酸-甲醇溶液调零,取上清液分别于280、325 nm波长处测定吸光度,重复3 次。以每克样品在280、325 nm波长处的吸光度分别表示总酚、类黄酮含量。
1.3.2.8 可溶性糖含量的测定
可溶性糖含量采用蒽酮比色法测定。称取1 g样品,加入5 mL蒸馏水,匀浆后置于沸水浴浸提30 min(提取2 次),提取液过滤入25 mL容量瓶中,以蒸馏水定容,混匀后吸取1 mL,加入0.5 mL蒽酮乙酸乙酯试剂和5 mL浓硫酸,充分振荡,立即将试管置于沸水浴中,准确保温1 min,取出冷却至室温,以蒸馏水做空白参比,于630 nm波长处测定吸光度。采用标准蔗糖溶液依上述过程制作标准曲线,对照标准曲线计算样品可溶性糖含量。
1.3.2.9 可溶性蛋白含量的测定
可溶性蛋白含量采用考马斯亮蓝G-250染色法测定。取3 支试管,各加入1.3.2.4节中的酶提取液100 µL、考马斯亮蓝G-250溶液5 mL及蒸馏水0.9 mL,混匀,室温下静置5 min,于595 nm波长处测定吸光度。采用牛血清白蛋白作标准曲线,对照标准曲线计算样品可溶性蛋白含量。
1.4 数据统计
实验均测定3 个平行样品,结果以平均值±标准差表示。采用SPSS 21.0软件进行相关性及单因素方差分析,数据处理间差异显著性检验采用Duncan法。
2 结果与分析
2.1 采后贮藏时期杏鲍菇子实体的乙烯释放量
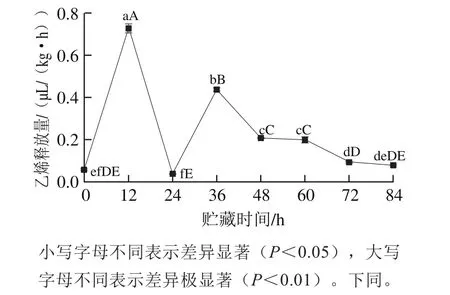
图1 杏鲍菇采后贮藏期间子实体的乙烯释放量Fig.1 Ethylene production in P. eryngii during postharvest storage
贮藏期间,随着子实体的继续发育,乙烯释放量整体呈现先增加后降低的双峰模式(图1)。采后贮藏期间,杏鲍菇子实体的乙烯释放量非常低,尤其是贮藏后期(48~84 h)远小于0.3 μL/(kg·h)。但在贮藏的12 h和36 h,各出现1 次乙烯释放高峰,分别为0.73、0.44 μL/(kg·h),分别是贮藏前的12.53 倍和7.57 倍,表现出典型的呼吸跃变型果蔬的乙烯释放特征。
2.2 外源乙烯处理对杏鲍菇子实体内源乙烯的诱导
贮藏期间,CK组及各剂量乙烯处理组均呈现双峰模式的乙烯跃变型(图2A)。CK组及1、10 μL/L乙烯处理组的跃变时间重合,分别在贮藏的12 h和36 h出现;相较于CK组,100、1 000 μL/L乙烯处理组的第一次跃变时间均延迟12 h,第二次跃变时间延迟了24 h以上。此外,各剂量外源乙烯处理均显著诱导了杏鲍菇子实体贮藏期间内源乙烯的释放,加快了乙烯释放速率,CK组及1、10、100、1 000 μL/L乙烯处理组的峰值水平分别为0.73、1.74、6.15、10.61、13.87 μL/(kg·h),各处理组的乙烯释放峰值水平分别为CK组的2.38、8.42、14.53、19.00 倍,差异均达显著水平(P<0.05)。可见,外源乙烯处理能显著诱导子实体内源乙烯释放量的增加,同时推迟乙烯跃变启动时间。经相关性分析,除12 h外,该诱导现象跟外源乙烯剂量呈极显著正相关(P<0.01),24~84 h内,相关系数分别为0.79、0.81、0.92、0.70、0.78、0.94。另外,结合各处理组杏鲍菇表型可以看出外源乙烯明显促进了菇体的褐变程度及菌丝体的生长,且剂量越高品质劣变越剧烈(图2B)。
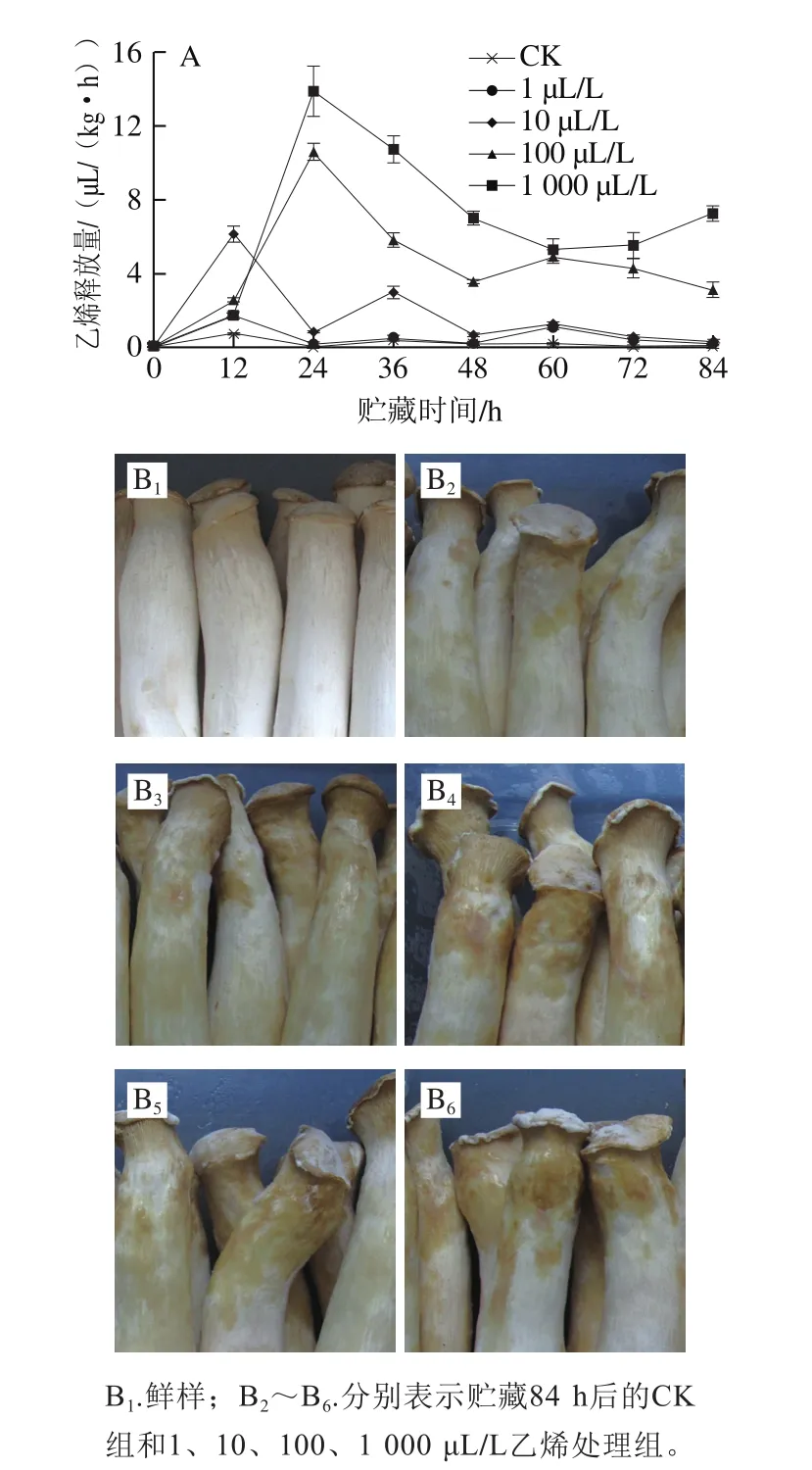
图2 不同剂量外源乙烯处理对杏鲍菇子实体贮藏期间乙烯释放量(A)及贮藏末期衰老表型(B)的影响Fig.2 Effect of exogenous ethylene treatment on ethylene production (A)and senescence phenotypes (B) of P. eryngii during postharvest storage
2.3 外源乙烯处理对杏鲍菇子实体褐变相关指标的影响
PPO是引起酶促褐变的关键酶之一,其活力水平对杏鲍菇的白度有较大影响。贮藏末期,CK组及乙烯处理组杏鲍菇子实体的褐变度(图3A1、A2)及PPO活力(图3B1、B2)较贮藏前有所上升,经相关性分析,两指标大小与外源乙烯剂量呈显著正相关效应(r=0.58、0.94,P<0.05)。贮藏末期高剂量乙烯(100、1 000 μL/L)处理组菇柄、菇伞的褐变度和PPO活力分别为CK组的1.82、1.91、1.27、1.29 倍和1.22、1.46、1.33、1.60 倍。可见,外源10、100、1 000 μL/L乙烯处理能显著促进子实体贮藏期间PPO活力的增加,加速其褐变进程。
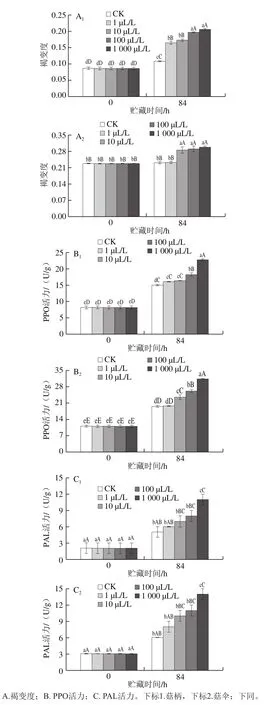
图3 不同剂量外源乙烯处理对杏鲍菇子实体褐变度、PPO和PAL活力的影响Fig.3 Effect of exogenous ethylene treatment on browning degree, and PPO and PAL activities of P. eryngii
PAL能够催化L-苯丙氨酸解氨生成反式肉桂酸,是大多食用菌酚类次生物质(类黄酮、酚类物质等)合成途径的关键酶,与食用菌的褐变密切相关[23]。贮藏末期,PAL活力较初期有所上升(图3C1、C2),84 h时各乙烯处理组活力水平均极显著高于0 h(P<0.01);菇柄及菇伞部位PAL活力与外源乙烯剂量均表现为极显著正相关效应(r=0.77、0.74,P<0.01);且高剂量外源乙烯(1 000 μL/L)处理组菇柄及菇伞的PAL活力分别为CK组的2.20、2.33 倍,差异达极显著水平(P<0.01)。可见,外源乙烯极大加速了杏鲍菇子实体PAL活力的上升,加剧子实体的褐变,这与冯立娟等[24]研究发现石榴果实的PAL活力与果皮褐变呈极显著正相关的结果一致。
2.4 外源乙烯处理对杏鲍菇子实体相对电导率和MDA含量的影响
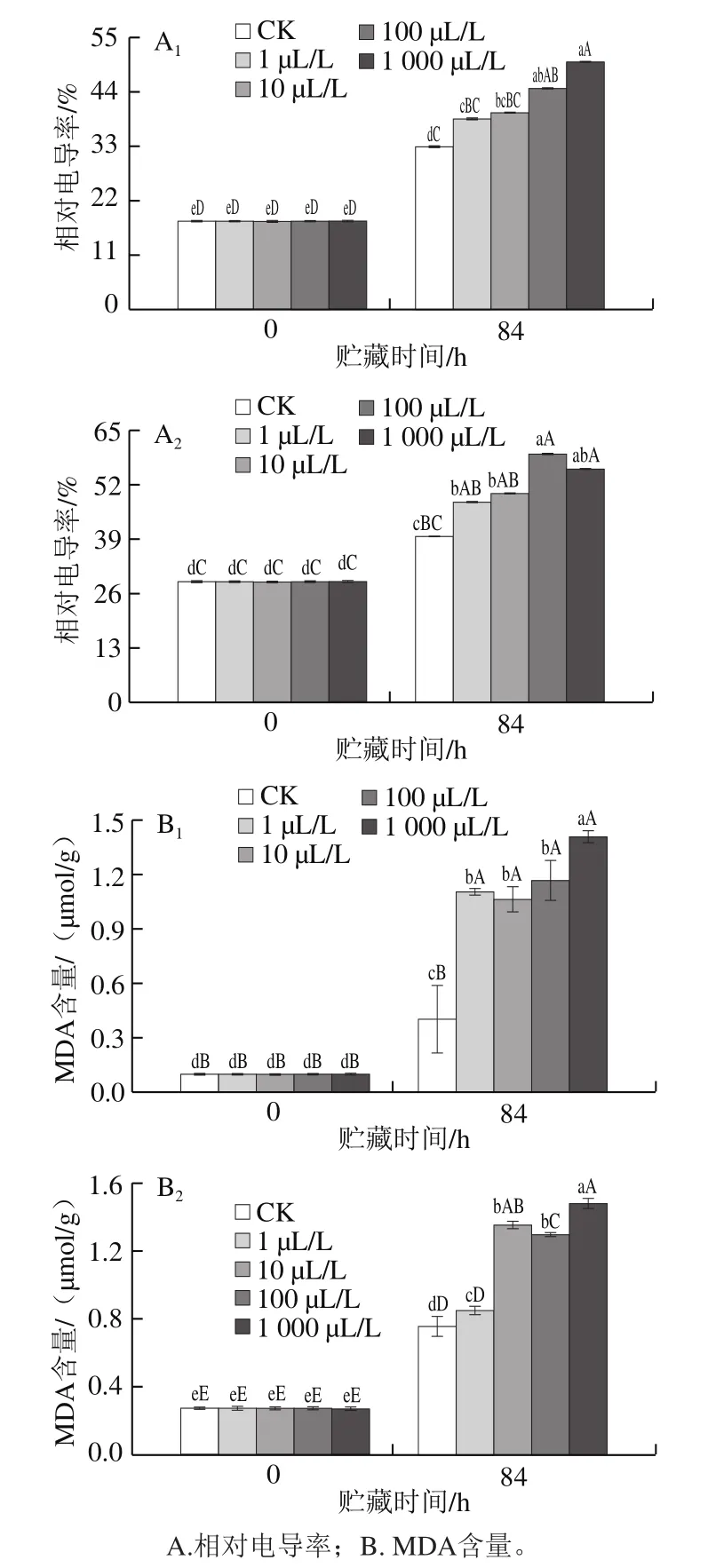
图4 不同剂量外源乙烯处理对杏鲍菇子实体相对电导率和MDA含量的影响Fig.4 Effect of exogenous ethylene treatment on relative electric conductivity and MDA content of P. eryngii
相对电导率可反映食用菌贮藏期间细胞膜受到的伤害程度,是衡量细胞膜通透性及细胞抗性强弱、衰老程度的重要指标[25]。贮藏末期,各处理组相对电导率较初期呈现上升趋势(图4A1、A2),且在贮藏84 h时显著高于0 h(P<0.05);可见贮藏末期杏鲍菇老化进程有所加剧。但CK组的相对电导率显著低于各乙烯处理组(P<0.05),且乙烯剂量越高,杏鲍菇细胞膜透性增加幅度越明显。由此说明各剂量外源乙烯不同程度地加速了杏鲍菇子实体的老化。
MDA是细胞膜脂质中不饱和脂肪酸发生过氧化的产物之一,其含量变化与相对电导率有一定的相关性(r=0.85,P<0.01)。贮藏末期,杏鲍菇菇柄及菇伞MDA含量极显著高于贮藏初期(P<0.01)(图4B1、B2)。贮藏至84 h,1、10、100、1 000 μL/L乙烯处理组菇柄及菇伞的MDA含量分别为CK组的2.77、2.66、2.92、3.53 倍及1.13、1.80、1.72、1.97 倍,同期菇柄MDA含量极显著高于CK组(P<0.01)。可见,外源乙烯加剧了杏鲍菇子实体膜脂过氧化产物的积累,且与乙烯剂量呈正相关(r=0.57,P<0.01)。
2.5 外源乙烯处理对杏鲍菇子实体抗氧化酶活力的影响
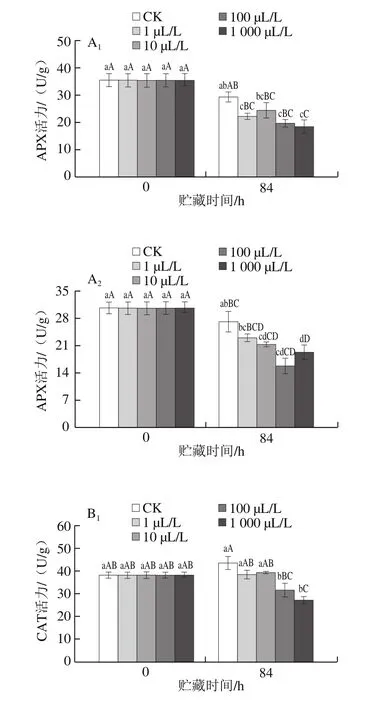
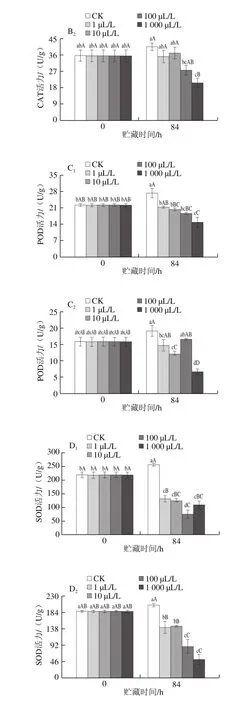
图5 不同剂量外源乙烯处理对杏鲍菇子实体APX(A)、CAT(B)、POD(C)和SOD(D)活力的影响Fig.5 Effect of exogenous ethylene treatment on the activities of APX (A),CAT (B), POD (C) and SOD (D) in P. eryngii
APX、CAT、POD和SOD是机体消除活性氧的关键酶类。贮藏末期,各剂量乙烯处理组的APX、CAT、
POD和SOD活力较初期均呈现出下降趋势,同期菇柄各酶活力稍高于菇伞(图5)。相较于CK组,1~1 000 μL/L外源乙烯处理均极显著加速了子实体(菇柄和菇伞)APX活力的降低(P<0.01),其活力水平在贮藏末期仅为CK组的58.20%~85.25%。贮藏末期,CK组CAT、POD和SOD活力与初期相比有所上升,而乙烯处理组与此相反。CAT、POD和SOD三者均为胞内诱导酶,在食用菌衰老过程中其活力水平随活性氧产生速率的增加而升高,但当活性氧产生量超过抗氧化酶的清除能力后,这些酶的活力就会受到抑制,并开始呈现下降趋势[26]。由此可见,各剂量乙烯处理极大加速了杏鲍菇子实体组织活性氧的积累。
2.6 外源乙烯处理对杏鲍菇子实体DPPH自由基清除率、总抗氧化能力、抗氧化物质(总酚、类黄酮)含量的影响
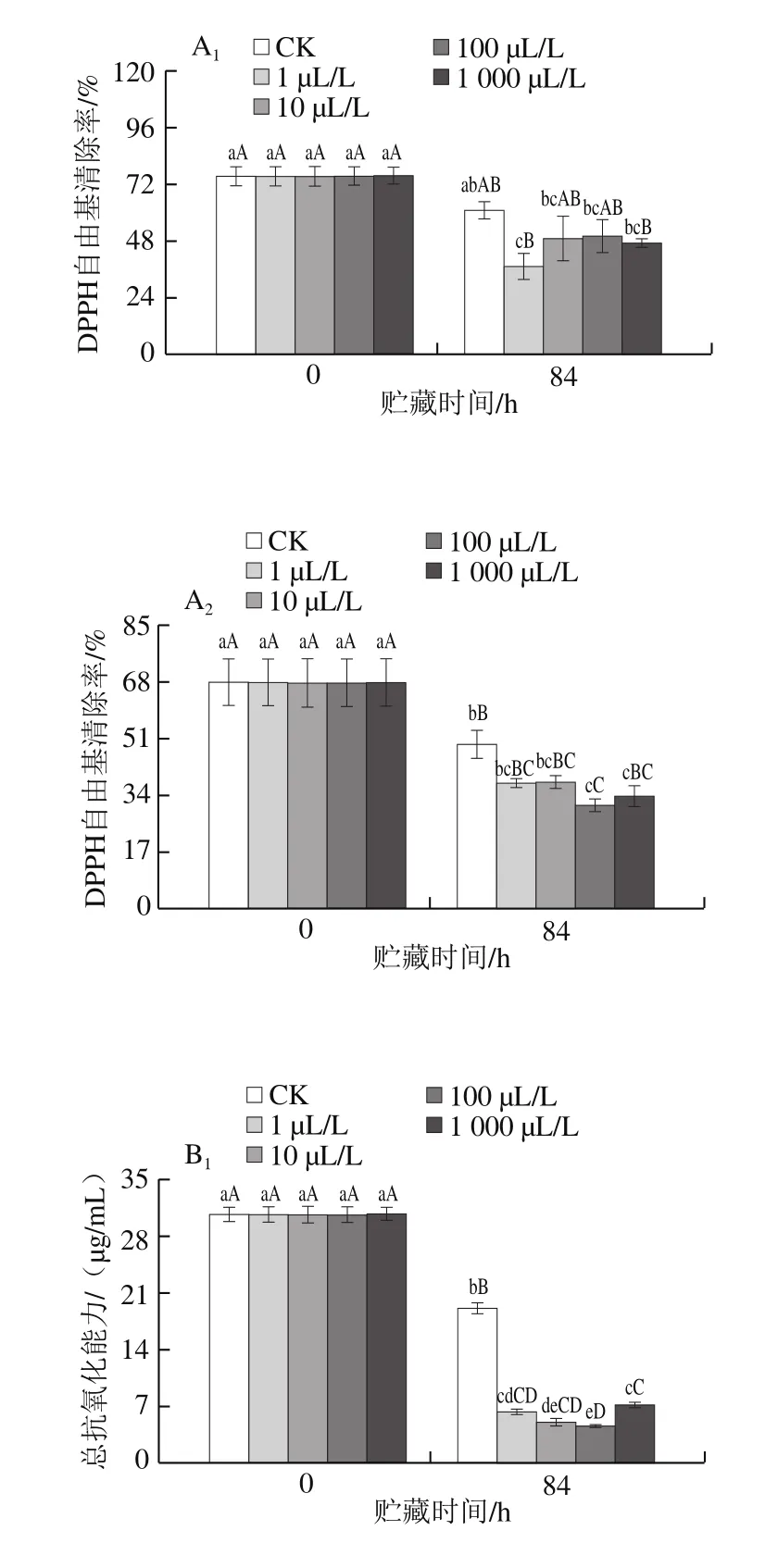
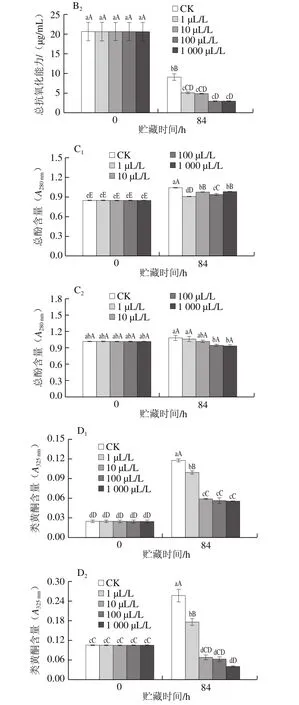
图6 不同剂量外源乙烯处理对杏鲍菇子实体DPPH自由基清除率(A)、总抗氧化能力(B)、总酚(C)和类黄酮(D)含量的影响Fig.6 Effect of exogenous ethylene treatment on DPPH free radicalscavenging capacity (A), T-AOC (B), total phenol content (C), and total flavonoid (D) content in P. eryngii
杏鲍菇子实体中含有的多酚、类黄酮等抗氧化物质具有较高的DPPH自由基清除能力及抗氧化能力。贮藏末期(84 h),杏鲍菇子实体(菇柄和菇伞)的DPPH自由基清除率、总抗氧化能力较初期均呈现下降趋势(图6A1、A2、B1、B2),且各剂量乙烯处理组的DPPH自由基清除率为CK组的61.27%~82.09%,总抗氧化能力为CK组的22.95%~56.33%,差异达显著水平(P<0.05)。
酚类物质被认为是食用菌中主要的抗氧化成分。贮藏末期,除100、1 000 μL/L乙烯处理组的菇伞外,其余各组总酚含量均稍有上升(图6C1、C2),这可能是由于随着贮藏时间的延长,杏鲍菇子实体受到环境胁迫引起组织产生更多的酚类物质,以增强子实体对不良环境的抗性;而高剂量乙烯(100、1 000 μL/L)处理组菇伞总酚含量稍有下降,这可能是由于高剂量乙烯加剧了菇伞组织膜脂过氧化程度和透性,导致细胞膜系统破坏,使酚类物质与相关酶类接触并发生反应,从而造成其含量减少。
类黄酮作为单宁的聚合物之一,是苯丙烷代谢途径的产物,同样具有很好的抗氧化和防御能力[27]。贮藏末期,各组杏鲍菇子实体类黄酮与总酚水平变化趋势相似(图6D1、D2),但CK组含量极显著高于各乙烯处理组(P<0.01)。同时,相关性分析表明类黄酮含量与乙烯剂量呈显著负相关(r=-0.43,P<0.05)。
2.7 外源乙烯处理对杏鲍菇子实体可溶性糖和可溶性蛋白含量的影响
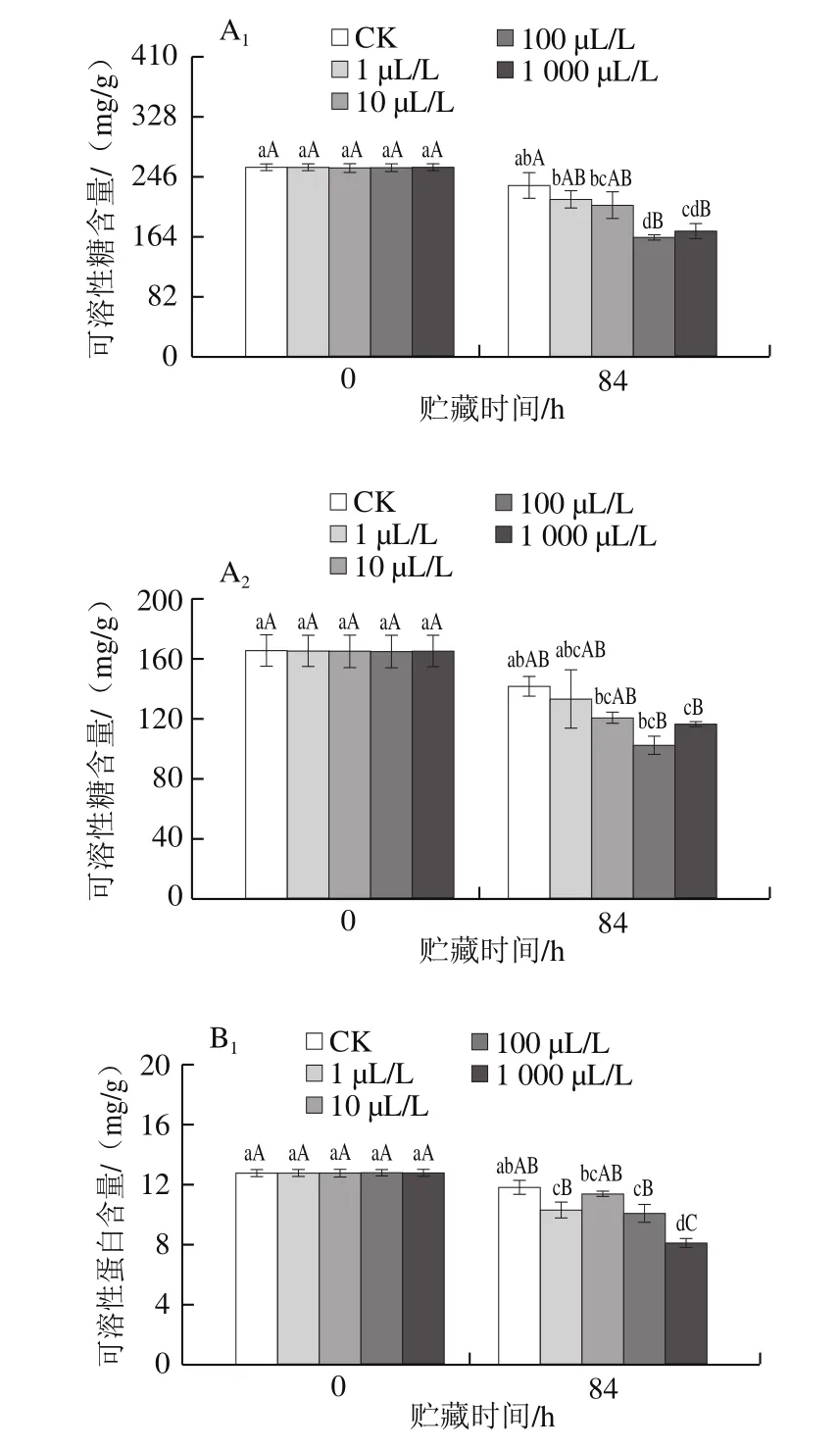
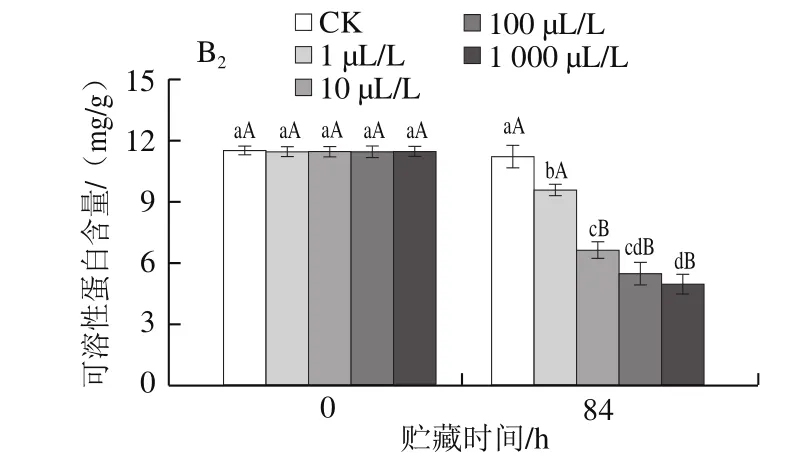
图7 不同剂量外源乙烯处理对杏鲍菇子实体可溶性糖(A)和可溶性蛋白(B)含量的影响Fig.7 Effect of exogenous ethylene treatment on the contents of soluble sugar (A) and soluble protein (B) in P. eryngii
食用菌中可溶性糖含量与其品质、成熟度和耐贮性密切相关[28]。贮藏末期可溶性糖含量低于贮藏初期(图7A1、A2),且此时乙烯处理组可溶性糖含量均不同程度地低于CK组,CK组含量比100 μL/L乙烯处理组高1.44 倍,且可溶性糖含量与外源乙烯剂量之间存在一定的负相关效应(r=-0.21)。
杏鲍菇子实体中的可溶性蛋白是采后贮藏过程中主要的营养物质来源,其含量的下降被认为是组织衰老的重要特征。贮藏末期,各组可溶性蛋白含量变化水平与可溶性糖含量保持一致(图7B1、B2),乙烯剂量与蛋白含量也存在一定的负相关效应(r=-0.53,P<0.01);且菇柄的可溶性蛋白含量水平稍高于菇伞。
可溶性糖和蛋白是杏鲍菇采后代谢底物之一,它们的降解是引起采后杏鲍菇变质和腐败的主要原因。可见,不同剂量外源乙烯处理均不同程度地加剧了杏鲍菇子实体采后营养物质的损失。
3 讨 论
本研究发现,在杏鲍菇子实体采后贮藏的前期(12 h和36 h)出现了两次乙烯跃变高峰,释放量分别为贮藏前的12.53 倍和7.57 倍,表现为典型的呼吸跃变型果蔬的乙烯释放特征,但释放量都远小于1 μL/(kg·h),属于Kader等[29]规类的‘very low’级别的乙烯释放果蔬,呈现出低水平类植物的乙烯释放特点。此外,本研究还发现较高剂量(100、1 000 μL/L)外源乙烯处理组第二次乙烯跃变启动时间相较于CK组均延迟12 h以上,这与外源乙烯加速猕猴桃[10]、芒果[30]内源乙烯跃变高峰出现的研究结果不一致,这可能是由于杏鲍菇对乙烯不甚敏感,外源乙烯与其受体位点的结合能力低于猕猴桃、芒果,导致外源乙烯处理不能立即启动内源乙烯释放高峰的出现,这与Jones[31]研究转基因矮牵牛对乙烯敏感性的结果保持一致;并且这种效应随外源乙烯剂量的增加表现得更为明显,一方面可能是由于乙烯与其受体的结合存在饱和效应,杏鲍菇子实体内已有的乙烯活性受体与高剂量外源乙烯在短时间内结合完全,且受体与乙烯结合的半衰期较长,一般都超过12 h[32],因此乙烯活性受体与高剂量外源乙烯一旦结合,较长时间内受体将不能调控乙烯诱导基因的表达,必须通过合成新的受体才能启动乙烯跃变高峰的到来;另一方面,这与外源乙烯对内源乙烯释放量的诱导可能在杏鲍菇采后继续发育及衰老的某一特定阶段才会起到较明显的促进作用有一定关联。
杏鲍菇作为一种大型真菌,采收后子实体继续分化发育,主要表现为菌褶发育、菇柄伸展、菇伞扩张、孢子形成与弹射[33],为保证其采后继续发育,子实体中的营养物质会发生一定程度的迁移与降低[34]。如采后子实体可溶性糖及蛋白含量迅速下降,菇伞部位营养物质含量明显低于菇柄,这可能是由于采收时菇柄底部不可避免地会遭受到机械伤害,伤呼吸迅速增加,需要消耗大量的营养成分,而菇伞作为子实体组织形态相对完好的部位,其营养成分快速转移到菇柄,以提高菇柄的愈伤能力,增强子实体抵抗逆境的能力;同时,菇伞也是杏鲍菇子实体质地特性相对比较脆嫩的部位[35],对外源乙烯等胁迫的抗性低于菇柄,致使其对碳水化合物及氮素的消耗速率高于菇柄。另外,子实体营养损耗随外源乙烯剂量的增加而加剧,这主要是由于随外源乙烯剂量的上升,子实体遭受到的逆境胁迫加剧,导致子实体营养代谢加快。
杏鲍菇子实体在贮藏期间遭受外源乙烯的胁迫,使得正常的代谢途径和相关酶系统发生改变,外源乙烯主要通过加剧组织膜脂过氧化程度及细胞膜的渗透性,增强与组织的结合能力,诱导杏鲍菇子实体对其敏感性增加[36],从而导致内源乙烯释放量上升,引起自身营养物质消耗加快,PPO活力升高,子实体褐变加重,促进抗氧化能力的下降,加速杏鲍菇子实体的衰老,且上述效应随外源乙烯剂量的升高而加剧。
外源乙烯处理能显著诱导采后贮藏期间杏鲍菇子实体内源乙烯的释放,加重杏鲍菇组织膜脂过氧化程度及细胞膜渗透性,提高子实体的褐变程度及褐变相关酶(PPO、PAL)的活力,加快可溶性糖及可溶性蛋白的降解,同时加速子实体抗氧化相关酶(APX、CAT、POD、SOD)活力、DPPH自由基清除率及总抗氧化能力的降低,降低抗氧化物质(总酚、类黄酮)含量,从而加速了杏鲍菇子实体的衰老进程,且该效应整体上随外源乙烯剂量的升高而更明显。但杏鲍菇生长发育与采后衰老机制非常复杂,外源乙烯对杏鲍菇衰老进程的调控机制还需进一步研究。
