不同模式超声预处理对莲子蛋白酶解物及其结构的影响
2018-12-29吴隆坤江连洲王丽娟肖志刚
吴隆坤,江连洲,王丽娟,肖志刚,*
(1.沈阳师范大学粮食学院,辽宁 沈阳 110034;2.东北农业大学食品学院,黑龙江 哈尔滨 150030)
莲子由于其蛋白含量高、必需氨基酸比例平衡,同时又富含赖氨酸,可以弥补谷类蛋白质中赖氨酸含量的不足,因此是一种理想、潜在的优质植物蛋白资源,也是制备降血压肽的原料,近几年利用莲子蛋白制备功能型肽备受关注[1]。为了更好地制备功能型肽,提高其功能特性,通常对莲子蛋白进行酶解,酶解后的小分子肽吸收率优于未经酶解的蛋白,而且具有生理调节和预防疾病的生物活性功能,如血管紧张素I-转化酶(angiotensin converting enzyme,ACE)抑制活性肽[2]。但是,常规酶解存在酶解效率低、生产成本较高等缺点。超声预处理下蛋白质酶解已经表现出显著的效果,包括提高酶解速度、酶利用率和增加肽生物活性[3]。
近年来,有较多关于超声辅助蛋白酶解的研究。Jin Jian等[4]研究了超声预处理对油菜籽蛋白酶解结构特征,荧光光谱发现超声预处理能够诱导蛋白分子展开,引起更多的疏水性基团和区域暴露;同时发现超声预处理是蛋白质酶解产生多肽的有效方法。Pan Adan等[5]发现在超声波参数中,超声频率是影响酶解的主要因素。由于超声频率对蛋白酶解的重要性,最近有研究者利用不同模式的超声预处理对蛋白酶解效果的影响:Xue Yang等[6]以蛋白水解度和ACE抑制率为指标,研究了多频率超声预处理对酶解后大米蛋白结构的影响,发现不同模式的超声预处理ACE抑制率差异较为明显,且三频超声ACE抑制效果最为显著;同时Xue Yang等[7]利用多频率超声预处理小麦胚芽蛋白,发现ACE抑制率及蛋白水解度具有类似的规律,同时还发现在不同模式的超声预处理条件下,酶解对小麦胚芽的氨基酸组成发生了很大的变化。虽然前人发现超声预处理可以提高植物蛋白的酶解效率,但是目前对超声预处理对莲子蛋白酶解影响的研究较少,利用不同模式超声预处理莲子蛋白酶解更是鲜有研究,而分析莲子蛋白酶解及结构特征是获取ACE抑制肽、提高莲子蛋白功能特性的有效途径。
为了探究不同模式、不同频率的超声预处理对莲子蛋白酶解及结构影响,本实验采用不同模式下的超声频率(单频、双频、三频),以蛋白水酶解度与ACE抑制率作为指标,选取最优的超声频率;通过蛋白表面疏水性、氨基酸分析及内源性荧光光谱对不同模式超声预处理下的酶解物结构进行分析,以期为莲子蛋白的应用提供依据与应用指导。
1 材料与方法
1.1 材料与试剂
空心白莲由湖南宏兴隆湘莲食品有限公司生产,于37 ℃下干燥,制成莲子粉(粒径为0.150 mm);木瓜蛋白酶(8 214 U/g) 广西南宁庞博生物工程公司;HCl、NaOH、丙酮等化学试剂均为国产分析纯级。
1.2 仪器与设备
磁力搅拌器 广州仪科实验仪器有限公司;水浴锅德国IKA公司;PHS-25数显台式酸度计 上海雷磁仪器厂;Allegra64R台式高速冷冻离心机 美国贝克曼公司;JXP-24型多频组合超声仪 北京金星超声波设备技术有限公司;L-8900全自动氨基酸分析仪、F-4500荧光分光光度计 日本Hitachi公司。
1.3 方法
1.3.1 多频率超声预处理
莲子粉用0.1 mol/L的NaCl溶液溶解,在45 ℃的恒温水浴锅中提取1 h,提取液4 000 r/min离心分离15 min,离心后用0.5 mol/L的HCl溶液调上清液pH值至4.2,得莲子蛋白液,将蛋白液冷冻干燥得到蛋白粉末[8]。多频功率超声仪配有6 个频率发生器,分别为20、28、35、40、50 kHz和60 kHz,它可以在单频超声、双频超声和三频超声模式下工作。配制底物质量浓度60 g/L的莲子蛋白溶液3 L,将超声探头以固定深度插入反应液,水浴温度30 ℃下分别在单频、双频和三频超声模式下,超声功率密度100 W/L、总电功率100 W工作超声处理一定时间,然后进行酶解,将ACE抑制率和水解度设定为优化超声频率和工作模式的指标。在相同条件下用不带超声波的磁力搅拌装置处理的莲子蛋白溶液作为空白对照[9]。所有实验均重复进行3 次。
1.3.2 酶解莲子蛋白的制备
超声波预处理后,莲子蛋白悬浮液在50 ℃下用水浴预热10 min,将pH值调节至8.0。然后加入质量分数5%木瓜蛋白酶,同时用2 mol/L NaOH溶液连续滴定,pH值保持在8.0,持续60 min。在酶解结束时,将混合物在水浴中煮沸10 min灭酶。冷却至室温后,将水解物以4 500 r/min离心10 min,并将上清液用于之后的分析[10]。
1.3.3 水解度的测定
参考Adler-Nissen[11]的方法略作修改,利用0.05 mol/L pH 7.0的磷酸盐缓冲液稀释莲子蛋白质得到质量浓度为15 mg/mL的蛋白溶液,取10 μL稀释后的蛋白溶液,加入含有1.5 mL OPA试剂的石英管中,漩涡混合2 s,之后避光5 min,最后在340 nm波长处测定吸光度。实验重复3 次取平均值,每次测量均以去离子水作为空白样品,水解度按式(1)计算。

式中:h为水解的肽键数/(mmol/g);htot为总肽键数/(mmol/g)。
1.3.4 ACE抑制活性的测定
参照Cushman等[12]的方法,略作改动,量取80 μL莲子蛋白酶解物加入到200 μL 5 mmol/L马尿酰-组氨酸-亮氨酸四水化合物(N-hippury-His-Leu tetrahydrate,HHL),37 ℃恒温水浴10 min。加入10 μL ACE(0.1 U)启动反应,37 ℃恒温60 min后,加入0.25 mL 1 mol/L的HCl溶液终止反应,再加入1.2 mL冷乙酸乙酯,混合均匀15 s,然后在3 500 r/min离心10 min,取出1.0 mL酯层放入另一试管中,在95 ℃的烘箱中处理30 min烘干,再将其溶于3.0 mL去离子水中,漩涡混合2 min,最后在228 nm波长处测定OD值。酶活力单位定义:在37 ℃、1 min内催化HHL形成1 μmol马尿酸所需的酶量计为1 个酶活力单位。ACE抑制率按式(2)计算。
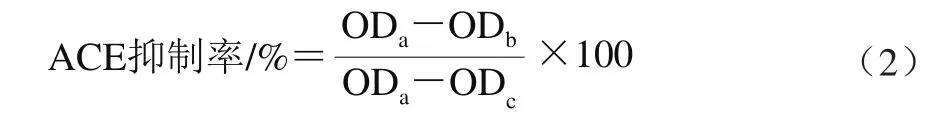
式中:ODa为不含抑制剂时的光密度值;ODb为含有抑制剂与酶时的光密度值;ODc为空白对照的光密度值。
1.3.5 表面疏水性测定
参照Kato等[13]的方法,采用8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)荧光探针法。利用0.05 mol/L pH 7.0的磷酸盐缓冲液稀释莲子蛋白质得到质量浓度为0.5 g/mL的蛋白溶液,然后在90 000×g下离心40 min,取上清液利用Lowry法测定蛋白质浓度,并用上述pH 7.0的磷酸盐缓冲溶液稀释,得到浓度0.005~0.500 mol/mL的蛋白溶液,然后取5 mL稀释后的蛋白溶液,分别加入40 μL浓度为8 mmol/L的ANS溶液,经漩涡振荡2 s后静置5 min,最后测定样品的荧光强度。设置的实验参数:激发波长λex=390 nm、发射波长λem=468 nm、夹缝为5 nm、扫描速率10 nm/s。以得到的荧光强度和蛋白质浓度作图,初始段斜率即为蛋白质分子的表面疏水性指数。
1.3.6 氨基酸组成分析
采用氨基酸全自动分析仪酸水解法测定,取适量样品中加入6 mol/L HCl溶液并封管,放入110 ℃烘箱中水解22 h,待反应结束后,酶解液用0.45 μm滤膜过滤到50 mL容量瓶,用去离子水定容。然后取1 mL酶解液进行浓缩、复溶,重复5 次后过滤进样,进样量50 μL。测定莲子蛋白酶解物中氨基酸含量[14]。
1.3.7 荧光光谱分析
采用F-4500荧光分光光度计测定不同模式超声预处理下莲子蛋白酶解物的内源性荧光光谱,即氨基酸荧光光谱。将莲子蛋白酶解物用0.01 mol/L、pH值为7.0的磷酸盐缓冲液,配制成质量浓度为0.15 mg/mL的蛋白溶液。荧光光谱分析实验设置:以莲子蛋白质内部的色氨酸荧光基团为探针,荧光光谱激发波长为290 nm,发散光谱扫描范围为300~500 nm,激发狭缝和发射狭缝宽均为5 nm。重复扫描3 次,取平均值。
1.4 数据统计与分析
每个实验均重复3 次,采用ANOVA进行误差分析,并用Origin 7.5和Excel软件统计分析数据并作图,采用Duncan检验法进行显著性分析,P<0.05为差异显著。
2 结果与分析
2.1 不同模式、不同频率超声预处理对莲子蛋白酶解物水解度和ACE抑制率的影响
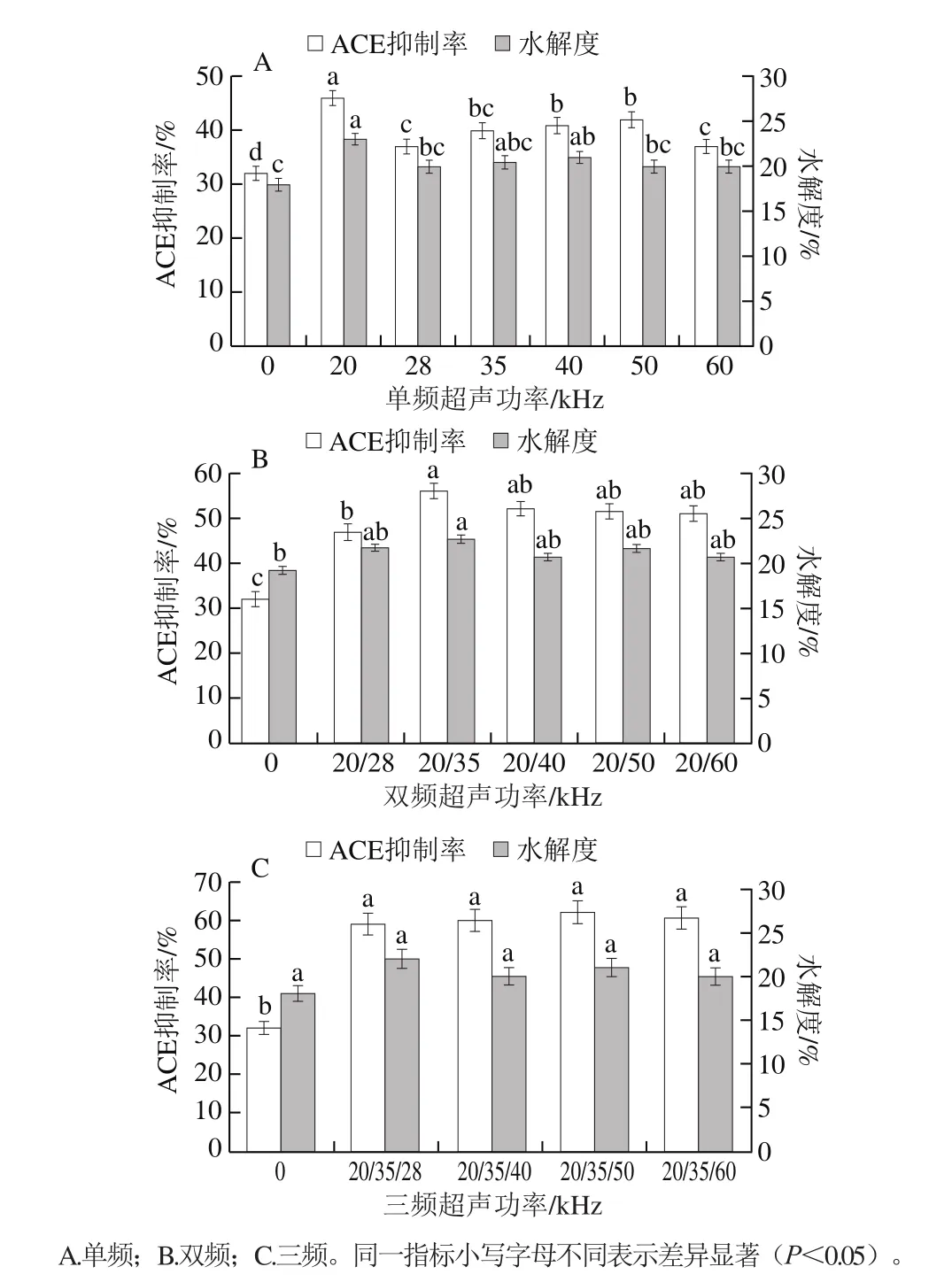
图1 不同模式、不同频率超声预处理对莲子蛋白酶解物水解度和ACE抑制率的影响Fig.1 Effect of ultrasound pretreatment with different working modes and different frequencies on degree of hydrolysis and ACE inhibitory activity of lotus seed protein hydrolysates
ACE抑制肽是一种具有降血压、促进矿物质吸收、抗氧化等特效的功能肽[15];在制备酶解肽时,除了要考虑ACE活力抑制效果,还要研究酶解过程中产生的有效蛋白肽即测定酶解肽的水解度[16]。按照1.3.3和
1.3.4 节水解度及ACE抑制率的测定方法,得到了ACE的抑制率及蛋白水解度随不同频率超声预处理的变化趋势。如图1A~C所示,所有超声预处理均提高了莲子蛋白酶解产物的ACE抑制率及水解度。同时也发现不同频率超声预处理下,莲子蛋白水解度间总体差异不显著(P>0.05),这与Pan Adan等[5]研究结果相似。图1A显示在20~60 kHz的范围内,与空白对照相比,单频超声预处理均提高了莲子蛋白水解液的ACE抑制率,且在20 kHz超声频率下获得最高的ACE抑制率。这可能是由于20 kHz预处理使蛋白结构发生了变化,使其更适合随后的酶解。图1B为双频率超声预处理对莲子蛋白水解产物的影响,结果显示,双频超声预处理下,莲子蛋白的ACE抑制率显著增加(P<0.05),并在20/35 kHz的频率组合下达到峰值。三频超声预处理下莲子蛋白的ACE抑制率又进一步增加,但所有频率组合之间差异显著(P<0.05),与其他组合的三频超声预处理相比,20/35/50 kHz组合呈现较高的ACE抑制率(图1C)。因此得出结论,所有的超声预处理均增加了莲子蛋白水解产物的ACE抑制率,且效果由大到小依次为:三频>双频>单频,对于莲子蛋白而言,最优频率是20 kHz或其组合,这可能是由于每种蛋白都有使蛋白内部的分子链展开的频率[17],即敏感频率或组合,20 kHz是莲子蛋白的敏感频率[6]。
2.2 表面疏水性分析
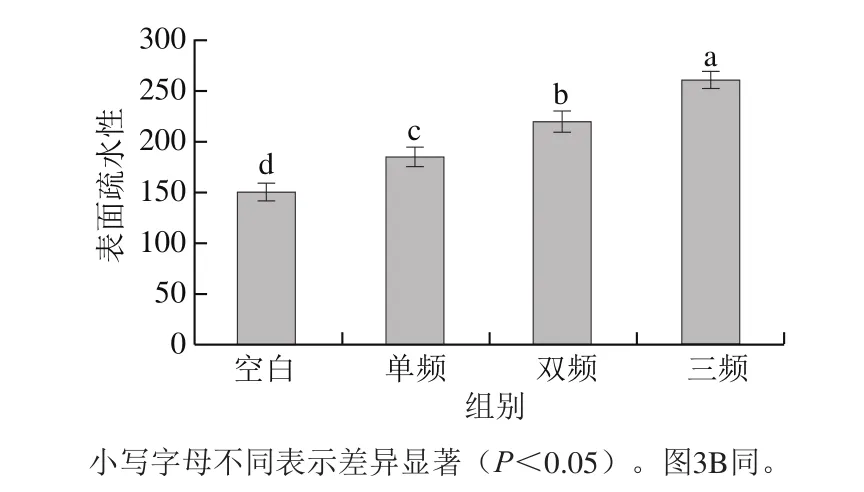
图2 不同模式超声预处理对莲子蛋白酶解物表面疏水性的影响Fig.2 Effect of ultrasound pretreatment with different working modes on surface hydrophobicity of lotus seed protein hydrolysates
表面疏水性是蛋白质表面疏水基团的重要表征,也是反映蛋白质分子结构变化的重要指标之一[18]。Jin Jian等[19]研究表明表面疏水性与疏水性氨基酸含量有关,这在肽的抗高血压活性中起重要作用。不同模式超声预处理下酶解后莲子蛋白的表面疏水性如图2所示。未处理的样品表面疏水性最低,这与Hayakawa等[20]的研究结果一致,未经超声处理的莲子蛋白中大多数疏水基团被紧密包埋在球状区域内,蛋白质的疏水基团和荧光探针之间的接触受到抑制,疏水性较低。超声预处理均显著提高莲子蛋白的表面疏水性,主要是由于超声作用使蛋白展开,使最初被掩埋在蛋白分子内部的疏水基团展开暴露[20]。另外,蛋白质复杂结构在超声波空化作用下被破坏,且超声强度越大蛋白质被破坏程度越大,蛋白质的表面疏水性随着蛋白质分子拉伸而增加[21],因此出现了如图2所示结果,随着超声频率组合的增多(三频>双频>单频)表面疏水性越来越大。这与不同频率超声预处理下,莲子蛋白酶解物的ACE抑制率变化趋势一致(图1A~C),推测主要是由于超声预处理使蛋白质构象发生变化,疏松的蛋白结构在酶解过程中导致大量的疏水氨基酸被释放,提高了莲子蛋白酶解产物的ACE抑制率[22]。这也与2.3节疏水氨基酸的研究结果一致。
2.3 氨基酸组成分析
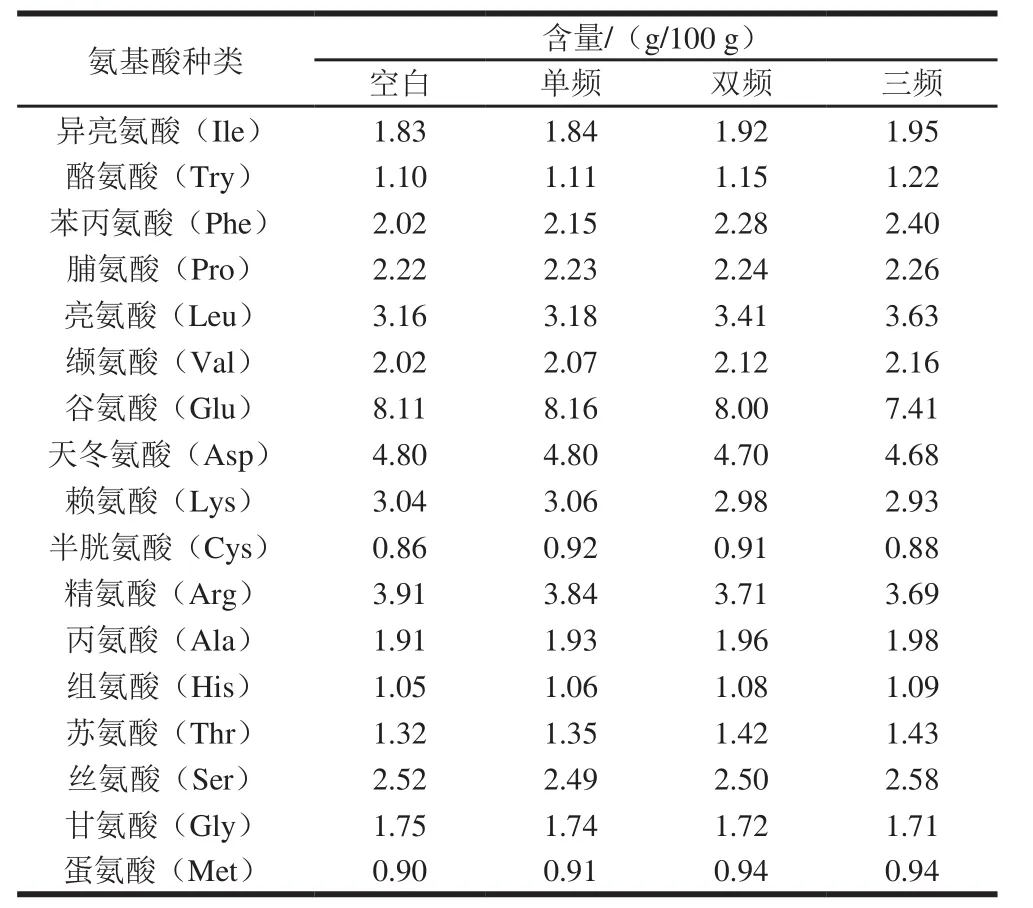
表1 不同模式超声预处理下莲子蛋白酶解后氨基酸组成Table1 Amino acid compositions of lotus seed protein hydrolysates obtained by ultrasound pretreatment with different working modes
不同模式超声预处理条件下的莲子蛋白氨基酸组成如表1所示。可以看出,超声预处理明显提高了蛋白质中Ile、Try、Phe、Leu、Val、Ala等的含量,Ile、Leu、Phe、Val均为疏水氨基酸,且发现随着超声预处理频率组合增多,疏水氨基酸含量增大,这与上述ACE抑制率的变化趋势一致。Jia Junqiang等[23]研究表明超声预处理可以改变蛋白的侧链结构使蛋白结构变的松散,使其更容易酶解,从而暴露更多的疏水性基团,从而使疏水氨基酸比例增加。张莉莉等[24]研究表明酶解可以使疏水氨基酸组成的肽键断裂,断裂的同时又会有疏水性氨基酸处于新肽链的端基,这类处于端基的疏水性氨基酸表现出强烈的疏水特性,更容易插入油脂表面,使亲水的抗氧化氨基酸残基也和脂质靠近,发挥抗氧化效果。由表1可以看出,超声预处理后的莲子酶解物中疏水性氨基酸含量显著提高,同时如图1所示,这些酶解物具有较高的ACE抑制率;因此,推测莲子蛋白酶解物中ACE抑制活性与构成肽的氨基酸种类、数量及氨基酸排列有关[25]。
2.4 荧光光谱分析
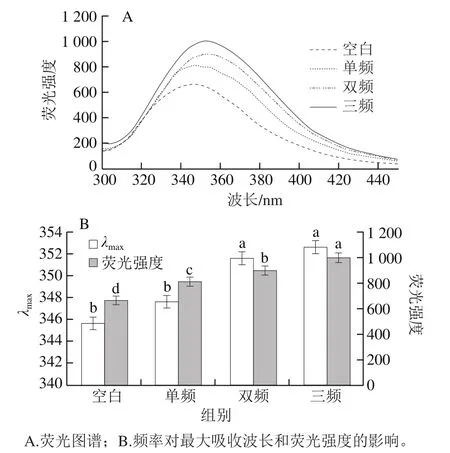
图3 不同模式超声预处理下莲子蛋白酶解物的荧光光谱Fig.3 Fluorescence spectroscopic analysis of lotus seed protein hydrolysates obtained by ultrasound pretreatment with different working modes
荧光光谱是通过测试蛋白质微环境体系,来有效反映蛋白质构象的变化[26]。在蛋白质氨基酸中,Try、色氨酸(Trp)和Phe残基具有荧光特性,特别是Trp残基对微观环境的变化很敏感[27]。因此,Trp荧光可用来于鉴定蛋白质三级结构蛋白质变化,图3A中蛋白质的荧光峰为色氨酸残基的荧光峰[28]。由图3B可知,与对照组相比,超声预处理提高了莲子蛋白的荧光强度,且三频超声预处理下莲子蛋白具有最大的荧光强度(998)。这种现象表明超声波预处理可以诱导展开蛋白质的分子结构,致使后期的酶解处理更容易使蛋白球形结构变得松散伸展,深埋在球状结构内部的色氨酸残基暴露导致[29],从而增加莲子蛋白的荧光强度。另外发现λmax均大于330 nm,说明Trp残基位于蛋白质分子外部的极性环境中[30],且随着超声频率组合的增多,莲子蛋白λmax发生了轻微的红移现象,这很有可能是蛋白质在超声作用下构象发生改变,Trp侧链转移到蛋白分子表面造成蛋白微环境极性的增加,从而使荧光转向更长的波长(红移)[31]。
3 结 论
利用单频、双频、三频不同模式、不同频率超声预处理莲子蛋白,得出了不同模式下的最优频率参数,在频率20~60 kHz的范围内,对于莲子蛋白而言,最优频率是20 kHz或其组合,这可能是由于每种蛋白都有使蛋白内部的分子链展开的频率,即敏感频率或组合,20 kHz是莲子蛋白的敏感频率;不同模式最优频率的超声预处理下,表面疏水性结果表明,随着超声频率组合的增多,表面疏水性越来越大,疏水性氨基酸含量增多;且表面疏水性与疏水性氨基酸含量变化规律与ACE抑制率一致,说明ACE抑制活性与疏水性基团及构成肽的氨基酸种类、数量及氨基酸排列有关;通过荧光光谱发现,超声预处理提高了莲子蛋白的荧光强度,且荧光强度顺序为三频率>双频率>单频率;同时,由于超声作用下莲子蛋白构象发生改变,Trp侧链转移到蛋白分子表面,造成蛋白微环境极性的增加,导致莲子蛋白λmax发生轻微的红移现象。
本研究发现超声预处理虽然对水解度没有明显影响,但不同模式下的超声预处理对ACE抑制率效果比较明显,说明不同模式的超声预处理对于莲子蛋白酶解及ACE抑制肽的制备至关重要,该结论可为莲子蛋白酶解、ACE抑制肽及营养价值更高和功能性质更好的蛋白多肽等产品的制备提供理论支持。
