奶牛围产期营养生理及典型代谢病发生机制
2018-12-29孙博非曹阳春蔡传江李生祥姚军虎
■孙博非 余 超 曹阳春 蔡传江 李生祥 姚军虎*
(1.西北农林科技大学动物科技学院,陕西杨凌712100;2.陕西省商洛市畜牧产业发展中心,陕西商洛726000)
围产期是奶牛泌乳周期中关键时期,包括围产前期(产前21 d)和围产后期(产后21 d),此阶段奶牛的生理代谢复杂,是代谢病高发期。营养负平衡诱导的体组织动员是奶牛围产期最为显著的代谢特征[1-2]。体组织动员可一定程度缓解奶牛营养负平衡,但会带来一系列负面问题,如:①加重肝脏代谢负担,释放急性期蛋白,影响机体各器官功能[3];②降低瘤胃机能,易发生瘤胃酸中毒,改变蹄部微循环,诱发蹄叶炎[4];③自由基产生增加,而机体抗氧化系统的功能相对不足,极易发生氧化应激[5];④部分代谢产物和自由基损伤免疫系统和免疫细胞,降低奶牛免疫功能,奶牛抵抗各种病原菌入侵的能力下降,易感多种疾病[4,6];⑤其它代谢性疾病,如真胃移位、乳房炎和产褥热等[4]。明晰奶牛围产期特殊生理代谢的通路和机理,阐明主要代谢病的发病机理,对于实施围产期奶牛精准营养调控和精细化饲养管理具有重要意义。
1 能量和脂质代谢
能量负平衡(negative energy balance,NEB)是奶牛围产期的重要生理特征,也是多种代谢性疾病的致病因素。奶牛分娩后,为满足泌乳需要,乳腺组织的发育和更新加快,糖类、氨基酸、脂肪酸的需要量分别是妊娠250 d时的3倍、2倍和5倍[7]。苏华维等[8]发现母牛产后第2 d的泌乳净能(net energy for lactation,NEL)需要约是产前2 d的2倍。在干物质采食量(dry matter intake,DMI)受限的前提下,为最大限度增加机体能量供应,奶牛通过自身适应性调节机制动员机体能量储备,导致体脂动员,使奶牛能量和脂质代谢异常旺盛,诱发酮病、脂肪肝等多种代谢障碍,并造成氧化应激和免疫抑制[9]。
1.1 酮病和脂肪肝
奶牛处于NEB时,机体分泌肾上腺素和胰高血糖素,二者刺激脂肪细胞膜上的腺苷环化酶,进而产生胞内第二信使环腺苷酸(cyclic adenosine monophosphate,cAMP),cAMP将信号传递给蛋白激酶A(protein kinase A,PKA),PKA信号可使脂滴打开,并与3种脂酶发生接触,这三种脂酶分别作用于甘油三酯(triglycerides,TG)、甘油二酯和甘油一酯,最终降解产生未酯化脂肪酸(non-esterified fatty acids,NEFA)和甘油。其中,TG中95%的生物可利用能量源于脂肪酸,甘油可提供的能量仅占5%[10]。NEFA从脂肪细胞释放入血,随血液循环转运到各组织器官,发挥相应功能(见图1)。对围产期奶牛而言,一部分NEFA在乳腺合成乳脂,一部分进入肝脏代谢。

图1 动物体脂动员示意图[17]
NEFA进入肝细胞后,共有3条代谢途径[1,11-13]:①完全氧化生成CO2和H2O,并产生大量能量,供能效率高;②不完全氧化生成酮体,产生少量能量,供能效率低。产生的酮体包括β-羟基丁酸(β-hydroxybutyric acid,BHBA)、乙酰乙酸和丙酮,主要为BHBA。当BHBA产生量超出机体利用和清除能力时,奶牛发生酮病;③再酯化形成TG。正常情况下,TG可与极低密度脂蛋白(very low density lipoprotein,VLDL)结合,被转运出肝脏,不会在肝脏中蓄积。奶牛围产期大量NEFA进入肝脏代谢,远远超出肝细胞线粒体的氧化能力,因而酯化生成较多TG,加之VLDL合成不足,TG不能被及时转运出肝脏,造成肝细胞脂肪浸润,甚至是脂肪肝,进一步降低肝脏功能,加剧NEB[14]。
TG在动物肝脏的代谢清除主要有2条途径:①水解为脂肪酸后进行氧化清除,此过程需要肝酯酶和脂蛋白脂酶等一系列酶的参与;②组合包装,以VLDL形式转运出肝脏。奶牛肝脏脂蛋白脂酶和肝酯酶严重缺乏,TG不能通过水解途径清除。因此,为应对肝脏脂肪蓄积,奶牛只能通过增加VLDL合成量的形式将TG转运出肝脏[15]。VLDL由TG、蛋白质、胆固醇、磷脂和胆固醇酯等组装而成,其中载脂蛋白B100(apolipoprotein B100,ApoB100)是VLDL的骨架和结构蛋白,也是最重要的载脂蛋白之一[16-17]。与其它动物相比,反刍动物肝脏VLDL的合成量和效率很低,但TG产生效率相当,因而反刍动物更容易发生脂肪肝[18],尤其是围产期奶牛。由此可见,通过营养调控提高奶牛围产期肝脏VLDL的合成是降低脂肪肝发生风险的重要途径之一。还有研究表明,啮齿类动物肝细胞脂质蓄积可诱发内质网应激(endoplasmic reticulum stress,ERS),ERS 抑制肝细胞ApoB100的表达和分泌[19]。目前,关于奶牛肝细胞ERS的相关研究还较少,ERS是否是围产期奶牛易感脂肪肝的原因尚缺乏充分的科学依据[20],仍需进一步研究。
1.2 瘤胃酸中毒
奶牛分娩前后几天DMI下降至10~12 kg/d,能量、蛋白质和其它营养素的负平衡严重,代谢性疾病频发。通过提高日粮营养浓度(通常是增加谷物类饲料)以增加奶牛的营养摄入,是缓解营养负平衡的主要手段之一,但可能造成负面影响:①奶牛产前高能饲喂不利于产后采食量恢复,对奶牛下一个泌乳周期的生产性能和机体健康不利[21];②围产期奶牛瘤胃机能相对偏弱,短链脂肪酸(short chain fatty acids,SCFA)吸收能力有所下降,对低pH值也更敏感。若大量增加快速可发酵碳水化合物(主要是淀粉),而不考虑日粮物理有效中性洗涤纤维(physically effective neutral detergent fiber,peNDF)含量,造成SCFA大量积累,诱发亚急性瘤胃酸中毒(subacute rumen acidosis,SARA),甚至急性酸中毒,严重威胁奶牛健康[4,22-23]。
当日粮peNDF和降解淀粉(ruminal degradable starch,RDS)配比适宜,营养均衡且饲养管理较好时,围产期奶牛瘤胃机能加强,酸的产生、吸收以及缓冲体系处于动态平衡,不会发生酸中毒[24]。当围产期奶牛发生SARA时,机体氧化应激和炎症反应尤其严重,免疫功能显著下降,更易感乳房炎、子宫炎和蹄叶炎等疾病[20,25],并可能降低繁殖性能[26]。SARA 导致瘤胃LPS、组胺等异常代谢产物增加,不仅损伤胃肠道上皮屏障和功能,还可吸收入血,随血液循环到达各组织器官,造成器官损伤和功能异常[4,27-28]。Zebli等[4]总结前人研究成果,构建了较为系统的围产期奶牛瘤胃酸中毒与机体代谢紊乱和繁殖的关联图(见图2)。

图2 奶牛围产期瘤胃发酵紊乱与机体代谢和繁殖的关系[4]
1.3 真胃移位
真胃移位是指真胃(皱胃)因一些因素而改变其生理解剖位置,是奶牛围产期的一种常见代谢性疾病。根据移位后真胃的位置,可分为左侧真胃移位(left displaced abomasum,LDA)和右侧真胃移位(right displaced abomasum,RDA),一般以LDA最为常见[29],且相关研究资料较多。
随分娩的临近,奶牛胚胎体积逐渐达到最大,子宫扩张挤压真胃,导致真胃的解剖学位置改变;当分娩发生时,母牛内分泌发生显著改变,DMI下降明显,奶牛遭受极为严重的分娩及其它应激,消化道部分机能紊乱甚至迟缓;产犊后,母牛子宫回缩速度快,而移位的真胃往往因为迟缓而不能及时复原,仍被前胃挤压,诱发LDA[30]。LDA奶牛采食欲望低,甚至不采食,表现为精神不振、反应迟缓、表情冷淡和体况下降等,产奶量和乳品质均显著下降,如不及时采取治疗措施,面临生命危险,目前最有效的措施是手术疗法[31]。随着奶业科技的不断发展,奶牛泌乳性能得到很大提升,LDA发病率也逐年升高,且高产奶牛发病率明显高于中低产奶牛。统计1982~1995年间22项研究,发现LDA的发病率约为1.7%[32],而在后续几项研究中,LDA发病率升高到5%~7%[33-34]。为探求奶牛围产期LDA的敏感血液标志物,LeBlanc等[25]开展了一项代表性研究,试验检测了来自20个牧场的1 131头围产期奶牛血样,检测血清NEFA、BHBA、尿素氮等指标,根据奶牛产后30 d是否发生LDA,分别统计LDA奶牛和健康奶牛血清相关指标的动态变化,发现53头奶牛发生LDA,发病率4.69%,且其血清NEFA和BHBA浓度高于健康奶牛(图3)。NEFA和BHBA是奶牛NEB公认的血液标志物,上述试验进一步确证:NEB是围产期奶牛LDA的主要病因。以上研究选取的血液参数明显偏少,是否存在其它敏感标志物,尚无法定论。作者认为,运用现代蛋白质组学和代谢组学技术,比较分析健康奶牛和LDA奶牛血清、尿液、瘤胃液等样品的蛋白质谱和代谢谱,有助于阐明LDA的特异标志物和相关代谢机理,并制定有效的营养和管理策略。

图3 真胃移位和健康围产期奶牛血清NEFA和BHBA的动态变化[25]
1.4 乳房炎
乳房炎严重威胁奶牛乳腺和机体健康,降低生产性能,其发病原因有很多,饲养环境和营养管理、神经内分泌变化、机械损伤、有害微生物感染等均可诱发乳房炎,根本原因是乳腺抵抗外源微生物或有害物质的能力下降,导致乳腺发生炎症反应[35]。奶牛围产期经历干奶-分娩-泌乳的剧烈变化,营养物质摄入不足,机体抗氧化和免疫力均下降,是乳房炎的高发期之一[36]。围产期奶牛脂质代谢异常旺盛,NEFA在肝脏氧化供能过程中产生大量氧自由基,而此阶段奶牛抗氧化屏障较弱,这些自由基不能被及时清除,随血液循环到达身体各器官。随着泌乳启动,乳腺血液循环显著加快,自由基在乳腺蓄积,诱发氧化应激,损伤乳腺上皮细胞,降低乳腺抗氧化和免疫功能,最终导致乳房炎的发生[37]。
动物抗氧化屏障包括抗氧化酶系和非酶抗氧化物质,奶牛体内主要的抗氧化酶有谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)等,非酶抗氧化物质有维生素E、硒(Se)、类胡萝卜素等。核因子E2相关因子2-抗氧化反应元件(nuclear factor erythroid 2-related factor 2-antioxidant response element,Nrf2-ARE)通路在动物抗氧化应激中发挥关键作用,GSH-Px、SOD和CAT等基因的表达均受Nrf2-ARE调控[38]。Nrf2是细胞抗氧化应激的关键转录因子(图4),当细胞需要增强抗氧化能力时,Nrf2与其伴侣蛋白Keap1解偶联而被激活,Nrf2转入核内与Maf蛋白结合形成异二聚体结构,此异二聚体可识别并结合ARE,进而启动相关抗氧化酶基因的转录[35,39]。

图4 氧化应激与细胞Nrf2信号通路[39]
目前奶牛Nrf2相关研究主要集中于肝脏和乳腺。研究表明,高浓度NEFA(2.4 mmol/l)可激活ROS-p38-p53/Nrf2通路,诱导体外培养奶牛肝细胞凋亡[40],由此可见,NEB奶牛体脂动员产生的NEFA可损伤肝细胞,进而降低肝脏功能,但NEFA能否通过Nrf2通路诱导奶牛乳腺上皮细胞凋亡尚未见报道。奶牛围产期肝脏Nrf2表达量显著升高,这可能是围产期奶牛肝脏抵抗氧化损伤和炎症反应的重要途径[41]。最新研究还证实,Nrf2通路是细胞维持Z氧化还原状态的主要途径,且其与细胞多种代谢过程和功能障碍密切相关,如内质网应激和细胞自噬等[38]。Schogor等[42]研究了亚麻粕对泌乳中后期奶牛乳腺组织抗氧化指标的影响,发现添加亚麻粕可提高奶牛乳腺组织Nrf2的mRNA丰度,增强乳腺抗氧化能力。奶牛发生乳房炎时,乳腺抵御病原微生物入侵的能力下降,一些有害微生物可损伤乳腺上皮细胞,而中国蜂胶可通过Nrf2通路减少损伤,并缓解炎症反应[43]。结合上述围产期奶牛乳腺、肝脏和其它动物乳腺Nrf2通路的相关研究可以推断,Nrf2通路在奶牛围产期乳腺氧化应激和乳房炎的发生发展过程中发挥重要作用,其机制仍需进一步解析。
2 蛋白质代谢
与NEB相比,NPB并未得到足够重视,相关研究相对较少。Bell等[44]研究了80头围产期奶牛MP平衡的动态变化,发现围产期后期普遍存在NPB,且产后第7 d最为严重,MP缺乏量可达600 g/d。当以粗蛋白质(CP)平衡为衡量指标时,CP负平衡出现于产前1周,但此时并不严重,且产后0~7 d负平衡最为严重。奶牛血浆3-甲基组氨酸(3-methylhistidine,3-MH)含量常被认为是机体蛋白质动员和MP平衡的标志物,但比较营养评估和血浆3-MH的变化规律发现,二者的动态变化并不同步,血浆3-MH含量在围产前期已显著上升,峰值出现于分娩当天,而MP负平衡最低值一般出现于产后0~7 d(见图5)。为明确围产期奶牛蛋白质和脂肪动员与血清BHBA浓度间的关系,荷兰乌德勒支大学的研究人员发现:①奶牛分娩前已发生蛋白质动员,且早于体脂动员,这说明蛋白质动员并不仅仅是NEB的结果;②血清BHBA含量高的奶牛,其血浆3-MH浓度反而较低,因此肌肉蛋白质动员可一定程度抑制酮体的产生,此假设尚待研究确证[45]。

图5 奶牛围产期代谢蛋白质平衡(A)和血浆3-甲基组氨酸浓度(B)的动态变化[44,46]
奶牛干奶期和泌乳早期蛋白质营养平衡影响整个泌乳周期的泌乳性能和机体健康[47],因而科学合理的营养调控至关重要。基于奶牛围产期的生理代谢特点和蛋白质代谢的基本原理,现有营养策略集中于:①瘤胃微生态调控,以保障瘤胃健康为基础,以增加MCP和能量前体物质产量为目标;②适当提高日粮过瘤胃蛋白(RUP)含量,提高机体MP中RUP的比例,以弥补MCP产量不足;③低蛋白质日粮补充过瘤胃氨基酸,保证日粮其它营养素和氨基酸平衡,提高小肠蛋白质利用率,并可降低氮排泄。关于奶牛围产期蛋白质高效利用及机体健康的营养策略已有部分经典综述[4,46-47],不再详述。
3 钙代谢
除NEB和NPB外,大多数经历围产期的奶牛面临钙负平衡的问题,且以高产奶牛最为严重[48]。胚胎骨骼发育需要从胎盘摄取大量的钙,随分娩临近,奶牛钙需要量增加;奶牛分娩后启动泌乳,牛乳中钙的浓度约为30 mmol/l[49],机体钙的输出急剧增加,而钙摄入量明显不足,且由于内分泌和其它因素的综合调控,钙利用率较低,因此血钙在短时间内快速下降,导致低钙血症(hypocalcemia)的发生[50]。生产中,低钙血症又分为亚临床性低钙血症(subclinical hypocalcemia)和临床性低钙血症(clinical hypocalcemia),后者又被称为乳热病(milk fever)。钙参与多种细胞信号转导通路,奶牛发生低血钙症时,白细胞活化过程变慢,影响免疫细胞对有害刺激的响应,诱发免疫抑制,严重威胁奶牛健康,限制泌乳性能的高效发挥[51]。
关于动物肠道钙吸收机制及其调控机理已有一些经典研究和综述[53-54],相关研究一直在持续,并陆续有新的通路或调控蛋白被发现。甲状旁腺激素(parathyroid hormone,PTH)在奶牛围产期钙适应和稳态中发挥重要作用,为满足泌乳启动的钙需要,甲状旁腺分泌大量PTH,PTH通过3条途径调控钙代谢[55]:①降低尿钙损失;②刺激骨钙重吸收;③增加1,25-(OH)2D3(维生素D的活性形式)合成,促进小肠钙的主动吸收。基于奶牛产前机体钙循环通路(图6),为调控奶牛围产期钙平衡,已有一些营养策略用于生产实践,概括如下:①围产前期饲喂低钙日粮。奶牛处于轻微的钙负平衡可促进PTH分泌,在泌乳启动前将奶牛钙吸收和1,25-(OH)2D3合成调控到较高水平,但考虑到饲料原料的钙含量,低钙日粮难以配制;②降低日粮阴阳离子差(dietary cation-anion difference,DCAD)。很多研究已证明,奶牛产前饲喂DCAD<0的日粮时,可有效预防低钙血症的发生[56],但为防止奶牛机体发生较为严重的酸中毒,DCAD最好不要低于-150;③日粮添加维生素D及其代谢产物,促进日粮钙利用;④其它策略:奶牛产后注射PTH,或口服钙制剂,考虑到工作量和成本,仅适用于病牛治疗,不适用于规模化推广[55]。
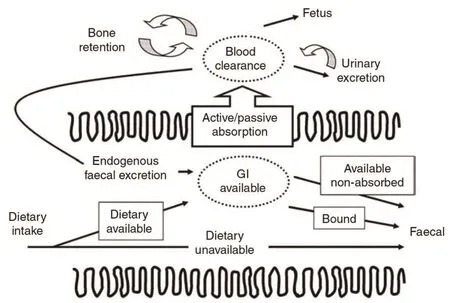
图6 奶牛产前机体钙循环通路[52]
4 小结
围产期是奶牛代谢病高发期,如酮病、脂肪肝、瘤胃酸中毒、真胃移位、乳房炎、低血钙症等,其发生均与奶牛机体营养素负平衡密切有关。受神经内分泌、信号分子和其它因素的影响,奶牛围产期DMI明显不足,且营养利用率下降,不能满足产前胎儿发育及产后泌乳需要,导致机体能量、蛋白质、钙等营养素负平衡,影响肝脏、瘤胃及其它器官的代谢机能,机体抗氧化和免疫功能下降,诱发各种代谢性疾病,威胁整个泌乳期的奶牛健康和高效生产[57]。因此,加强奶牛围产期营养管理首要任务是提高奶牛围产期DMI,保障瘤胃和肝脏健康及生理功能,缓解营养素负平衡。
