紫外-微波诱变选育抗菌肽高产菌株及抗菌肽性质分析
2018-12-29朱永明董伟洁姜军坡王世英朱宝成
■朱永明 董伟洁 姜军坡王世英 朱宝成
(河北农业大学生命科学学院,河北保定071001)
微生物源抗菌肽是由微生物分泌的可杀灭或抑制其他细菌、真菌的小分子多肽,相对分子质量一般介于2 000~7 000 Da之间[1]。抗菌肽具有无残留、无毒害、无耐药性等优点,适合应用于畜牧养殖业[2-3]。
对微生物进行诱变选育是提高微生物胞外产物产量的一种有效方法。杜康等[4]对巴氏芽孢杆菌YBB进行微波诱变,筛选出两株产脲酶更高的突变菌株,诱变菌株尿素分解能力较原菌株提高1.5倍左右,矿化能力提高114%;郭宏文等[5]对产异淀粉酶的黄杆菌菌株D15进行紫外线诱变处理,获得了1株产异淀粉酶活力较高且产酶稳定的菌株ZYF32,比出发菌株提高了3.23倍;秦艳飞等[6]经紫外-微波复合诱变,获得1株PUM-13菌株,使那西肽摇瓶产量达883.450 μg/ml,比出发菌株的产量提高了17.14%。
Bacillus velezensisTu-569菌株是本研究组从幼兔肠道中分离出的一株对大肠杆菌有抑菌活性的芽孢杆菌[7]。向断奶仔兔日粮中添加Tu-569菌株制备的菌剂,可改善断奶仔兔的生产性能,降低幼兔腹泻率和死亡率[8]。本研究拟以抑制大肠杆菌能力为指标,对Tu-569菌株进行紫外-微波诱变选育,并以遗传稳定性试验评价正突变菌株的稳定性,以获得抑菌能力更强、遗传更稳定的高产菌株;通过观察高产菌株的菌落和菌体形态,以生理生化试验和API 50 CH细菌鉴定条综合评测高产菌株生理生化特性,结合16S rDNA序列分析来鉴定高产菌株的种属;通过考察硫酸铵盐析、透析处理、蛋白酶处理、加热处理、缓冲液pH值等对突变菌株胞外产抑菌活性物质的影响,探索抑菌物质的性质,为将其开发为抗菌肽制剂奠定基础。
1 材料与方法
1.1 试验材料
供试菌种:Tu-569(Bacillus velezensis),由河北农业大学制药工程系实验室分离并保存。
指示菌株:大肠杆菌(Escherichia coli)ETEC-44155,由河北农业大学制药工程系实验室保存。
API 50 CH细菌鉴定条,由法国生物梅里埃公司生产。
NB培养基、LB培养基、NA培养基的组成参考文献[9],发酵培养基的组成参考尚伟(2012)[7]。
生理生化特性试验所用试液的配制参考文献[10]。
1.2 试验方法
1.2.1 Tu-569菌株生长曲线的绘制
从Bacillus velezensisTu-569菌株斜面上挑取部分菌苔,接种于NB培养基中,装瓶量为50 ml/250 ml,于37℃、180 r/min培养12 h,即得种子液。
按2%的接种量向装瓶量为50 ml/250 ml的NB培养基中接入种子液,于37℃、180 r/min培养;每隔3 h取样一次,以NB培养基为空白对照,测定600 nm下的OD值并绘制Tu-569菌株的生长曲线。
1.2.2 Tu-569菌株的紫外诱变选育
1.2.2.1 菌悬液的制备
将50 ml Tu-569菌株的种子液加入100 ml离心管中,9 000 r/min离心6 min,收集菌体。用无菌生理盐水洗涤2次,再向菌体中加入适量的生理盐水,振荡,配制成浓度为108CFU/ml的菌悬液,备用。
1.2.2.2 紫外诱变处理
取无菌平皿(内径为9 cm),加入上述菌悬液5 ml,然后放入磁力搅拌子,置于磁力搅拌器上。将紫外灯(20 W)预热30 min后,进行不同时间(0~360 s)的紫外照射,照射距离为30 cm,每隔60 s取样一次。将上述诱变处理后的菌悬液稀释至10-6后涂NA平板;注意避光操作。以未经紫外线处理的菌液作为对照,稀释至10-6后涂NA平板。将上述NA平板置37℃培养;处理组NA平板需避光培养;24 h后观察菌株生长情况,并统计菌落数,计算致死率,绘制致死率曲线。
致死率(%)=(对照原菌液中的活菌数-处理后菌液中的活菌数)/对照原菌液中的活菌数×100。
1.2.2.3 初筛
大肠杆菌平板的制备方法参考文献[11]。挑取处理组NA平板上生长的菌落转接于E.coli平板,培养24 h,测量菌落直径和抑菌圈直径,并以后者与前者之比计算圈径比;将产生抑菌圈的菌株保存于NA斜面。在同一E.coli平板上同法测量Tu-569菌株产生的圈径比;以Tu-569菌株对应圈径比为基准,选取比其更大者作为复筛菌株。
1.2.2.4 复筛
将复筛菌株和Tu-569菌株分别接种于装瓶量50 ml/250 ml的NB培养基中,37℃,180 r/min培养12 h作为种子液。将种子液按2%接种量接种于发酵培养基中,装瓶量为50 ml/250 ml,30 ℃,180 r/min培养24 h,即得发酵液。取发酵液10 000 r/min离心20 min,取上清液待用。以琼脂打孔扩散法[12]测定各菌株发酵液的抑菌活性。选取比Tu-569菌株抑菌活性更大的菌株,作为正突变菌株,进行遗传稳定性的测定。
1.2.2.5 突变菌株遗传稳定性的测定
将正突变菌株与Tu-569菌株同时于NA斜面上连续传代10次;利用琼脂打孔扩散法测定各代菌株的抑菌活性,以抑菌活性为指标来评价正突变菌株的遗传稳定性。
1.2.3 微波诱变选育高产菌株
以紫外诱变获得的正突变菌株中遗传最稳定且活性较高者参考文献[13]进行微波诱变。制备该菌株的菌悬液,用无菌生理盐水将其稀释至10-6;吸取500 μl加入1.5 ml的EP管内。设置微波炉参数为P50,每次微波辐射EP管(于碎冰盒中进行冰浴)10 s。进行不同次数(1~10次)的微波辐射。每次辐射均使用新制碎冰,以减少微波热效应引起的菌体死亡。诱变结束后,吸取100 μl均匀涂布于NA平板上,于37℃静置培养24 h。观察菌株生长情况,并统计菌落数,计算致死率,绘制致死率曲线。
按1.2.2.3、1.2.2.4节和1.2.2.5节的方法对NA平板上的菌株进行初筛、复筛和遗传稳定性评价。以其中遗传稳定性最佳且抑菌活性较高者作为高产菌株。
1.2.4 高产菌株的鉴定
1.2.4.1 菌落和菌体形态观察
将高产菌株划线接种于NA培养基上,37℃培养48 h,观察菌落的大小、表面、边缘、透明度、隆起形状等形态特征。以革兰氏染色法观察菌体形态和芽孢形态。
1.2.4.2 生理生化特性测定
生理生化特性试验参考文献[10]中相关内容进行。
分别将Tu-569和高产菌株接种于API 50 CH细菌鉴定条上,37℃孵育24 h,观察颜色变化,以确定对不同碳源的利用情况。
1.2.4.3 16S rDNA序列分析
参照文献[14]进行高产菌株总DNA的提取,并进行16S rDNA的扩增。将PCR产物送华大基因测序,将所测出的16S rDNA序列提交到GenBank中进行BLAST比对,选取相似性较高的模式菌株序列,利用Mega 5.0软件构建系统发育树。
1.2.5 高产菌株胞外产抑菌物质的性质研究
1.2.5.1 硫酸铵盐析抑菌物质的效果
按1.2.2.4节的方法制备发酵上清液。分别向100.0 ml发酵上清液中加入硫酸铵,使其达到不同的饱和度,并将其4℃静置过夜后,于10 000 r/min离心20 min,可得上清液和沉淀。所得沉淀用10.0 ml的Tris-HCl(pH值7.4)溶液溶解,即得溶解物。采用琼脂打孔扩散法测定溶解物和上清液抑制大肠杆菌的活性。
1.2.5.2 透析处理盐析沉淀的效果
将截留分子量为3.5 kDa和8.0 kDa的透析袋剪成适当长度(15 cm左右)。8.0 kDa透析袋使用前需在含有2%(W/V)碳酸氢钠和1 mmol/l EDTA(pH值8.0)的溶液中加热煮沸10 min;用蒸馏水将其清洗3次;再在1 mmol/l EDTA(pH值8.0)中煮沸10 min。3.5 kDa透析袋使用前只需于蒸馏水中煮沸10 min即可。
按1.2.5.1节中方法制备70%饱和度硫酸铵盐析对应的溶解物,作为处理液,取20 ml转移至透析袋中。在透析试验的整个过程中,透析袋始终浸没在溶液中,取透析袋的时候必须戴手套。将处理液加入透析袋中透析24 h;前4 h每隔1 h更换ddH2O 1次;之后4~6 h换ddH2O 1次,以彻底除去硫酸铵。透析完成后,测量透析袋内截留液的体积;以透析前加入处理液的体积为基准,计算截留液体积增大的倍数,作为稀释倍数。按相同的稀释倍数稀释处理液,作为同比稀释液。测定处理液、截留液和同比稀释液的抑菌活性。
1.2.5.3 蛋白酶处理对抑菌物质活性的影响
将胰蛋白酶和胃蛋白酶分别用pH值8.0和pH值2.0的磷酸氢二钠-柠檬酸缓冲液配制成10 000 U/ml的溶液,并依次稀释成1 000、100 U/ml的蛋白酶溶液。在3个不同的1.5 ml EP管中先加入500 μl按1.2.5.1节中方法制备的70%饱和度硫酸铵盐析对应的溶解物,再加入500 μl蛋白酶溶液,使其终浓度达到5 000、500、50 U/ml。37 ℃孵育不同时间(30、60、90 min和120 min)后,分别加入500 μl酶反应终止液,混合均匀,即得酶解液。
除以500 μl水代替500 μl蛋白酶溶液外,其余同上述操作,所得溶液作为阳性对照液。
除以500 μl水代替500 μl溶解物外,其余同上述操作,所得溶液作为阴性对照液。
以琼脂打孔扩散法测定阳性对照液、阴性对照液和酶解液的抑菌圈面积;不同浓度酶解液的抑菌圈面积与相应阴性对照之差即为抑菌物质在该浓度酶解液对应的抑菌活性。
1.2.5.4 pH值对抑菌物质活性的影响
取500 μl按1.2.5.1节中方法制备的70%饱和度硫酸铵盐析对应的溶解物,加入1.5 ml EP管中,再按1∶1体积分别加入磷酸氢二钠-柠檬酸缓冲液(pH值2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0),混合均匀后,4℃静置1 h,作为处理液。以相应pH值的磷酸-柠檬酸缓冲液代替溶解物作为阴性对照;以蒸馏水代替磷酸-柠檬酸缓冲液作为阳性对照。以琼脂打孔扩散法测定处理液、阴性对照、阳性对照的抑菌圈面积;处理液的抑菌圈面积与相应阴性对照之差即为抑菌物质在该pH值下对应的抑菌活性。
1.2.5.5 加热处理对抑菌物质活性的影响
取1 ml按1.2.5.1节中方法制备的70%饱和度硫酸铵盐析对应的溶解物,分别在40、60、80、100℃和121℃下加热处理30、60 min,然后立即放入碎冰盒中冷却,静置1 h后即得处理液。采用琼脂打孔扩散法测定处理液抑菌活性,以未处理的溶解物作为阳性对照。
2 结果与分析
2.1 Tu-569菌株的生长曲线
Tu-569菌株的生长曲线如图1所示。由图1可知,0~6 h为延滞期;7~15 h为对数期,此时菌体生长旺盛;16~25 h为稳定期;26 h后进入衰亡期。诱变一般选择对数生长期中后期,这时菌体生长速度快,因此选用种龄12 h的种子液进行诱变选育。
2.2 Tu-569菌株的紫外诱变结果
由图2可知,随着紫外线照射时间的增加,Tu-569菌株的致死率逐渐增大,360 s时致死率达到100%。紫外线照射180 s时,致死率为63.3%;紫外线照射240 s时,致死率达到81.2%;紫外线照射300 s时,致死率为95.7%。一般认为当致死率在80%~90%之间时,菌株的变异正突变概率大且可以稳定遗传[15]。因此,选择紫外线照射时间为240 s时的菌株进行初筛。

图1 Tu-569菌株的生长曲线

图2 紫外诱变的致死率曲线
Tu-569菌株紫外诱变的初筛、复筛结果见表1。从结果可知,初筛得到9株圈径比大于原菌株Tu-569的正突变菌株,其中T-4M-5突变株的圈径比最大,达到2.20。复筛时,T-4M-5、T-4M-26、T-4M-11突变株的抑菌圈面积较大,分别是原菌株的1.79、1.69、1.61倍。

表1 Tu-569菌株紫外诱变初筛、复筛结果
T-4M-5、T-4M-11、T-4M-26突变株的遗传稳定性结果见表2。连续传代10次后,T-4M-5、T-4M-11、T-4M-26突变株抑菌圈面积较第一代分别降低了4.0%、20.8%、24.0%,说明T-4M-11、T-4M-26遗传稳定性较差,而T-4M-5菌株遗传稳定性良好。故选择T-4M-5菌株进行微波诱变。

表2 突变菌株遗传稳定性结果
2.3 微波诱变选育高产菌株
用微波诱变T-4M-5菌株的致死率曲线如图3所示。随着处理时间的增加,致死率逐渐升高;在微波辐照30~70 s范围内,致死率上升较快;微波处理50 s时,致死率为62.6%;微波处理60 s时,致死率为78.2%;当微波处理70 s时,致死率为85.2%;当微波处理90 s时,致死率达到100%。选择微波处理60 s和70 s的菌株进行初筛。

图3 T-4M-5菌株微波诱变致死率曲线
T-4M-5菌株微波诱变的初筛、复筛结果见表3。筛选出12株圈径比较大的突变菌株,其中T-70-1突变株的圈径比最大,达到3.10。经复筛后T-70-1、T-70-2、T-70-3、T-60-5突变株的抑菌圈面积分别是出发菌株的1.53倍、1.34倍、1.47倍、1.33倍。

表3 T-4M-5菌株微波诱变初筛、复筛结果
将T-70-1、T-70-2、T-70-3、T-60-5突变株的遗传稳定性结果见表2。连续传代十次后,T-70-1、T-70-2、T-70-3、T-60-5突变株抑菌效果分别降低了5.6%、5.1%、9.8%、7.4%,说明这四株菌遗传稳定性较好,其中T-70-1菌株的抑菌圈面积最大,达到343.3 mm2。因此选择T-70-1菌株作为高产菌株进行后续研究。
2.4 高产菌株的鉴定
2.4.1 高产菌株的菌体形态与菌落形态
高产菌株T-70-1的菌落、菌体形态如图4所示。由结果可知,T-70-1菌株菌落呈乳白色,近圆形,培养后期边缘突出呈火山口状,与培养基结合紧密难挑取,质地黏稠。T-70-1菌株的革兰氏染色呈阳性,菌体为杆状,芽孢中生。与原菌株Tu-569相比,无差别。

图4 T-70-1菌株的菌落与菌体形态
2.4.2 高产菌株的生理生化试验
原菌株Tu-569和高产菌株T-70-1的生理生化特性测定结果见表4和图5。由表4可知,两菌株有以下不同之处:T-70-1菌株不产接触酶,而Tu-569菌株产接触酶;T-70-1菌株可在含10%、15%NaCl的培养基中生长,而Tu-569菌株不能。除此之外的生理生化特性,两菌株相同。由图5可知,T-70-1菌株可利用D-半乳糖(10)和D-塔格糖(42)生长,而Tu-569菌株不能。两菌株都可利用淀粉、肌醇、D-果糖等24种碳源;都不能利用D-阿拉伯糖、L-山梨糖、L-鼠李糖等23种碳源。依据T-70-1菌株的生理生化特性,可将其归为芽孢杆菌属。

表4 Tu-569菌株和T-70-1菌株的生理生化试验对比

图5 24 h API 50试纸条颜色反应结果
2.4.3 高产菌株系统发育树的构建
高产菌株的16S rDNA序列相似性分析结果见表5,构建的系统发育树见图6。供试菌株T-70-1与15株模式菌株的16S rDNA序列的相似度均高于90%,其中T-70-1菌株与Bacillus velezensis模式菌株CR-502的16S rDNA序列的相似性最高,达到99.93%。由系统发育树可知,T-70-1菌株与Bacillus velezensis的同源性最高。故初步鉴定T-70-1菌株为Bacillus velezensis。
2.5 高产菌株胞外产抑菌物质的性质分析
2.5.1 硫酸铵盐析抑菌物质的结果
不同饱和度硫酸铵盐析T-70-1菌株胞外产抑菌物质的结果见图7。由结果可知,在30%~70%的硫酸铵饱和度范围内,随着硫酸铵饱和度的增加,溶解物的抑菌活性逐渐增大;当硫酸铵饱和度达到70%时,抑菌活性最大,抑菌圈面积为361.7 mm2;在70%~100%的硫酸铵饱和度范围内,随着硫酸铵饱和度的增加,溶解物的抑菌活性稍有波动,但是差异不显著(P>0.05)。故选取70%硫酸铵饱和度为沉淀抑菌物质的最佳饱和度。

表5 高产菌株T-70-1的16S rDNA序列的相似性分析结果

图6 高产菌株T-70-1的系统发育树
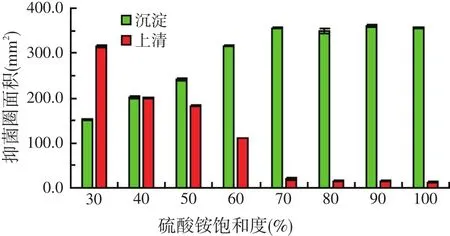
图7 硫酸铵饱和度对盐析后抑菌物质活性的影响
2.5.2 透析袋截留分子量对截留液活性的影响
采用截留分子量为3.5、8.0 kDa的透析袋处理菌株硫酸铵盐析溶解物的结果见图8,硫酸铵溶解物经3.5 kDa透析袋透析处理后,截留液仍具有抑菌活性,其对应的抑菌圈面积为稀释液的81.6%;8.0 kDa透析袋的截留液没有形成抑菌圈,无抑菌活性。故采用3.5 kDa透析袋可有效截留T-70-1菌株胞外产抑菌物质,推测其相对分子质量在3.5~8.0 kDa之间。
2.5.3 蛋白酶处理对抑菌物质活性的影响
胰蛋白酶对T-70-1菌株胞外产抑菌物质活性的影响见图9。由结果可知,在50~5 000 U/ml的浓度范围内,随着胰蛋白酶酶活力的增加,在相同反应时间下,酶活力越高,则抑菌物质的活性越低;酶活力相同时,随着反应时间的增加,抑菌活性也逐渐降低。蛋白酶浓度为50 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的90.7%;当蛋白酶浓度增加到500 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的76.7%;当胰蛋白酶浓度增加到5 000 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的62.4%。

图8 T-70-1菌株胞外产抑菌物质的透析试验结果
胃蛋白酶对T-70-1菌株胞外产抑菌物质活性的影响见图10。由图10可知,在50~5 000 U/ml的浓度范围内,随着胃蛋白酶酶活力的增加,在相同反应时间下,酶活力越高,则抑菌物质的活性越低;酶活力相同时,随着反应时间的增加,抑菌活性也逐渐降低。胃蛋白酶浓度为50 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的83.4%;当胃蛋白酶浓度增加到500 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的72.3%。当胃蛋白酶浓度增加到5 000 U/ml时,反应120 min后,抑菌物质所对应抑菌圈面积为阳性对照抑菌圈面积的49.1%。
综上所述,高浓度的胰蛋白酶或胃蛋白酶均可使T-70-1菌株胞外产抑菌物质活性降低,说明抑菌物质分子结构中含有可被两种酶作用的肽键。而与中等浓度的两种蛋白酶反应120 min后,抑菌物质仍有较高活性,说明抑菌物质对胰蛋白酶和胃蛋白酶不敏感。

图10 胃蛋白酶对T-70-1菌株胞外产抑菌物质活性的影响
2.5.4 pH值对抑菌物质活性的影响
pH值对高产菌株T-70-1胞外产抑菌物质活性的影响如图11所示。在pH值2.0~7.0范围内,随着pH值的上升,抑菌活性也逐渐增强;在pH值7.0~10.0范围内,随着pH值的上升,抑菌活性逐渐降低。当pH值为7.0时抑菌活性最高,抑菌圈面积为406.6 mm2;在pH值2.0时抑菌活性最低,为阳性对照的38.5%;当pH值为10.0时其抑菌圈面积为阳性对照的47.8%。当pH值为3.0时其抑菌圈面积为阳性对照的51.5%;当pH值为9.0时其抑菌圈面积为阳性对照的53.0%,故T-70-1菌株产胞外抑菌物质在pH值3.0~9.0的范围内,有较高的抑菌活性。

图11 pH值对T-70-1菌株胞外产抑菌物质活性的影响
2.5.5 加热处理对抑菌物质活性的影响
如图12所示,当加热温度为40、60℃时,分别处理30 min和60 min后,抑菌圈面积无明显变化。当加热温度为80℃时,处理30 min后,抑菌圈面积降低了11.7%;加热60 min后,抑菌圈面积降低了13.7%。当加热温度为100℃时,处理30 min后,抑菌圈面积降低了25.1%;加热60 min后,抑菌圈面积降低了30.1%;121℃处理后,抑菌物质无抑菌活性。综上可知,菌株T-70-1胞外产抑菌物质对100℃以下温度有较强的耐受性。

图12 温度对T-70-1菌株胞外产抑菌物质活性的影响
3 讨论与结论
3.1 讨论
传统抗生素的大量使用导致的耐药性问题日益突出,严重威胁人们的健康;开发促生长、抗腹泻的新型饲料添加剂已成为研究热点。孙雪梅等[15]研究发现,在断奶仔猪教槽料和保育料中添加天蚕素抗菌肽(300 g/t),有明显提高日增重和减少腹泻的功效。王曦尧[16]研究表明,日粮中添加抗菌肽(350 mg/kg)可明显促进吉戎兔生长,降低料重比。吕尊周等[17]用抗菌肽粗提物饲喂肉鸡发现抗菌肽可以抑制肠道中大肠杆菌,促进乳酸杆菌等,提高饲料转化率,进而提高蛋鸡生产性能,改善蛋鸡产蛋性能和蛋品质。本研究所使用的诱变原始菌株Tu-569可改善断奶仔兔的生产性能,降低幼兔腹泻率和死亡率[8],其作为野生型菌株,抑菌活性尚有提高的空间。
选育高产菌株可有效降低发酵成本。使用单一诱变育种方法,存在突变无法定向、突变率低、遗传不稳定等缺点[18]。采用复合诱变的方法,能更好地改善菌株的性能。何淼等[19]以链霉菌SN03菌株为出发菌株,利用紫外线诱变结合微波诱变的处理方法,获得了高效菌株UV-1-W3,其发酵液对蜡样芽孢杆菌的抑菌圈直径达到33.2 mm,抗菌活性比出发菌株提高了30.2%。李海娜[20]以乳酸链球菌ATCC11454为出发菌株,经紫外线、微波、亚硝酸钠并用的方法最终选育出一株遗传特性稳定的高产菌株,该菌株效价达到6 200 IU/ml,较原始菌株提高了5倍;通过10 L发酵罐中试生产Nisin效价达到9 600 IU/ml左右,大大降低了发酵成本。本研究通过对Tu-569菌株进行紫外-微波诱变,得到了1株性状稳定的高产菌株T-70-1,其抑菌活性是原菌株的2.74倍。
T-70-1菌株胞外产抑菌物质可被70%饱和度的硫酸铵盐析;该抑菌物质的相对分子质量在3.5~8.0 kDa之间;抑菌物质分子结构中含有可被胰蛋白酶或胃蛋白酶水解的肽键;故T-70-1菌株胞外产抑菌物质为抗菌肽。Tu-569菌株胞外产抗菌物亦为抗菌肽[7]。两菌株的抗菌肽对应相对分子质量均在3.5~8.0 kDa之间。
Tu-569菌株[7]胞外产抗菌肽在pH值9.0时抑菌活性最高,在pH值5.0~10.0的范围内,有较高的抑菌活性;而T-70-1菌株胞外产抗菌肽在pH值7.0时抑菌活性最高,在pH值3.0~9.0的范围内,有较高的抑菌活性。畜禽动物胃液pH值在1.5~2.0之间,肠液pH值一般为8.0~9.0,故胃肠液pH值环境中T-70-1菌株胞外产抗菌肽能保持较高活性。畜禽动物胃液中胃蛋白酶浓度约为500 U/ml;胰蛋白酶浓度约为250 U/ml[21]。Tu-569菌株[7]胞外产抗菌肽用500 U/ml的胃蛋白酶处理120 min后,抑菌活性为原来的18.8%;用250 U/ml的胰蛋白酶处理120 min后,抑菌活性为原来的33.3%。T-70-1菌株胞外产抗菌肽经浓度为500 U/ml胰蛋白酶处理120 min后,抑菌活性是原来的76.7%;抗菌肽经浓度为500 U/ml胃蛋白酶处理120 min后,抑菌活性为原来的72.3%。因此,与胃肠液中存在的蛋白消化酶发生作用后,T-70-1菌株胞外产抗菌肽也保留着大部分的抑菌活性。T-70-1菌株胞外产抗菌肽很适宜在畜禽胃肠道环境中发挥抑菌作用。Tu-569菌株[7]胞外产抗菌肽经100℃处理30 min后,抑菌活性完全丧失,而T-70-1菌株胞外产抗菌肽经100℃加热60 min后,抑菌圈面积仅降低了30.1%,耐热性提高,有利于将其制备成粉剂。
综上所述,T-70-1菌株胞外产抗菌肽耐受畜禽动物胃肠液pH值环境,适宜在畜禽胃肠道环境中发挥抑菌作用,还可耐受高温处理,为将其制备成新型饲料添加剂并应用于畜禽养殖奠定了基础,有着良好的应用前景。
3.2 结论
经紫外-微波诱变获得了1株高产抗菌肽、遗传稳定的T-70-1菌株,与原菌株Tu-569同属于Bacillus velezensis种属。T-70-1菌株除不产接触酶、可耐受10%和15%的NaCl、可利用D-半乳糖和D-塔格糖外,其余生理生化特性与Tu-569菌株均相同。与原菌株Tu-569相比,T-70-1菌株胞外产抗菌肽抑菌活性更强,是原菌株的2.74倍,性质更为稳定,具体表现在更耐受胃肠道环境,更为耐热,可将其制备成粉剂应用于畜牧养殖业。
