江西省猪链球菌临床分离株毒力基因检测及药物敏感性分析
2018-12-29洪家兵黄奕雯张学良
洪家兵,陶 政,黄奕雯,王 萍,张学良
(1.江西农业大学动物科学技术学院,江西 南昌 330045;2.南昌市农村综合产权交易中心,江西 南昌 330038)
猪链球菌病是一种由猪链球菌引起的人兽共患传染病,主要引起猪脑膜炎、关节炎、心内膜炎、败血症及突然死亡。随着中国规模化养猪业的发展,猪链球菌病的流行情况呈逐步上升趋势,该病已成为中国养猪生产中的常见病和多发病,对中国养猪业的发展有较大的威胁。猪链球菌是一种新出现的人兽共患病原菌,可通过被感染的猪或者受污染的生猪肉产品传播给人。目前国内有不少关于人感染猪链球菌病的报道[1-2],猪链球菌病具有很重要的公共卫生学意义。
虽然现在已有许多的猪链球菌疫苗被研究出来,且被广泛的应用到养猪过程中。但由于猪链球菌包含有35个血清型(1型~34型及1/2型)及相当数量难以定型的菌株,而目前市场上的猪链球菌疫苗主要是针对致病性最强的2型猪链球菌,疫苗很难有效的帮助养殖户预防猪链球菌病。故在养殖过程中养殖户更倾向于采用抗生素来防治猪链
球菌病,但是伴随着抗生素的大量使用,猪链球菌的耐药形式也变得愈来愈严峻,这给猪链球菌病的防治带来了巨大的威胁。目前国内外已经有不少关于猪链球菌的调查研究[3-5],江西省是养猪大省,江西地区此类报告罕见。本试验采用K-B纸片法测定从2014-2016年江西地区不同规模化猪场疑似猪链球菌病的病例分离的62株猪链球菌对16种抗菌药物的敏感性,并采用PCR技术对猪链球菌毒力基因进行检测,以期为江西乃至全国猪链球菌病的防治提供参考。
1 材料与方法
1.1 菌株来源 从2014-2016年江西各地区疑似猪链球菌病的病猪中分离得到的62株猪链球菌。
1.2 主要试剂及抗菌药物药敏试纸 2×Taq PCR Master Mix,购自南昌沃玛科技有限公司;胰蛋白胨大豆琼脂(TSA)、胰蛋白胨大豆肉汤(TSB)培养基、琼脂粉,均购自南昌天沃科技有限公司;阿莫西林(AMX,10 μg/片)、链霉素(SM,10 μg/片)、青霉素(PEN,10 μg/片)、四环素(TET,30 μg/片)、克林霉素(CM,15 μg/片)、头孢唑啉(CZ,30 μg/片)、头孢噻肟(CTX,30 μg/片)、复方新诺明(SXT,25 μg/片)、庆大霉素(GEN,10 μg/片)、阿米卡星(AN,30 μg/片)、恩诺沙星(ENR,5 μg/片)、万古霉素(VAN,30 μg/片)、红霉素(ERY,15 μg/片)、强力霉素(DOX,30 μg/片)、环丙沙星(CIP,5 μg/片)、氟苯尼考(FFC,30 μg/片),均购自杭州天和微生物试剂有限公司。
1.3 方法
1.3.1 毒力基因检测 根据文献中[6-7]已公布的猪链球菌毒力基因 gdh、mrp、fbps、orf2、epf、sly 的引物序列,委托生工生物工程(上海)股份有限公司合成6对特异性引物,引物序列信息见表1。采用25 μL的反应体系(2 ×Taq PCR Master Mix 12.5 μL,上、下游引物各1 μL,DNA 模板2 μL,灭菌双蒸水加至25 μL),PCR反应条件:94℃预变性5 min;94℃变性 40 s, 各毒力基因(gdh、mrp、fbps、orf2、epf、sly)分别退火 40 s、35 s、35 s、45 s、40 s、30 s(退火温度见表 1),分别于 72 ℃ 延伸 45 s、35 s、45 s、50 s、45 s、90 s,共35个循环;72℃再延伸10 min。扩增产物通过1.0%琼脂糖凝胶电泳进行鉴定,将电泳后凝胶放置在凝胶成像系统中,拍照并保存。

表1 毒力基因检测引物
1.3.2 药物敏感性试验 采用世界卫生组织(WHO)推荐的K-B纸片法测定阿莫西林(AMX)、链霉素(SM)、青霉素(PEN)等16种抗菌药对分离菌的抑菌圈大小。并参照美国临床实验室标准委员会(CLSI)公布的标准(表2),通过抑菌圈的大小来判断药物的敏感性。以敏感、中介、耐药3种形式对抑菌圈大小进行判定。
2 结果
2.1 毒力基因测定 通过PCR技术对62株猪链球菌的 6 种毒力基因 mrp、orf2、gdh、sly、fbps、epf进行检测。结果表明,所有毒力基因均被检出,谷氨酸脱氢酶gdh基因(62/100%),溶菌酶释放蛋白mrp基因(47/75.8%),纤连结合蛋白 fbps基因(36/58.1%),毒力相关序列 orf2基因(34/54.8%),胞外蛋白因子epf基因(33/53.2%),溶血素sly基因(14/22.3%)。毒力基因电泳图见图1~6。
2.2 药敏试验 用16种临床常用抗菌药物对分离得到的62株猪链球菌进行药敏试验,发现猪链球菌江西株对其均有不同程度的耐药,主要对四环素、红霉素、克林霉素、强力霉素的耐药率较高,其中对四环素耐药率最高,达到了96.78%;对头孢唑啉、头孢噻肟、阿莫西林及万古霉素敏感程度较高,分别达到了85.49%、87.10%、82.26%和79.03%(见表3)。

表2 猪链球菌抗菌药物药敏试验结果判定标准
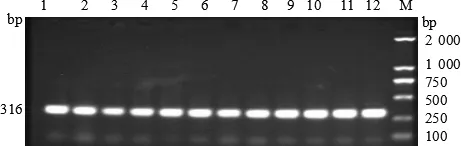
图1 猪链球菌分离株mrp基因扩增结果

图2 猪链球菌分离株fbps基因扩增结果
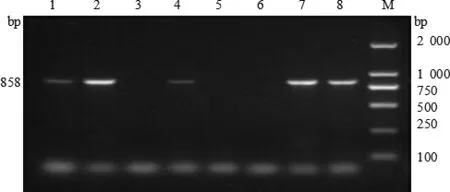
图3 猪链球菌分离株orf2基因扩增结果

图4 猪链球菌分离株epf基因扩增结果

图5 猪链球菌分离株sly基因扩增结果
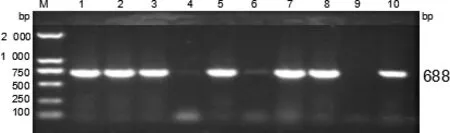
图6 猪链球菌分离株gdh基因扩增结果
本次试验分离的62株猪链球菌多重耐药情况(见表4、图7)。1耐菌株有1株,占1.61%;2耐菌株有2株,占3.23%;3耐到15耐菌株有56株,占90.32%;16耐菌株有3株,占4.84%。耐药情况主要集中在3耐到11耐之间,48.39%分离株为四环素-红霉素-强力霉素-克林霉素耐药。
3 讨论
据当前研究报道,猪链球菌的毒力因子主要包括:荚膜多糖(cps)、胞外蛋白因子(epf)、溶菌酶释放蛋白(mrp)、谷氨酸脱氢酶(gdh)、纤连蛋白和纤连蛋白原结合蛋白(fbps)、溶血素(sly)、毒力相关序列orf2等。猪链球菌致病性强弱主要与毒力因子具有相关性,gdh和cps不仅能够作为猪链球菌的种属鉴定和血清分型,也是重要的毒力因子[8-10]。在强毒株中,mrp和epf的检出率较高,但是在非致病猪链球菌中检出率较低,所以把mrp和epf作为猪链球菌毒力强弱的一个参考标准[11-12]。曾巧英等[13]通过相关研究证明,mrp可以独立作为2型猪链球菌的毒力基因。

表3 猪链球菌分离株对16种抗菌药物的药敏率 (%)
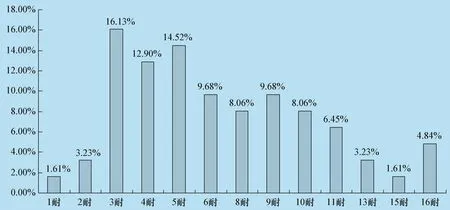
图7 猪链球菌分离株多重耐药情况

表4 猪链球菌分离株多重耐药情况
了解江西地区猪链球菌分离株的毒力基因分布情况,对于江西地区猪链球菌病的防治具有重要意义。通过PCR检测发现江西地区致病性猪链球菌分离株中的毒力基因型具有多样性,主要的毒力基因为:谷氨酸脱氢酶gdh基因(62/100%)、纤连结合蛋白fbps基因(36/58.1%)、毒力相关序列orf2基因(34/54.8%)、溶菌酶释放蛋白mrp基因(47/75.8%)。本试验结果与王红宝等[14]报道的山西地区,李小军[15]报道的上海地区致病性猪链球菌的毒力基因分布情况相比存在较大的差异性,说明致病性猪链球菌毒力基因型具有一定的区域性,提示相关部门应该加强对猪链球菌病的检疫防疫,以免造成大规模的暴发。
在当前的养殖过程中,抗生素被广泛的应用于治疗猪链球菌病。本试验选取16种抗菌药物,对分离得到的62株猪链球菌进行药物敏感性试验。结果表明,分离株对临床使用的16种抗菌药物均呈现不同程度的耐药性,而且大多表现为多重耐药,主要集中在3耐至11耐,表明江西地区猪链球菌耐药性比较严重,主要以多重耐药为主。整体上看,江西源致病性猪链球菌对如阿莫西林、头孢类等的常用抗生素保持着良好的敏感性,但是耐药率也比较高,均在10%以上,耐药率高于金卉[16]对122株国内猪链球菌所检测的4%,证明猪链球菌对常用治疗药物的耐药性正在不断增强;对万古霉素敏感程度较高,但是由于此种抗生素毒副作用较大,临床很少使用,一般作为其他药物效果不佳或者无效时的备选用药。青霉素过去作为治疗链球菌病的常用药物,本次试验中多表现为低度耐药,表明猪链球菌对青霉素耐药性正在增强,需要引起注意;本次试验中猪链球菌对克林霉素、红霉素、四环素、庆大霉素、阿米卡星的耐药性最为严重,这与金卉对8株猪链球菌江西分离株耐药性检测结果相似;这些数据表明,猪链球菌国内分离株对大环内酯类和林可胺类等抗菌药物的耐药性比丹麦、瑞典、日本等国家分离得到的猪链球菌更加严重,表明国内外猪链球菌的耐药情况具有差异性[17-19]。伴随着猪链球菌耐药性的不断增强,对于其耐药性的监测也显得尤为重要。本研究所采用的试验方法、试验材料和研究结果都具有一定的科学性,这为江西地区猪链球菌病的防治提供了理论依据。
