条件性基因敲除动物及其在毒理学研究领域的应用进展*
2018-12-28李子南敬海明尤育洲李国君宁钧宇
胡 红 李子南 郑 珊 敬海明 冯 颖 尤育洲 李国君 宁钧宇,2
(1.北京市疾病预防控制中心/北京市预防医学研究中心,食物中毒诊断溯源技术北京市重点实验室,北京 100013)(2. 首都医科大学公共卫生学院,北京 100069)
毒理学是一门实验科学,其主要研究手段是动物实验,旨在将外源化学物对实验动物的毒性反应结果外推至人,以期评价外源化学物对人的危害,为确定安全限值和采取防治措施提供科学依据。随着基因工程技术的发展,大量基因修饰动物越来越多地应用到毒理学实验中。与野生型动物相比,基因修饰动物中特定基因的表达强度改变或功能丧失,可以加速某些疾病的进程(如肿瘤),缩短毒理学试验周期,有助于降低毒理学评价的成本。此外,“有害结局路径(Adverse outcome pathway)”概念的提出将毒理学研究深入到基因、分子层面,而基因修饰动物的出现为探讨毒物对机体的损伤机制提供了便利。
基因修饰动物包括转基因动物、基因敲除动物以及基因敲入动物,在基因敲除动物中,应用Cre-LoxP重组酶系统将基因敲除局限于特定组织、细胞或时间进程中,便可获得条件性基因敲除(conditional knock-out, cKO)动物。相对于传统的完全性基因敲除(conventional knockout)动物,条件性敲除能使基因在时间和空间上的靶位修饰更加明确、精准,效果更加可靠。因此,cKO能避免传统基因敲除动物的不足而用于具有胚胎致死性目的基因的研究,并用于研究基因在特定的组织或细胞中的生理病理功能。随着DNA同源重组与胚胎干细胞等分子生物学技术的发展,条件性基因敲除技术日趋成熟,cKO动物模型大量出现,同时也为科学研究提供了更加广阔的平台。
鉴于条件性基因敲除动物具有如此优越性,在本文中我们主要阐述其原理和发展现状,以及在毒理学领域的应用现状和今后可能的发展方向。
1 条件性基因敲除动物的原理和发展现状
胚胎干细胞的分离培养是成功制作cKO动物的重要基础。1981年,英国科学家Evans和Kaufman提取出了小鼠的胚胎干细胞[1]。在此基础上,1994年Gu等利用Cre-Loxp系统对胚胎干细胞进行改造,完成了第一例条件性基因敲除的研究[2]。时至今日,条件性基因敲除动物制备技术已经发展成熟,其主要步骤可简述如下(图1)[3]:①打靶载体的设计和构建。②打靶载体导入同源的胚胎干细胞(embryonic stem cell, ES),并筛选发生同源重组的阳性ES克隆。③ES显微注射和嵌合胚胎制备,并与Cre工具鼠杂交。④F1代的繁殖和鉴定。
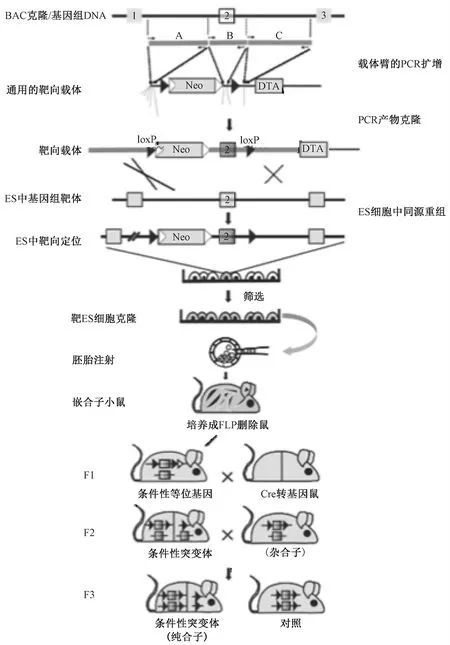
图1 条件性基因敲除动物制备简述
目前,条件性基因敲除小鼠技术日趋成熟,并广泛应用于免疫学[4]、临床医学(心脏病、肝病、糖尿病)[5-8]以及毒理学(神经系统、生殖系统、呼吸系统[9-11])等领域,为这些领域提供了一个全新、强有力的研究手段。
与小鼠相比,大鼠在神经系统、代谢方式等方面与人类更为接近,且由于个体比较大使得其在生物医学实验中更容易进行手术等操作,所以在神经系统、代谢方式的研究上是更理想的动物模型[12]。虽然具备以上优势,但一直未能找到建立大鼠胚胎干细胞株的方式[13],直到2008年,Li等才第一次成功地从大鼠胚胎中提取出胚胎干细胞,这是除小鼠外第二种动物建立的胚胎干细胞株[14]。Abbott曾在报道中预言,在不久的未来大鼠将会代替小鼠重新成为实验室里的重要研究对象[15]。随后,在2010年Tong又首次培育出了肿瘤抑制基因p53基因敲除的大鼠[16]。这一系列的突破使科学家利用大鼠作为动物模型、研究人类疾病的愿望有了实现的可能。由于测序等分子生物学技术的巨大进步,以及大鼠胚胎干细胞分离培养及基因敲除技术的逐步成熟,如今,各种类型的条件性基因敲除大鼠也已广泛应用于科研各领域[17]。目前实现条件性基因敲除的动物还有斑马鱼[18]、秀丽隐杆线虫[19]。
2 条件性基因敲除动物在毒理学中的应用
2.1 外源化学物致癌作用研究
与传统的致癌实验相比,转基因动物和基因敲除动物的诱癌实验一般在3个月左右就可以完成,这些基因突变模型不仅缩短肿瘤的潜伏期,还可增加肿瘤发生率[20],因此更加省时、省力、经济。无疑,基因改造的动物模型在毒理学安全评价中有很高的应用价值,但是在推广应用前还需要进行系统的标准化并逐步完善评价体系。目前条件性基因敲除动物主要应用于致癌机制研究,以明确基因在癌症形成过程中的作用机制。
芳烃受体(aryl hydrocarbon receptor, AhR)主要功能是与外源性芳香烃结合并将其转运进细胞核内,是介导多种环境污染物反应的配体转录因子,比如2,3,7,8-四氯代二苯-并-对二噁英(2,3,7,8-TCDD)、苯并a芘(Benzoapyrene, BaP)。2,3,7,8-四氯代二苯-并-对二噁英(2,3,7,8-TCDD)是迄今为止人类已知的毒性最强的污染物,国际癌症研究中心已将其列为人类一级致癌物。为了深入探讨AhR的生理作用和建立危险性评价的有效模型,Schmidt等利用同源重组建立了AhR的全基因敲除小鼠,发现AhR-/-小鼠出现了不同程度的肝损害,这说明AhR在维持肝的正常生长和发育中起着重要作用[21]。根据Boutros等的研究,AhR自身就影响肝脏392个基因的表达[22]。经过TCDD处理后,在野生型和AhR敲除小鼠中有471个AhR依赖而非TCDD依赖的转录水平变化基因[22]。Cornelis J. Elferink等在条件性敲除小鼠肝脏AhR中,发现一个新的特异性内源性AhR信号通路靶基因Stanniocalcin 2 (Stc2)[23]。因为哺乳动物的Stc2是一种对非折叠蛋白反应(unfolded protein response,UPR)和凋亡具有保护作用的分泌性糖蛋白[24],所以认为AhR调节的Stc2对肝细胞具有一定保护作用。并且Elferink等还发现TCDD能导致AhR与Cyp1a1启动子结合而不能与Stc2结合[23],进一步深化了TCDD的肝脏毒性机制研究。
动物实验研究对于鉴别人类化学致癌物发挥重要作用,尽管目前建立了很多小鼠靶基因突变模型来针对性地分析特定组织的肿瘤生长情况,但是仍没有用来确定化合物潜在致癌性的模型系统。今后仍需建立不同的癌变模型,用以研究致癌物对特定组织的致癌作用。
2.2 发育毒性研究
根据Wilson致畸学基本原理,孕体对致畸因素的易感性依赖于孕体的基因型及其孕体与致畸因素相互作用的方式。在对化合物生殖毒性评价中,通过条件性基因敲除,可对胚胎致死性基因(如:重组人金属蛋白酶10、PTEN、brca1/2等)的表达进行时空特异性控制,以避免出现死胎,并对其它基因相关联的发育毒性进行机制研究。
1960—1962年间沙利度胺作为抗妊娠反应药物应用于临床后,出现8 000例海豹畸形儿,表现为四肢短缺陷、无眼、颚裂、骨骼发育不全、十二指肠和肛门闭锁等,利用cKO动物可更加清晰认识其发育毒性的机制。Bashur等通过Jab1的cKO小鼠和微团培养发现:Jab1是体内早期胚胎肢发育所必须的调节因子,它可能通过“共激活”Y染色体“男性性别决定区族蛋白9”(SRY (Sex determining region Y)-box 9,Sox9)和BMP信号来起作用[25]。Notch信号通路是高度保守的,它对许多组织器官的发育都起着关键作用。电离辐射所导致的骨损伤可能是由于Notch1-4四种受体介导的信号通路[26]。Nantie等利用早期胚胎条件性Notch2敲除发现,Notch2的缺失对早期胚胎垂体的增殖影响不大,但是对产后孕体的维持和增殖至关重要,并且发现Notch信号对胚胎期和出生后的Prop1表达是必须的[27]。总体来讲,cKO动物在发育毒性领域的应用还比较少,经典动物仍是筛选发育毒性的主流,但相关cKO动物能揭示产生发育毒性的机制,并能最终减少实验结果外推的不确定性,具有一定的应用前景。在发育毒性应用的基础上,cKO动物也为化学致突变性的研究提供了有希望的动物模型。
2.3 毒理基因组学研究
毒理基因组学是研究生物体的整个基因组如何对环境有害因素发生反应的一门新兴学科。它利用人类基因组的资料,帮助筛选和鉴别潜在的环境毒物,并在基因组水平上阐明毒作用发生的机制。肝细胞生长因子(Hepatocyte growth factor,HGF/c-Met)在肝再生中的肝细胞存活和组织重构中发挥重要作用。在对肝脏Met条件性基因敲除的小鼠进行慢性CCl4染毒后,c-Met cKO小鼠更加容易发生肝损害并发展成肝纤维化。采用芯片平台对小鼠的各个时间点转录组(基因的RNA表达)进行检测,这可在全基因组的范围内筛选出显著改变的基因。然后用免疫蛋白印迹技术(Western Blot,WB)验证入选的与肝纤维化相关的关键分子的蛋白表达水平,总转录组分析揭示了c-Met(Met proto-oncogene,c-Met)在与肝纤维化关键信号通路中的广泛影响:趋化和炎性信号分子(MCP-1, RANTES, CXCL10)的下调以及其它相关基因的变化如细胞骨架网络的重构(Actb,Tuba1a,Tuba8)、细胞间交流和粘附(Adam8,Icam1,Itgb2)、细胞增殖(Ccng2,Csnk2a,Cdc6,cdk10)以及DNA损伤和应激反应(Rad9, Rad52, Ercc4, Gsta1 and 2, Jun)[28]。
毒理基因组学的近期目标是确定全基因组中对某种有害因素产生应答的基因(信号分子的基因),用于有害结局路径的毒理学和相关疾病的研究;远期目标是建立全基因组与蛋白质组毒性反应知识库,开辟数字毒理学。cKO动物的出现将极大丰富毒理学反应知识库。
2.4 药物的药效及安全性评价
在抗肿瘤药物的研究中,可利用cKO动物对抗肿瘤药物进行危险性分析,评价药物的安全性。人第10号染色体缺失的磷酸酶及张力蛋白同源的基因(Phosphatase and tensin homolog deleted on chromosome 10,PTEN)是人类突变率最频繁的肿瘤抑制基因之一。而PTEN双等位基因敲除的胚胎致死性阻碍了PTEN完全敲除在癌症研究中的应用。在cKO的技术成熟条件下,Mirantes等条件性敲除上皮细胞内PTEN分子,小鼠能很快生成子宫内膜腺瘤、前列腺上皮内瘤样病变、甲状腺增生;他们再将依维莫司连续给予15 d,每天10 μg/g体质量施加于这些小鼠,发现子宫内膜增生和甲状腺增生得到抑制[29]。前列腺上皮条件性敲除PTEN能导致前列腺上皮内瘤,Hafeez等利用此模型研究发现口服白花丹素0.2 mg/g或者0.5 mg/g能抑制前列腺癌的发展,并且在第15周和30周时均没有毒性指征[30]。cKO动物模型的出现为PTEN缺失的肿瘤的抗肿瘤药物研究提供了很好的疾病模型。cKO动物为基因治疗提供了更具体的动物模型,并为新的基因靶点提供更可靠的证据。
这些以cKO动物实验为基础的剂量-反应关系模型不仅整合了分子/生化反应、细胞/组织反应,还提供了发育毒性测定的靶组织剂量的药物动力学信息,并揭示其分子机制。
3 结语
现有研究报导在条件性基因敲除的小鼠中,重组酶诱导剂多西环素不仅删除目的基因,还影响免疫系统,降低回肠中Il1b, Il10, Il18,Tnf, Cxcl1, Cxcl2的表达以及结肠中Il18的表达[31],尽管这有可能使得研究结果的解释复杂化,但条件性基因敲除技术日趋成熟,cKO动物模型也为科学研究提供了更加广阔的平台,目前cKO动物的制作与发展应用日新月异[32-34]。国际基因敲除小鼠协作体(International Knockout Mouse Consortium)的一项新技术——高通量打靶技术,将基因工程鼠的批量生产成为可能,每个月能产生数以百计的基因敲除胚胎干细胞[35]。在许多复杂疾病方面,如心血管和精神疾病,大鼠在建立疾病模型过程中操作更加简单,因此要比小鼠更有优势。随着研究的深入,生物学者通过从整体水平到细胞、分子水平的机制研究之后得到了大量数据,并建立假说,这些假说急需回到动物整体水平加以验证,条件性基因敲除动物的出现给该需求提供了实验的条件。根据现有文献资料,毒理学领域应用cKO动物作为研究对象还不多,但近两年有增加趋势。随着描述性毒理工作的完善,机制性毒理学研究的深入,更多的条件性基因敲除的动物将会应用于毒理学研究领域中,这将给未来的系统化、整体化、综合化的毒理学研究趋势提供可能。
