MXH10/Mo-lpr/lpr鼠在肿瘤诊断与治疗的实验研究
2018-12-28吕誉坤贾立敏李明卿郑金华
吕誉坤 彭 艳 贾立敏 李明卿 郑金华
(1. 哈尔滨医科大学口腔医学院,哈尔滨 150001)(2. 哈尔滨医科大学基础医学院,哈尔滨 150081)
MRL/lpr鼠多用于免疫炎症及红斑狼疮病相关的实验研究[1],也由于其肿大的淋巴结也用于肿瘤淋巴结转移相关研究,但由于其严重的系统性疾病使其寿命缩短,为克服MRL/lpr鼠的寿命限制,MXH10/Mo-lpr/lpr重组鼠应运而生。目前国内尚没有文章对此鼠进行介绍。
1 MXH10/Mo-lpr/lpr鼠的遗传背景
1.1 C3H/lpr近交重组
MXH/Mo-lpr/lpr鼠由MRL/lpr(lymphoproliferation,淋巴增殖基因)和C3H/lpr鼠为祖系,杂交得到的F2代后经连续20代以上的严格兄妹交配培育而成的一组重组近交系。Tanaka等自1994年至今已经繁殖90代[2],其中编号为10的亚系MXH10/Mo-lpr/lpr(图1)与MRL/lpr狼疮鼠相比较具有稳定的全身淋巴结肿大、轻微的肾小球肾炎和血管炎等自身免疫疾病以及更长的寿命[3-5]。

图1 重组近交(RI)鼠MXH/Mo-lpr/lpr的建立原理
1.2 MHC与免疫表型
主要组织相容性复合体(major histocompatibility complex, MHC) 是所有生物相容复合体抗原的一种统称,位于细胞表面,主要功能是绑定由病原体衍生的肽链,在细胞表面显示出病原体,以便于T细胞的识别并执行一系列免疫功能[6]。鼠类的H-2基因位于小鼠第17号染色体,是决定小鼠主要组织相容性抗原H-2抗原表达的基因。这一组紧密连锁的基因群,其编码产物参与抗原递呈和T细胞活化,在免疫应答的启动和免疫调节中发挥重要作用。而MXH10/Mo-lpr/lpr的亲代MRL/lpr和C3H/lpr的MHC的基因均为H-2k单体型[4],它作为单体型将完整地遗传给子代,这确保了MXH10/Mo-lpr/lpr重组近交系间具有相似的免疫表型。
1.3 疾病的遗传方式
很多疾病是由亲代遗传而来,遗传方式可以分为两种,一种是由单一基因的缺失或突变引起的;另一种是由于多种基因的改变致病,且每对致病基因的作用轻微。有文献报道引起小鼠易患肾小球肾炎等自身免疫疾病表型的易感基因座为量变而非质变,其中控制数量性状的基因在基因组中的位置称数量性状基因座 (Quantitative Trait Loci,QTL)。MRL/lpr鼠是由多种易感基因累积相加达到一定程度时引起发病(血管炎、肾小球肾炎、关节炎、唾液腺炎、泪腺炎),也就是易感基因座的累加效应决定遗传表型。Mori等利用PCR法来检测重组近交鼠发病群体中有关血管炎、肾小球肾炎、关节炎、唾液腺炎、泪腺炎的基因序列。通过QTL分析方法发现与MRL/lpr小鼠胶原病有关的易感基因座共24个,其中在鼠基因信息数据库(Mouse Genome Informatics, MGI)中登记的有20个(表1)[3]。
Mori等选择了近亲组中病症较轻鼠进行重组交配,使其后代的肾小球肾炎,血管炎的症状都较MRL/lpr其他亚型更轻,且保留淋巴结肿大和生存周期较长的特征。

表1 MRL/lpr鼠胶原病的易感性位点
2 MXH10/Mo-lpr/lpr鼠的品系特征
2.1 MRL/lpr和C3H/lpr小鼠的特征
MRL/lpr小鼠由 LG/J、AKR/J、C3H / Di 及 C57BL /6 品系小鼠复杂交配产生的[4]。因T 细胞、B 细胞和巨噬细胞出现凋亡缺陷,进而T细胞增生,全身淋巴结肿大,并发生侵蚀性关节炎。半数MRL/lpr小鼠在17~20周就会因肾小球肾炎和肾血管炎而死亡。
C3H/lpr小鼠是由Bagg albino鼠和DBA鼠进行杂交得到的淋巴增殖基因小鼠。此鼠也发生进行性淋巴结肿大,但不患血管炎、关节炎、肾小球肾炎等自身免疫性疾病,该鼠死因不明[6-7]。主要用于神经、免疫和炎症方面的研究。
2.2 MXH10/Mo-lpr/lpr鼠的特征
MXH10/Mo-lpr/lpr鼠在6周龄时可见外周淋巴结均明显肿大,淋巴结直径平均可达到10 mm(图2)。由于缺乏lpr基因,小鼠体内的IgM和IgG血清水平增高,但仍明显低于MRL/lpr小鼠,这也限制了关节炎的病理严重程度。MXH10/Mo-lpr/lpr鼠的自身免疫症状如关节炎、血管炎、肾小球肾炎和唾液腺炎也都较MRL/lpr小鼠轻,即不发展成严重的自身免疫病,因此它们的生命跨度更长一些[8]。
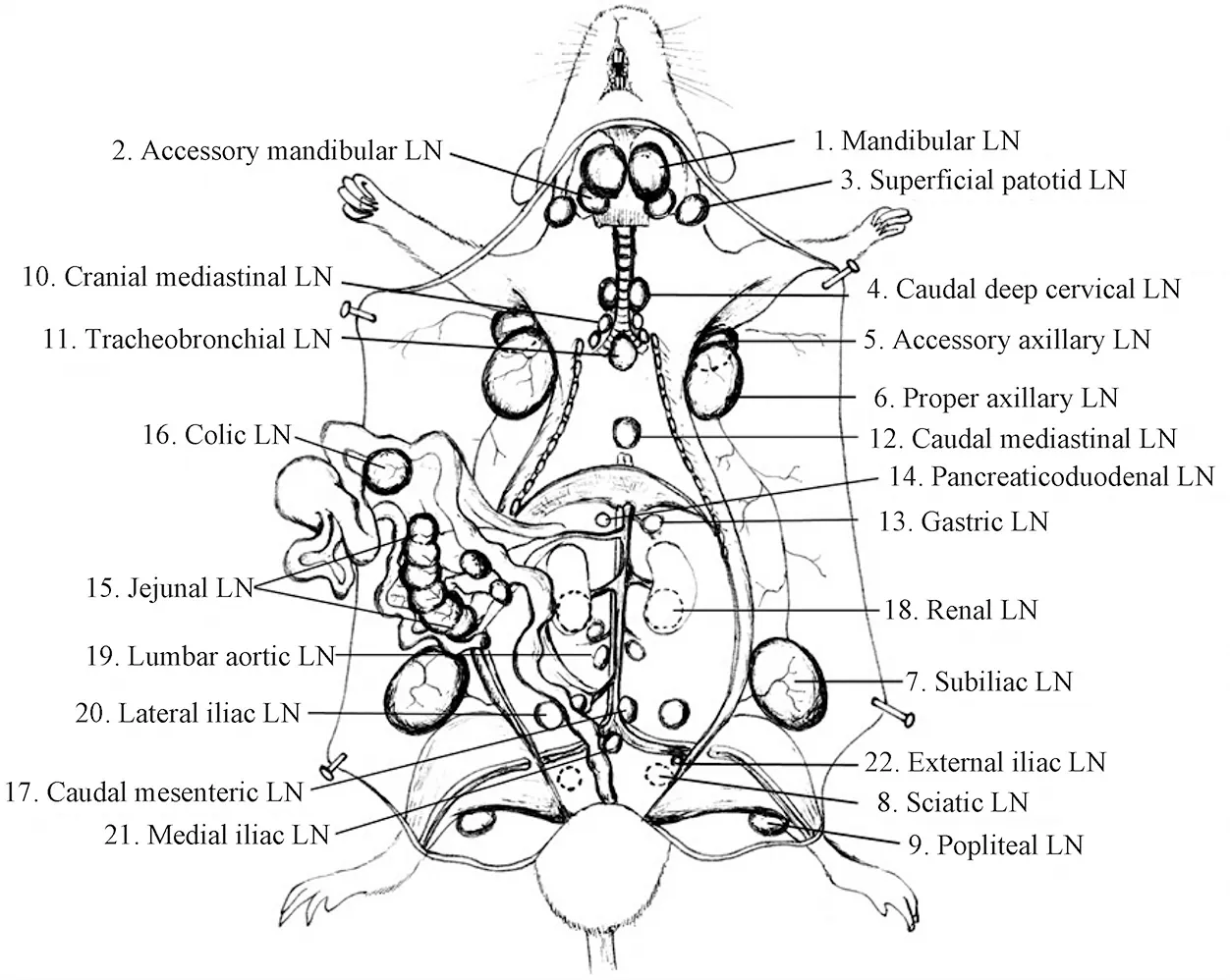
图2 MXH10 / Mo / lpr鼠淋巴结的位置示意图及淋巴结的大小
3 MXH10/Mo-lpr/lpr鼠在肿瘤诊断与治疗中的应用
众所周知,肿瘤、心血管疾病和传染病是发病率和死亡率最高的三类疾病。其中肿瘤是威胁人类生命的头号杀手。我国癌症总体发病率和死亡率呈现上升的趋势。据2013年全国肿瘤登记结果显示,目前癌症发病率235/10万,死亡率144.3/10万,防治形势十分严峻。转移到局部淋巴结是肿瘤播散的一个重要步骤,与远处转移(比如到肝或肺)相比常发生在肿瘤发展的相对早期阶段。淋巴结转移的准确评估对于肿瘤的分期和治疗计划的制定非常有帮助。而目前实验用小鼠淋巴结的直径为1~2 mm,使淋巴结转移动物实验受到局限。MXH10/Mo-lpr/lpr鼠的外周淋巴结1 cm的直径与人的淋巴结大小相似,而且淋巴结肿胀的大小和起始时间是稳定且可预测的,有利于观察淋巴结的内部结构及通过淋巴结的成像及治疗,并有利于对实验的操控和掌握。
3.1 建立淋巴结及远隔脏器肿瘤转移模型
Shao等将能够稳定表达荧光素酶基因的KM-Luc/GFP恶性纤维组织瘤样细胞注射到MXH10/Mo-lpr/lpr鼠的髂骨下淋巴结(SiLN),通过体内生物发光成像系统,3~9 d内能够检测到固有腋淋巴结(PALN)和肺内的肿瘤转移,开发了一个新型的淋巴结和肺转移实验的动物模型[9]。
3.2 为淋巴结癌转移的可视化诊断提供适宜的研究模型
在临床中通过CT和MRI确定肿瘤患者淋巴结直径,直径大于10 mm是诊断淋巴结转移的最重要的影像学标准。然而,这种基于尺寸判断淋巴结有无转移常常会导致误诊,例如正常尺寸的淋巴结可能已有转移,或增大的淋巴结可能只是一种反应性肿大。
最近,Li等人向MXH10/Mo-lpr/ lpr鼠SiLN内注射表达荧光素酶的肿瘤细胞后,应用对比增强高频超声联合声学脂质体对小鼠PALN内的血管进行三维重建,观察到在淋巴结癌细胞转移中血管容积和密度的变化要早于淋巴结体积大小的变化[10-11],为癌淋巴结转移的早期检测提供新的诊断标准。
3.3 淋巴系统给药治疗淋巴结转移的研究
当癌症转移到局部淋巴结时,淋巴结切除术仅限于那些可以承受手术、身体状况良好的病人。对于不适合手术切除的病人,临床主要采用化学治疗,给药的方式多采用静脉注射,但很难清除残余在淋巴管和淋巴结内的肿瘤细胞。若将抗癌药物直接注射到区域淋巴结内,利用淋巴流速慢于血液这一特性可使药物在淋巴系统内保持高浓度并且能够长时间与肿瘤细胞接触,增强对淋巴结转移治疗的有效性。但是目前常用于进行研究的荷瘤小鼠的淋巴结直径只有1~2 mm,即使在肿大的情况下也只有3~5 mm,注入药物难免会发生外渗。由于MXH10/Mo-lpr/lpr鼠的淋巴结的直径可达1 cm,允许我们在超声引导下将药物精确并重复地注射入淋巴结,这为肿瘤淋巴管治疗提供实验基础。
Kodama等研究发现向MXH10/Mo-lpr/lpr鼠内SiLN内注射的荧光分子TOTO-3和声学脂质体,可经淋巴管到达PALN[12],为淋巴管药物运输提供实验模型。另外有研究显示将药物和纳米微泡混合后注入瘤周,药物可通过淋巴管到达肿瘤的引流淋巴结,之后再加超声辐射,可用于解决癌淋巴结转移的治疗[13]。为临床治疗癌淋巴结转移提供了一种新的思路。
Kodama等发现与静脉化疗相比,在超声引导下向MXH10/Mo- lpr/lpr鼠荷瘤SiLNs内注射CDDP(顺铂)进行淋巴内化疗并联合超声和纳米/微泡,通过对比增强高频超声 (CE-HFUS) 成像系统测量荷瘤淋巴结的体积和血管密度并经组织病理学评估,结果显示治疗后荷瘤淋巴结体积和血管密度下降,具有显著的抗肿瘤效果[12]。
上述研究显示淋巴结内注射化疗药物的淋巴药物输送系统应该是一个可行的方法,可清除残余在淋巴管和淋巴结内的肿瘤细胞,而MXH10/Mo-lpr/lpr鼠为这一系列研究提供很好的动物模型。
4 问题及展望
从重组近交鼠亚系MXH10/Mo-lpr/lpr形成至今,在不断对这种小鼠品系的特性和机能日益了解的同时,由于其较长的寿命及较稳定的淋巴结肿大的特性,已经运用于基础医学和转化医学的研究中。但由于MXH10/Mo-lpr/lpr鼠还没有经过广泛的使用,故其在不同领域的使用还需要进一步验证。根据现阶段其在诊断和治疗肿瘤淋巴结转移研究的探索使用,认为在不久的将来,有可能将通过淋巴药物输送系统和成像技术来进行肿瘤诊断或治疗的方法推广到临床,进一步提高肿瘤患者的诊断率和生存时间。由此可见MXH10/Mo-lpr/lpr鼠将会在人类免疫及红斑狼疮疾病的致病机理研究和肿瘤淋巴结转移的诊断和治疗领域中具有广阔的应用前景。
