三白脂素-8抑制缺氧诱导因子-1α对肾癌细胞解偶联功能的影响
2018-12-28张永春董安涛杨锦春
张永春,谷 江,董安涛,杨锦春
(1.武警贵州总队医院外二科,贵阳 550005;2.贵州医科大学附属医院泌尿外科,贵阳 550004)
缺氧诱导因子1α(hypoxia-inducible factor 1 alpha,HIF-1α)是恶性肿瘤细胞在抗乏氧环境下保持增殖的重要基因[1],目前,通过抑制HIF-1α达到抑制恶性肿瘤生长的研究正成为研究热点[2]。而在HIF-1α的有效抑制剂中,三白脂素-8(manassantin A,Man A)是一种由三白草提纯而来植物制剂,对HIF-1α的特异性抑制作用很强[3],而对正常细胞的毒性作用很小[4]。Man A可影响线粒体呼吸传递链,抑制细胞线粒体复合物的功能,并降低ATP的产量[3]。线粒体内膜上的线粒体解偶联蛋白2(uncoupling protein2,UCP2),通过对线粒体膜通透性转运孔(mitochondrial permeability transition pore,mPTP) 的稳定调节,使线粒体产能电势(mitochondrial membrane potential ΔΨm)达到动态平衡平衡,以此调节ATP的生成[5],并与恶性肿瘤的增殖关系密切[6]。鉴于Man A和UCP2对细胞产能存在可能的相关性,因此本研究将Man A和UCP2一并引入研究,观察Man A对肾癌细胞的抑制作用并与UCP2的解偶联功能是否存在联系,并探讨其机制。
1 材料与方法
1.1 主要材料
肾癌细胞株(GRC-1)购于上海弗雷堡生物公司,Man A由武警后勤学院刘英福博士惠赠,RPMI1640购于Hyclone公司,MTT购于Sigma公司,总RNA提取试剂盒购于Fermentas公司,ELISA试剂盒购于R&D公司,G418购于Solarbio公司,DH5α菌种为贵州医科大学干细胞实验室提供相关的限制性内切酶、脂质体LipofectamineTM2000转染试剂、质粒抽提试剂盒均购于Invitrogen公司。
1.2 方法
1.2.1细胞培养 25 cm2培养瓶中将肾癌细胞株置入,使用含10%胎牛血清、1%青霉素、链霉素的RPMI1640培养液,培养瓶外部环境为5%CO2、37 ℃。换液频率为每2~3天1次,或消化传代每2~3天1次,当细胞培养生长为对数期时进行后继试验。
1.2.2质粒构建及其鉴定
1.2.2.1HIF-1α/pcDNA3.0载体的构建 氯化钙法制备DH5α大肠杆菌感受态细胞,保存于-70 ℃低温冰箱。HIF-1α基因的CDS区序列(NM-001530)于NCBI获得,引物设计使用Primer5.0软件。上游5′-AAA AAT CTA GAA TGG AGG GCG CCG GCG GCG CGA ACG-3′,下游为5′-CCC CCG GAT CCT CAG TTA ACT TGA TCC AAA GCT CTG-3′,引物合成自大连宝生物公司。 PCR扩增及反应条件:预变性94 ℃、3 min,变性94 ℃、30 s,退火53 ℃、30 s,延伸72 ℃、1 min,全程共35个循环。载体及目的基因分别经BamH1和HindⅢ进行双酶切,将载体与酶切基因按3∶1的摩尔比进行过夜连接,外界环境为16 ℃,设立质粒阳性和阴性对照。取4 μL将连接产物接种于100 μL的DH5α感受态细胞中。挑取单菌落扩增并抽提质粒,使用限制性内切酶BglⅡ进行单酶切鉴定,将重组质粒命名为HIF-1α/pcDNA3.0。
1.2.2.2鉴定重组质粒序列 使用3730XL型DNA自动测序仪测序,由大连宝生物公司进行。
1.2.3质粒转染 肾癌(GRC-1)细胞的转染由脂质体介导:细胞株于25 cm2培养瓶中培养,汇合度达到90%后使用胰酶消化,于24孔培养板接种,加入无双抗RPMI1640及10%胎牛血清,48 h后细胞密度约80%~90%。A液(于147 μL无双抗、无血清的RPMI1640培养液中加入3 μL质粒,静置5 min)、B液(于144 μL无双抗、无血清的RPMI1640培养液中加入6 μL LipofectamineTM2000,静置5 min),C液(A液和B液混合为C液)。将C液移入培养板,密度为每孔100 μL,加入无双抗、无血清的RPMI1640培养液,密度为每孔400 μL。培养6 h后换含10%胎牛双抗、血清的RPMI1640培养液,24 h后按1∶10给予传代,24 h后加入含G418的维持液进行筛选,每3~5天换液1次。
1.2.4细胞分组与干预 对HIF-1α/pcDNA3.0、空载体质粒使用脂质体LipofectamineTM2000转染,对照组为肾癌(GRC-1)细胞,转染效率提示转染成功后,构建高表达HIF-1α基因的转染组肾癌细胞,未行基因干预的GRC-1细胞定义为非转染组,实验组及对照组分别使用密度为0、0.1、0.2、0.4 μmol/L的Man A溶液进行干预并依次命名为对照组及低、中、高剂量组。
1.2.5检测实验设计指标
1.2.5.1半定量PCR检测GRC-1细胞内UCP2、HIF-1α的基因表达 待25 cm2培养瓶细胞汇合度达到90%后行分组处理,提取GRC-1细胞总RNA,检测RNA的完整性与浓度,逆转录及合成cDNA。引物序列如下所示:β-actin(正向5′-CCC TGG ACT TCG AGC AAG AGA T-3′,反向5′-GTT TTC TGC GCA AGT TAG G- 3′),UCP2(正向5′-GAC CTA TGA CCT CAT CAA GG-3′,反向5-GTT TTC TGC GCA AGT TAG G-3′),HIF-1α(正向5′-TCC AGC AGA CTC AAA TAC AAG AAC-3′,反向5′-GTA TGT GGG TAG GAG ATG GAG ATG-3′),反应条件为:预变性94 ℃、3 min,变性94 ℃ 、30 s,退火53 ℃ 、30 s,延伸72 ℃、 1 min,进行35个循环,终止反应条件为72 ℃、 5min;于2%琼脂糖凝胶中对PCR产物进行电泳,经Image J软件行条带分析,将检测基因与β-actin的光密度比值代表所检测基因的半定量表达。
1.2.5.2ELISA检测UCP2、HIF-1α的蛋白表达 使用细胞裂解液及PMSF裂解细胞,离心半径8.5 cm、12 000 r/min对细胞离心5 min,取上清液按每孔50 μL滴加,分别将相应孔板设空白孔、标准孔及待测样品孔,上述检测严格按照试剂盒说明书的提示操作。
1.2.5.3细胞增殖活性的检测 将细胞接种于96孔板,密度约104个/孔,均设6个复孔,分组处理24 h后吸弃原有培养基,加5 μg/L的MTT 20 μL及无血清培养基80 μL,孵育4 h(环境为37 ℃)后吸弃培养孔内液体,加入二甲亚砜150 μL后低速震荡(震荡时间为10 min),酶标仪(490 nm)检测其吸光度(A)值。
1.2.5.4细胞内ATP水平的检测 分组处理细胞并消化离心后,加入520 μL无血清培养基,再加入520 μL 2%的三氯醋酸后冰浴、离心,时间为5 min。取300 μL上清液、300 μL NADH液、10 μL磷酸甘油醛脱氢酶一磷酸甘油激酶进行混合,检测NADH下降的A值,根据标准曲线计算ATP的值。
1.2.5.5线粒体提取及鉴定 实验步骤均于冰面上进行,25 cm2细胞培养瓶中培养细胞汇合度约80%后分组处理,消化离心,裂解,离心半径9.3 cm、4 000 r/min条件下离心10 min。取上清液,离心半径8.9 cm、 10 000 r/min条件下离心15 min后弃上清液,收集所得沉淀。将沉淀均匀涂抹于载玻片,加詹纳斯绿B染液(0.02%),浸染10 min,用10×40倍的高倍镜观察,重复3次。
1.2.5.6mPTP开放程度的检测 使用上述方法制备线粒体悬液。将3 mL测定介质P分别加入分组后的线粒体悬液,摇匀。对照组加入的测定介质P为4 mL,分光光度计(752N型)于540 nm测定A值,mPTP开放程度与A值呈负相关。
1.2.5.7ΔΨm的检测 制备及分组线粒体悬液同上。将6.6 μL Rh123加入线粒体悬液中,避光孵育30 min(37 ℃水浴箱),荧光分光光度计检测其(激发光:480 nm,发射光:525 nm)荧光强度,ΔΨm的大小与荧光强度呈负相关。
1.3 统计学处理
2 结 果
2.1 对HIF-1α重组质粒的鉴定结果
3730XLDNA测序仪对送检标本进行测序后符合Genebank上的序列,见图1。

图1 HIF-α/pcDNA3.0质粒的部分测序结果
2.2 评价GRC-1细胞质粒转染的效率
转染组、非转染组的HIF-1α半定量表达分别为0.71±0.09、0.42±0.03。转染组较之非转染组显著增高(P<0.01),证明高表达HIF-1α的肾癌细胞已成功构建,见图2。
2.3 各实验指标的检测结果
2.3.1HIF-1α、UCP2的基因表达结果 转染组较之非转染组,HIF-1α基因的表达量显著增高(P<0.05)。转染组细胞UCP2基因的表达量虽低于非转染组,但差异无统计学意义(P>0.05),见图3。
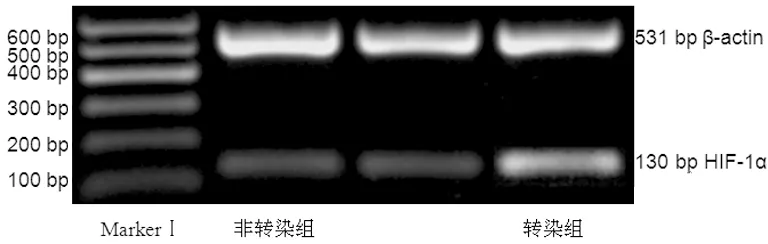
图2 HIF-1α的PCR电泳图

图3 HIF-1α、UCP2基因的表达结果
2.3.2Man A干预各组细胞后检测HIF-1α和UCP2基因表达 非转染组和转染组细胞较之对照组,HIF-1α基因在各组细胞的表达随着Man A剂量的增加而下降,差异均有统计学意义(P<0.05)。而UCP2基因的亦随着Man A剂量的增加而逐渐下降,非转染组可在高剂量组出现显著下降(P<0.05)。转染组在中、高剂量组均出现了显著下降(P<0.05),见表1和图4。

A:非转染组HIF-1α;B:转染组HIF-1α;C:非转染组UCP2;D:转染组UCP2

表1 Man A对各组肾癌细胞内HIF-1α、UCP2基因表达的影响
a:P<0.05,与对照组比较;b:P<0.05,与低剂量比较;c:P<0.05,与中剂量组比较
表2 Man A对各组肾癌细胞内HIF-1α、UCP2蛋白表达的影响
a:P<0.05,与对照组比较;b:P<0.05,与低剂量比较;c:P<0.05,与中剂量组比较
2.3.3Man A干预细胞后HIF-1α、UCP2的蛋白表达水平 非转染组和转染组细胞较之对照组,HIF-1α的蛋白表达量随Man A剂量的增加而下降,非转染组除低剂量组外,其余各组HIF-1α蛋白表达量差异均有统计学意义(P<0.05);与对照组相比,非转染组和转染组细胞各剂量组UCP2蛋白的表达量,随着Man A剂量的增加而逐渐下降,但均仅在高剂量组出现明显差异(P<0.05),见表2。
2.3.4Man A干预各组细胞后检测细胞内ATP水平 非转染组和转染组细胞较之对照组,细胞内ATP水平随着Man A剂量的增加而下降,在高剂量组出现明显差异(P<0.05),见表3。
表3 Man A对各组细胞内ATP水平的影响
a:P<0.05,与对照组比较
2.3.5Man A干预各组细胞后检测细胞增殖活性 各实验组较之对照组,其A值均增高,且随着Man A剂量的增加而逐渐下降,两组细胞在中、高剂量组均出现显著下降,差异有统计学意义(P<0.05),见表4。

表4 Man A对各组肾癌细胞增殖活性的影响
a:P<0.05,与对照组比较
2.3.6线粒体在镜下的形态学鉴定 根据染色(詹纳斯绿B)结果显示:细胞中提取的线粒体在外形上呈圆形、椭圆形和杆状,见图5。
2.3.7Man A干预各组细胞后mPTP的变化情况 与各自的对照组相比,两组细胞随着Man A给药浓度的逐渐增加吸光度逐渐降低。非转染组的中、高剂量组,转染组3个实验组差异均有统计学意义(P<0.05)。A值在各转染组中显著高于相同剂量非转染组(P<0.05)。
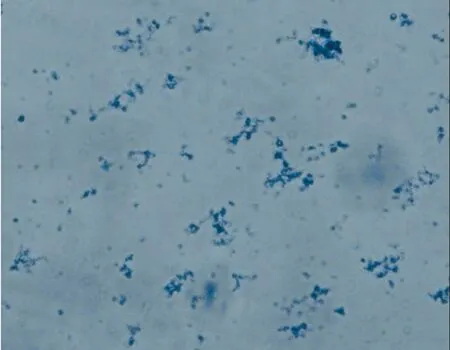
图5 线粒体的镜下染色(×400)

组别n 非转染组A值转染组A值对照组60.097±0.0240.253±0.029 低剂量组60.092±0.0160.194±0.033a中剂量组60.075±0.028ab 0.141±0.046ab高剂量组60.063±0.031ab 0.093±0.027abc
a:P<0.05,与对照组比较;b:P<0.05,与低剂量比较;c:P<0.05,与中剂量组比较
2.3.8ΔΨm在Man A干预细胞后的变化 各实验组随着Man A给药浓度的增加,其荧光强度亦增强,与对照组比较,中、高剂量组差异有统计学意义(P<0.05),见表6。

表6 细胞行Man A干预后ΔΨm的变化
a:P<0.05,与对照组比较;b:P<0.05,与低剂量比较;c:P<0.05,与中剂量组比较
3 讨 论
恶性肿瘤的能量代谢、细胞增殖、凋亡等在很大程度上依赖HIF-1α来维持[7]。机体低氧状态时,HIF-1α生成增加,以维持细胞的氧自稳和能量代谢平衡[8]。HIF-1α是公认的肿瘤适应低氧环境重要调节剂[9],缺氧环境可促使HIF-1α在细胞中稳定表达,促进肿瘤发生转移等恶性倾向,产生放化疗抗药性[10]。目前,国内外针对有效抑制HIF-1α的功能,达到抑制肿瘤生长的研究逐渐成为热点[2],但尚未针对肾癌细胞进行过相关研究。因此,本实验将HIF-1α的植物抑制剂Man A引入了肾癌细胞的研究中。
Man A于1983年首次被报道从三白草中提取出的一种双新木脂体,在亚洲国家作为传统中药运用于治疗水肿、黄疸、淋病等多种疾病[12]。多项研究均证实Man A对HIF-1α有强烈的抑制作用[3],有研究报道发现Man A可影响线粒体呼吸传递链(ETC),抑制细胞线粒体复合物的功能,并降低ATP产量[5]。线粒体解偶联蛋白2(UCP2)是线粒体内膜上的一种质子转运蛋白,介导跨线粒体内膜的质子流,使呼吸链与ATP产生解偶联[13],是线粒体呼吸功能、ATP生成的关键调节蛋白。基于Man A、UCP2均对线粒体内外膜电势、ATP生成等有生理作用具有功能上的交叉点,故本实验将UCP2作为Man A干预肾癌细胞后的观察指标,判断UCP2是否在Man A干预肾癌细胞后出现改变,以资推断Man A抑制HIF-1α后,UCP2是否参与其作用机制。
实验结果提示,成功构建高表达HIF-1α的肾癌细胞株中UCP2的基因表达量出现了上升趋势,但未出现显著差异,提示HIF-1α的表达增高和UCP2无明显关系;当实验中给予Man A进行干预后,HIF-1α的基因及蛋白表达量均出现显著下降,符合Man A作为HIF-1α阻断剂的理论前提。UCP2的基因及蛋白表达量出现下降趋势,特别是在高剂量Man A干预后出现了显著下降,这可能与Man A影响了线粒体膜电势,并降低ATP的生成,负反馈于UCP2造成,亦可能是Man A直接作用于UCP2,降低其基因及蛋白的表达。但此项结果尚需对UCP2的基因进行调控并完善其他指标后才能明确判定。在检测细胞ATP产量时发现,随着Man A干预剂量的不断增加,两组细胞的ATP水平逐渐减少,在高剂量组可出现显著下降,符合以往研究对Man A生理功能的描述。为了探讨Man A对肾癌细胞ATP产量影响的具体机制,本研究检测了线粒体解偶联功能相关指标mPTP及ΔΨm。实验结果提示,Man A可提高mPTP开放程度,并导致ΔΨm的降低,并因此降低了线粒体内外膜电势,造成ATP产量的减少。这一现象与UCP2表达降低的结果是符合的。线粒体解偶联功能的改变可能是Man A抑制了UCP2的表达造成,亦有可能是Man A直接作用于线粒体后导致,且并不能判断是否因Man A抑制了HIF-1α后带来的产能影响。需进一步实验明确。
HIF-1α有利于肾癌细胞在低氧环境下的生存[14],而找到抑制HIF-1α的药物对于肿瘤的生长势必能产生负向调节的作用。Man A属三白草属提取的植物制剂,目前有较多的萃取及合成方法[15],长期运用于其他疾病的治疗,未见不良反应的报道。结合以往研究以及本实验的结果证实,Man A可有效抑制HIF-1α及肾癌细胞的生长和产能,其具体作用机制与线粒体解偶联功能关系密切,但其具体作用与UCP2的关系尚需进一步研究证实,这也为本课题组下一步的实验提出了方向和要求。
